FILO PORIFERA
PORÍFEROS OU ESPONGIÁRIOS
As principais esponjas de banho do Mar Egeu em seu habitat (linha superior) e após o processamento, ou seja, remoção de tecido vivo (linha inferior). (A, B) Spongia officinalis morfotipo adriatica; (C, D) morfotipo mollissima de Spongia officinalis; (E, F) Hippospongia communis (Fotos de T. Dailianis). (Voultsiandou et al., 2011)
Os poríferos, também chamados de espongiários, são animais aquáticos, encontrados tanto em ambientes marinhos quanto de água doce. São organismos conhecidos e utilizados como esponjas de banho desde a antiguidade, foram incluídas já no primeiro tratado de classificação dos organismos vivos, escrito em 350 a. C. por Aristóteles (sec. IV a.C.).
A primeira declaração sobre a pesca foi de Oppianus Cilicius (século II a.C.) e inclui notas sobre o estilo de vida e a dieta dos pescadores de esponjas, e sobre seu terror de serem mortos e comidos por tubarões.
Aristóteles (350 a.C.) em suas descrições morfológicas e ecológicas detalhadas sobre esponjas, relatou também um peculiar "tubo em forma de nariz de elefante" que permitia aos pescadores esponja respirar durante o mergulho (His-toria animalium, I, 1; V, 16; VIII, 1; IX, 14, 32, 44; De partibus animalium, IV, 5).[Aristotle reported also a peculiar ‘elephant nose-like tube’ that allowed sponge fishermen to breathe during diving (Historia animalium, I, 1; V, 16; VIII, 1; IX, 14, 32, 44;De partibus animalium, IV, 5).]
Esponjas de banho são coletadas e usadas no Mar Mediterrâneo desde os tempos pré-históricos. Representações de esponjas em vasos que datam do final da Idade do Bronze foram encontradas nas ilhas do mar Egeu, Creta e Melos (Figura com os golfinhos, abaixo), enquanto muitos registros sobre esponjas ocorrem na literatura grega clássica.
Oppian (c. séc II a.C.) em sua Halieutica (5.612) dá uma descrição detalhada do procedimento de colheita de resposta por pescadores de esponja: suas orações a Apolo antes de mergulhar, a corda grossa em volta da cintura, o peso de chumbo para permanecer debaixo d'água, a foice para cortar esponjas e sua luta para emergir o mais rápido possível depois de ter colhido as esponjas pretas que cresciam nas rochas. Dioscorides (séc. I AD) no De Materia Medica descreve o processo de limpeza, branqueamento e secagem das esponjas coletadas para torná-las adequadas para o uso. O uso de esponjas na antiguidade grega foi pesquisado detalhadamente por Voultsiadou (2007).
O uso das esponjas foi relatado nas civilizações egípcia e fenícia. As decorações de "moldes de esponja" nas paredes da casa da rainha em Knossos (1900-1750 a.C.) comprovam historicamente o primeiro uso de esponjas durante a cultura Creta-Minóica. A "pintura com esponja" é uma prática antiga bem conhecida, ainda utilizada, de decoração de paredes por uma esponja redonda Hippospongia communis (Lamarck, 1813), embebida em tinta e aplicada na parede de forma aleatória, para produzir o efeito decorativo desejado (Welsh, F.S., 1975).
Representação de esponjas em localidades pré-históricas do Mar Egeu. (A) Esponjas na borda superior e inferior do "afresco dos golfinhos" em Knossos, Creta, 1700 a.C., de acordo com Evans (1930); (B) Parte do "afresco de peixe voador" na Caverna Phylakopi, Ilha Melos, 2000–1550 a.C., mostrando uma esponja de banho no chão; (C) Vaso de argila da caverna Kamares no centro de Creta, 1900–1700 a.C. A última representação foi feita por Evans (1921), que afirmou que os objetos retratados eram esponjas fósseis, enquanto segundo Arndt (1935) são mais provavelmente esponjas de banho recentes. (Voultsiadou et alii, 2011)
As esponjas têm sido representadas de várias maneiras na cerâmica grega (765-755 a.C.) como objetos de "símbolo de status" ou em cenas em banhos nas termas.
Homero (séculoVIII - VI a.C.) refere-se às esponjas como ferramentas higiênicas em seus poemas Yliada (XVIII, 414) e Odyssea (I, 111; XX, 151; XXII, 22, 439, 453).
Aristófanes (405 a.C., XIV, 60) [6], Platão (360 a.C., XIV), Ateneu Naucratita (170-230 a.C., I, 32) e outros poetas ou filósofos também relataram diferentes usos de esponjas e sua difusão na Grécia antiga.
Sínteses históricas sobre esponjas gregas foram realizadas recentemente. A literatura latina da Idade Romana Clássica também relata a história natural das esponjas (Plinius, 23-79, XI, 129), enquanto outros autores escreveram sobre o uso da esponja principalmente na agricultura e culinária por ex.: Cato, ca. 160 a.C., CLXII, 3; Columela, ca. 65 DC, XI, 3, 43; Apicius, 230 DC, I, 26).
Cícero (56 a.C., CXXII) [16] usava o verbo "spongiare" no sentido de lavar ou limpar. Cada legionário durante o perído do Império Romano recebia esponjas para serem inseridas sob seu próprio capacete e armadura, e também usadas para cosméticos e cuidados pessoais e para beber. É para esse uso comum dos soldados romanos que podemos ler: "... e imediatamente um deles correu, pegou uma esponja, encheu-a de vinagre, colocou-a sobre uma cana e deu-lhe de beber ... "(Matthaeus, século 1 aC, XXVII, 48).
Esponjas embebidas de mel também eram usadas como sugadores de bebê, e embebidas alternadamente em água morna e fria eram amplamente aplicadas na hidroterapia. As esponjas também são consideradas alimento humano. Aldrovandi, na página 585 de seu "De reliquis animalibus exanguibus", relata "Tethyae" comestível, representada nas ilustrações como esponjas com o habito típico de espécies dos gêneros Tethya, Suberites e provavelmente Chondrosia.
No século 19, Chondrosia reniformis Nardo, 1847, conhecido na Itália com o nome trivial mais comum "rognone di mare" (rim do mar), era vendido no mercado de Trieste (Itália) como "fegato di mare"(fígado do mar).
Para coletar nafta da superfície do mar (a) é um uso realmente incomum de esponjas documentado por Stradanus em "Venationes Ferarum"; (b) na Idade Média, a "esponja soporífica" era amplamente usada como anestésico por cirurgiões árabes e europeus; esta técnica ainda estava em uso no final do século 18 (c).
Esponjas envoltas em seda e com um cordão, usadas pelos antigos judeus, foram consideradas o anticoncepcional mais eficaz no passado. As "esponjas vaginais", embebidas em suco de limão diluído e vinagre, e inseridas antes da relação sexual como método de barreira de contracepção, foram amplamente utilizadas ao longo de muitos séculos. Em 1823, a primeira campanha de controle de natalidade do neo-malthusiano Francis Place foi aberta na Inglaterra com conselhos anticoncepcionais recomendando a inserção pré-coital de uma esponja na vagina. Desde então, a “esponja anticoncepcional”, popularizou-se até a primeira metade do século 20 (1920-1960) (lembrando que a pílula anticoncepcional foi comercializada pela primeia vez em maio de 1960). Em 1983, uma ferramenta sintética moderna, contendo espermicida, a "esponja de hoje" foi introduzida nos Estados Unidos.
Na Roma antiga, aqueles que faziam suas necessidades em uma latrina pública possivelmente usavam um tersorium para se limpar. O artefato antigo consistia em um bastão que continha uma esponja embebida em vinagre ou água salobra na ponta. Ele é mencionado em toda a literatura romana, inclusive em uma passagem inesquecível e terrível de uma carta do filósofo Sêneca ao oficial romano Lucilius que relata o suicídio de um gladiador alemão que preferiu enfiar em sua garganta um bastão de madeira com uma esponja na ponta “dedicado aos usos mais vis” do que ir para a arena e ser devorado por um animal selvagem.
Segundo fontes antigas, os romanos usavam um bastão com uma esponja na ponta conhecido chamado tersorium (réplica moderna acima). Os arqueólogos não têm muita certeza, no entanto, se o objeto era utilizado para limpar o banheiro ou pelas pessoas que usavam o banheiro (Blakemore, 2020).
A placa 86 (de uma gravura em metal) do "Venationes Ferarum, Avium, Piscium" de Jan Van der Straet (Figura acima letra a) mostra um emprego incomum de esponjas documentando o uso de esponjas para coletar nafta da superfície das ondas, conforme sugerido pelo texto original da gravura em cobre: "Gênero Naphtha Bituminis est liquidi: in mare manta Montibus e Siculus, fluidisque sobrenatat undis: Spongia eam excipiunt Nautae, expressamque recundunt Ollis, ut varios hominum seruetur in usus". Quanto à localidade onde esta atividade foi realizada, alguns Antiquários vendedores de Gravura (por exemplo, Galeria Philographikon, Rottenbuch, Alemanha) sugerem, com cautela, a costa norte da Sicília.
As esponjas comerciais cobriam uma ampla gama de usos. Eles eram tradicionalmente usados em cirurgia, desde a Idade Média. A técnica para administrar anestesia inalatória por uma "esponja soporífica" é genuinamente árabe e fui comumente utilizada na época do cirurgião Ibn Al Koff (1232-1286).
A "esponja soporífera" embebida de suco de haxixe, papaver e hiocimina, e depois seca ao sol, era umidificada novamente quando solicitada e colocada no nariz do paciente (Figura 1) para favorecer a liberação e absorção do anestésico pelo membranas mucosas para induzir sono profundo e alívio das dores cirúrgicas. Na Europa, no final do século XII, Nicolau de Salerno mencionou a inalação de vapores da "esponja soporífera".
O frade dominicano Teodorico de Cervia (1205-1298) (também conhecido como Teodorico Borgognoni de Lucca) foi o pioneiro da anestesia em 1267 em Bolonha. Filho de um cirurgião dos cruzados (Hug de Lucca), Teodorico defende o uso de esponjas embebidas em narcótico em sua famosa "Cyrurgia seu filia principis" tendo sua primeira sido publicada em Veneza no ano de 1498.
A receita (prescrição) européia era bem diferente da original árabe. Uma esponja tinha que ser fervida dentro de uma mistura em um recipiente de latão com uma proporção específica de ópio, cicuta e suco de mandrágora, hera e amora verde (unripe mulberry), até que tudo fosse reduzido e absorvido, e então aplicado nas narinas do paciente. Para acordar o paciente novamente, após a cirurgia, uma esponja cheia de vinagre deve ser aplicada no nariz.
Arnaldo de Villanova (Arnaldus Villanovanus, ca. 1238-1310), um alquimista, astrólogo e mágico, relata que variações na "spongia somnifera" eram bastante comuns nos séculos IX ao XIV, e eram usadas ainda no século XIX ( Figura 1). Em síntese, as esponjas representam um patrimônio histórico e cultural muito antigo mediterrâneo. O uso de "esponjas de banho", inicialmente comum entre gregos e romanos, foi amplamente estendido em toda a área circun-mediterrânea e espalhou-se por toda a Europa continental durante a Idade Média e o Renascimento. A República de Veneza governava o comércio de esponjas dirigido ao Império Romano Oriental e ao Sacro Império Romano.
As esponjas de banho mediterrâneas. A) As cinco espécies de esponjas mediterrâneas comumente encontrados no mercado: a) Spongia mollissima, b) Hippospongia communis, c) Spongia lamella, d) Spongia zimocca (?), e) Spongia officinalis; B: Spongia officinalis neótipo BMNH 83.12.4-28; C: Spongia adriatica sinônimo junior de S. officinalis, espécime tipo BMNH 67.7.26.31; D: Spongia mollissima neótipo MSNG 54200; E: O espécime tipo de Spongia zimocca LMJG 15470/0 é claramente uma S. officinalis; F: Neótipo LMJG de Hippospongia communis 15945/83. (Pronzato & Manconi, 2008). [The Mediterranean bath sponges. A: The five species of Mediterranean sponges commonly found on the market: a) Spongia mollissima, b) Hippospongia communis, c) Spongia lamella, d) Spongia zimocca (?), e) Spongia officinalis; B: Spongia officinalis neotype BMNH 83.12.4-28; C: Spongia adriatica junior synonym of S. officinalis, type specimen BMNH 67.7.26.31; D: Spongia mollissima neotype MSNG 54200; E: The Spongia zimocca type specimen LMJG 15470 ⁄ 0 is clearly a S. officinalis; F: Hippospongia communis neotype LMJG 15945 ⁄ 83].
Durante o final do século XIX e a primeira metade do século XX, com o desenvolvimento de equipamentos de mergulho e o uso de métodos de dragagem, a pesca intensiva tem sido praticada na bacia oriental do Mediterrâneo, principalmente ao longo do mar Egeu, Tunisina, sul da Itália, Líbia, e costas egípcias; as peculiaridades desta atividade trouxeram um notável patrimônio cultural nas comunidades costeiras envolvidas (ver Pronzato e Manconi, 2008, Voultsiadou et alii, 2011).
https://youtu.be/m8a0oNsDEx8
Considerados inicialmente como plantas devido ao seu habito séssil e assimetria de muitos de seus representantes, sua natureza animal só foi reconhecida no final do século XVIII em 1765 quando se observou a corrente de água em seu corpo. Durante grande parte do século XIX Porífera e Cnidaria eram colocados juntos no táxon Radiata ou em Coelenterata (Santos, 2016).
Foi o naturalista inglês R.E. Grant quem primeiro compreendeu a anatomia e fisiologia das esponjas e criou o nome Porífera, que significa “portador de poros".
As esponjas são os animais mais simples dentre os Metazoários, apresentando uma organização morfológica bastante diferente da dos outros animais.
Devido a esta característica muito peculiar, pesquisadores resolveram considerá-las um grupo a parte dentro do Reino Animalia ou Metazoa (Santos, 2016).
Segundo Hajdu et al. (2011), tanto dados moleculares como morfológicos sustentam a inclusão dos Porifera em Metazoa.
Dentre os aspectos mais importantes podemos listar cinco características compartilhados pelas esponjas com os demais metazoários:
(2) meiose,
(3) padrão da oogênese,
(4) padrão da espermatogênese,
(5) plano básico da célula do esperma
(6) plano básico das células flageladas: opistoconta.
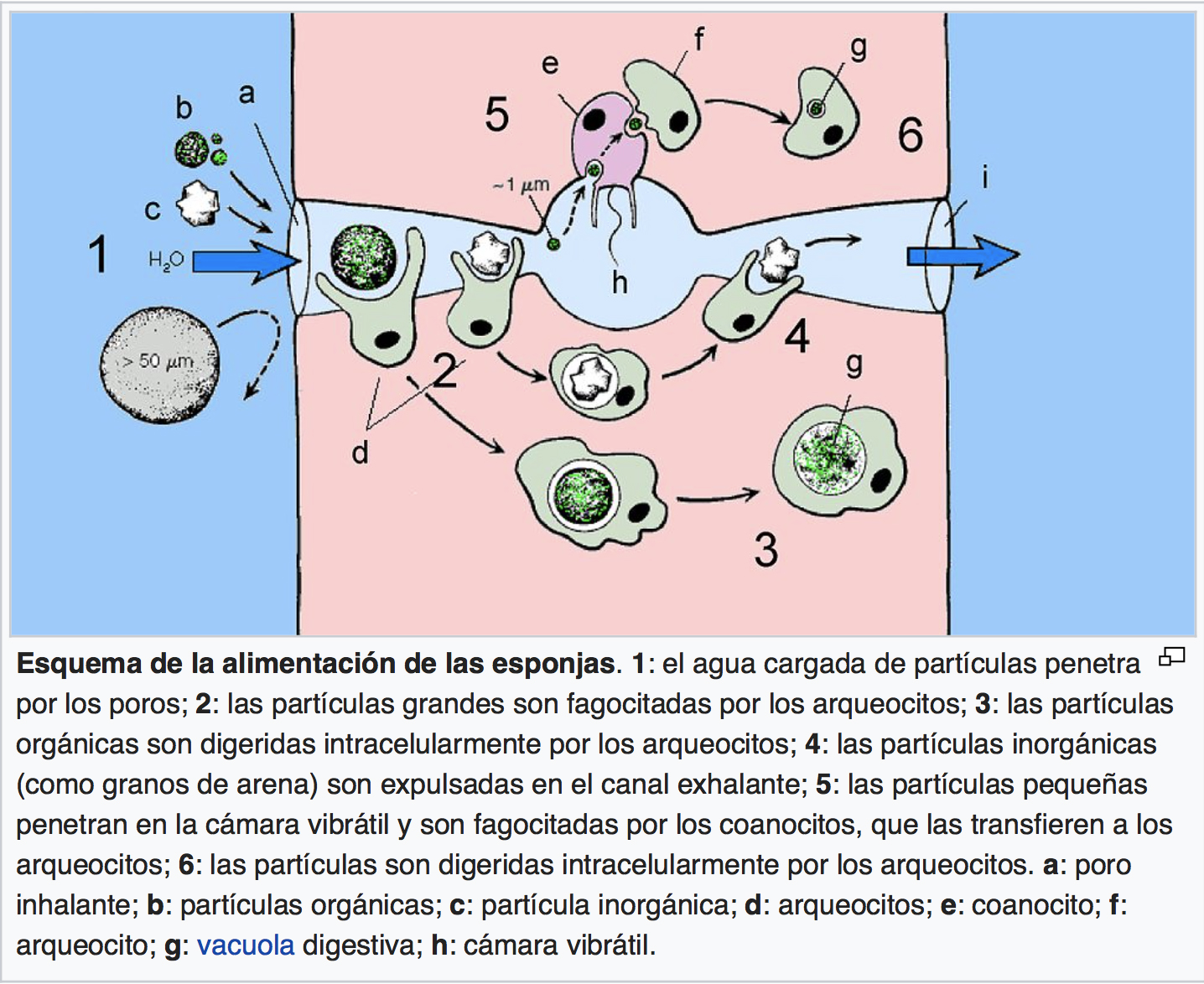
Esponjas são animais bentônicos sésseis filtradores de partículas em suspensão, que utilizam células flageladas chamadas coanócitos para promover a circulação da água através de um sistema de canais exclusivo do filo, o sistema aquífero.
Diferentemente de outros grupos de organismos bênticos e filtradores, por exemplo, moluscos, ascídias e certos poliquetas, que quase não retêm as partículas inferiores a 1 ou 2 μm, as esponjas utilizam matéria orgânica particulada de 0,1 a 50 μm e sua associação com algas cianofíceas e bactérias lhes permitem utilizar matéria orgânica dissolvida (VACELET, 1979, Santos, 2016).
Uma exceção a isso é encontrada em algumas esponjas carnívoras, altamente adaptadas às águas profundas, em que o sistema aquífero é inexistente, mas que têm uma superfície exterior pegajosa com a qual as pequenas presas são capturadas (VACELET; BOURY-ESNAULT, 1995, Santos, 2016).
Apesar da aparente simplicidade quando comparado a animais mais complexos, o padrão de organização das esponjas é indiscutivelmente eficiente, tendo garantido sua presença nos ecossistemas marinhos, e em habitats de água doce, por mais de meio bilhão de anos (HAJDU et al., 2004).
Por ser considerado o grupo de animais mais antigo existente, as esponjas estão entre os animais mais ancestrais (ERPENBECK; WÖRHEIDE, 2007). O primeiro registro fóssil data de 750 milhões de anos (MA), e seu bauplan é basicamente inalterado desde o Cambriano superior (509 MAA, REITNER; WÖRHEIDE, 2002, Santos, 2016).
Embora as esponjas sejam conhecidas da humanidade desde as civilizações mais antigas ~5.000 anos (Pronzato & Manconi, 2008; Voultsiadou et al., 2011), elas não foram reconhecidas como uma linhagem metazoa independente até meados do século XIX, quando Robert Grant (Grant, 1836) observou pela primeira vez a morfologia e fisiologia única, e criou o nome Porifera para elas, embora outros nomes tenham sido frequentemente utilizados (e.g. “Spongida”, “Spongiae”, “Spongiaria”).
Desde então, a espongiologia, o estudo de todos os aspectos da biologia, ecologia, taxonomia e química de esponjas, tornou-se uma disciplina atraindo uma população cada vez maior de centenas de pesquisadores em todo o mundo. Hoje vemos que cada vez mais, as esponjas são estudadas como parte de um empreendimento mais amplo de tentar detalhar a Árvore da Vida (Van Soest et al., 2012).
Durante grande parte do século XIX Porífera e Cnidaria eram colocados juntos no táxon Radiata ou em Coelenterata. Foi o naturalista inglês R.E. Grant quem primeiro compreendeu a anatomia e fisiologia das esponjas e criou o nome Poriphera, que significa “portador de poros" devido seu corpo ser atravessado por inúmeros poros.

Sponge diversity: (A) Clathria shoenus, (B) Haliclona sp., (C) Aplysilla aff. Rosea, (D) Haliclona implexiformis (smooth surface) and Tedania ignis (irregular) exposed during the low tide (all demosponges), (E) The calcareas Grantessa sp. (left) and Leucascus roseus (right), (F) Histological section of the demosponge Chondrosia sp. showing canals from the aquiferous system forming pores in the collagenous matrix. Reproduced from Ref 28, with permission from permission of the author.
The Indo-Pacific and Mediterranean ‘elephant ears’. A: Spongia agaricina (Indo-Pacific Ocean) neotype BMNH 25.11.1.1; B: Spongia lamella (Mediterranean Sea) neotype MSNG 54199; C: The exhalant (inner) surface of the Indo-Pacific Spongia agaricina; D: The inhalant (outer) surface of the Indo-Pacific Spongia agaricina; E: The exhalant (inner) surface of the Mediterranean Spongia lamella; F: The inhalant (outer) surface of the Mediterranean Spongia lamella; G: Spongin skeleton network of Spongia agaricina with primary fibers rich in mineral inclusions; H: Spongin skeleton network of Spongia lamella with primary fibers less thick, less dense and less rich in mineral inclusions than those of Spongia agaricina. (Pronzato & Manconi, 2008).
Origem e ecologia das esponjas
Acredita-se que os coanoflagelados coloniais (Protoctistas unicelulares bentônicos sésseis) estão na origem dos primeiros animais, sobretudo pelas semelhanças que partilham com os Porifera (esponjas):
Ambos são sésseis bentônicos
entre suas células há cooperação e comunicação celular
apresentam células com colarinho
são opistoconta (flagelo oposto a direção do movimento)
apresentam digestão intracelular
e apresentam em seu ciclo de vida formas livres natantes (larva dos poriferos a anfiblástula) e formas sésseis.
Estimativas filogenômicas sugerem que o último ancestral comum das esponjas e dos eumetazoários (Ctenophora, Cnidaria e Bilateria) existiu já na era Criogeniana cerca de 700-720 milhões de anos atrás e os fósseis das esponjas datam do Cambriano 600 - 500 maa.
Recentemente, Yin e colaboradores publicaram achados de um fóssil de 600 milhões de anos preservado em nível celular datando do Pré-Cambriano. O fóssil contém muitas características dos Porifera, como células semelhantes a pinacócitos e uma estrutura tubular oca que sugere um plano corporal para bombear água. Embora baseado em um único espécime, o achado aponta para a existência de esponjas anteriores ao Cambriano (De Biasse, 2015).
As esponjas atuais como indivíduos também podes viver muito tempo. Xestospongia muta, a esponja de barril gigante, é considerada a sequóia dos recifes. A pesquisa do Pawlik Lab em UNC Wilmington sugere que grandes esponjas Xestospongia muta nas Florida Keys podem ter até 2.000 anos, tornando-as entre os organismos vivos mais antigos da Terra (McMurray et al. 2008).
Esponjas ramificam-se basalmente na árvore filogenética dos metazoários e compreendem quatro linhagens distintas na categoria de classes:
Demospongiae,
Hexactinellida,
Calcarea e
Homoscleromorpha.
Os Porifera recentes somam cerca de 9.000 espécies que vivem em todos os ambientes aquáticos em todas as profundidades. Uma esponja é tradicionalmente definida como "um metazoário sedentário que se alimenta por filtração". Eles não têm nervos, músculos, sistema digestório ou gônadas.
No entanto, esponjas e eumetazoários compartilham as características básicas da sexualidade reprodução, como oogênese, espermatogênese, gametas, morfogênese etc.
As esponjas são um grupo-chave para fornecer respostas significativas à questões evolutivas fundamentais, entre elas como surgiram os tecidos, como as células passaram a cooperar, como iniciaram a comunicação entre si, bem como esclarecer como se deu o surgimento das gônada e da reprodução nos metazoários.
Apesar de haver debates acerca da origem única das esponjas e das relações entre os grupos, o filo Porifera é atualmente considerado um grupo monofilético, divididas em quatro classes como ja visto (Van Soest et al., 2016).
Dentro dessa diversidade de cerca de nove mil espécies divididas em quatro classes, as esponjas apresentam diferenças na composição do esqueleto, tipos de sistemas aquíferos, além de uma enorme variedade de morfologias externas, estratégias de vida, de ocupação de ambientes e interações com outros organismos.
As esponjas ocupam praticamente todos os ambientes aquáticos ao longo de todas as latitudes: desde a zona entre marés, poças de maré, costões rochosos, recifes, cavernas submarinas até profundidades abissais (8840m); e massas de água salobra e doce como manguezais, rios e lagos internos e de altitude (Van Soest et al., 2012).
Nesses ambientes, elas desempenham papeis ecológicos importantes para a comunidade bentônica se associando a micro-organismos, servindo de proteção e alimento para outros animais, como tartarugas marinhas, promovendo a ciclagem e disponibilidade de compostos e matéria orgânica dissolvida.
Esses organismos atuam como agentes de distúrbio através da bioerosão e competição por espaço, servindo de substrato e permitindo o aumento da heterogeneidade e biodiversidade de habitats pouco complexos (Pádua, 2016), além de ser importantes na criação, estabilização e consolidação do substrato bentônico (Bell, 2008).
A enorme plasticidade das esponjas permitiu a ocupação de diversos ambientes e o desenvolvimento de uma enorme gama de hábitos de vida e morfologias.
Em regiões abissais, extensos “jardins de esponjas” formados por esponjas hexactinelidas ou demosponjas são conhecidos e geram substrato para outros organismos, além de promover o aumento da diversidade local e heterogeneidade geográfica (Maldonado et al., 2015).
O hábito carnívoro em esponjas que apresentam redução total ou parcial do sistema aquífero é considerado uma adaptação evolutiva a ambientes oligotróficos e é restrito a uma família de demosponjas (Hestetun et al., 2016). As esponjas são os componentes mais diversos e abundantes em ambientes recifais e costões rochosos, onde podemos encontrar desde espécies de hábito perfurante, medindo milímetros de espessura, até metros de altura, com
as mais diversas cores e morfologias externas, inclusive variando dentro da mesma espécie
ou gênero (Pádua, 2016).
São organismos sésseis (fixos no substrato), pois não possuírem estruturas locomotoras, são pouco móveis (apenas a larva é livre natante) e vivem fixos ao substrato seja ao fundo marinho, até 8.000 m de profundidade ou a rochas, em costões rochosos. São encontradas em água doce (ambientes lóticos) presas em galhos flutuando ou a troncos submersos, formando colônias. O tamanho, forma e coloração variam bastante dentro do filo, de acordo com a espécie, fatores ambientais e associações simbióticas com algas verdes unicelulares e bactérias fotossintetizantes (cianobactérias).
Dysidea sp. com cianobactérias filamentosas longas vivendo em simbiose com a esponja em seu corpo (mesohílo), contribuindo para a nutrição da esponja por meio da fotossíntese.
As esponjas também são verdadeiros "hotéis" para uma miríade de outras formas de vida. Isso inclui camarões, cracas, vermes e, mais significativamente, os outros Domínios da Vida (Bactérias e Arquéias). Em muitas esponjas, geralmente há mais células de bactérias do que células de esponja, e algumas delas co-evoluíram com as esponjas. Esses parceiros coevolucionários incluem as cianobactérias que vivem no mesohilo. Essas bactérias vivem em simbiose com muitas esponjas, principalmente em águas rasas, fornecendo nutrientes e subprodutos fotossintéticos à esponja por meio da fotossíntese.
Apresentam corpo muito simples, sem tecidos diferenciados.
Apresentam poros por toda extensão (superfície) corporal, de onde provém o nome do filo, possuem também aberturas chamados de óstios. Os poros são constituídos por células denominadas porócitos; essas células tem o formato de barril (aberta nas duas extremidades), os porócitos facilitam a comunicação, do meio externo, com os coanócitos (células que promovem o fluxo de água e a captura do alimento). Assim, a água do meio externo carregada de matéria orgânica (bactérias, algas unicelulares, restos de animais em decomposição etc.), entra pelos porócitos e vai até os coanócitos, onde é filtrada, indo para o átrio ou espongiocele, saindo pelo ósculo. É pelos porócitos e óstios que a água entra no interior do animal – mais especificamente na espongiocele, ou átrio.
O ósculo, na porção superior, é a maior abertura do corpo das esponjas e por onde a água sai, eliminando excretas e outros resíduos, inclusive gás carbônico. Por isso as esponjas são consideradas animais filtradores. Cada célula elimina seus resíduos na água circundante que sairá, devido a corrente provocada pelos coanócitos, pelo ósculo.
Externamente as esponjas são revestidas com células especiais os pinacócitos, células achatadas e unidas que revestem e protegem todo o corpo do animal externamente.
Internamente, são os coanócitos: células ovoides, dotadas de flagelos e colarinho (coana), responsáveis pela circulação da água no corpo da esponja. Os coanócitos são células responsáveis pela captura de partículas alimentares, digestão intracelular (que ocorre no citoplasma), e a transferência dos nutrientes para os amebócitos, que são células localizadas no mesohilo ou mesênquima. Os amebócitos são responsáveis pelo transporte dos nutrientes para as demais células do corpo da esponja. Além dessa função os amebócitos também podem se transformar em qualquer tipo de célula do corpo da esponja, atuando como um tipo de célula tronco ancestral.
No mesohilo encontramos também, células encarregadas da regeneração celular e reprodução os arqueócitos (que são um tipo de amebócito) e células responsáveis pela secreção de estruturas de sustentação esquelética os escleroblastos que produzem as espículas, que são estruturas formadas de carbonato de cálcio ou sílica, ou fibras proteicas, principalmente a espongina.
As esponjas podem ser monóicas ou dióicas. Reproduzem-se assexuadamente por brotamento, fragmentação e, ainda, por gemulação, no caso das esponjas de água doce.
Na reprodução sexuada os arqueócitos e coanócitos se modificam em óvulos e espermatozoides, que são liberados para o ambiente externo pelo ósculo e para dentro de outras esponjas, por meio das correntes de água.
Discussão sobre formação de tecidos em Poriphera
Estudos sobre tecidos animais em esponjas
Além de simplesmente colar e manter unidas as células, as moléculas de adesão celular são reguladas dinamicamente durante o desenvolvimento dos organismos e a migração celular, reguladas espacialmente em tecidos polarizados e envolvidas na sinalização celular e na mecanotransdução. Consequentemente, uma miríade de mecanismos de adesão evoluiu para funcionar em diferentes contextos em animais. Destes, dois predominam: (1) a junção aderente, que está envolvida na adesão célula-célula e é composta de receptores de caderina, α- e β-catenina, e (2) adesões focais, que estão envolvidas na adesão célula-matriz extracelular (ECM) (cell–extracellular matrix adhesion) e composta por proteínas, como integrinas, vinculina, paxilina, talina e quinase de adesão focal (FAK) (focal adhesion kinase)(Mitchell and Nichols, 2019).
Os componentes moleculares da junção aderente e das adesões focais são amplamente conservados em animais, e alguns de seus componentes têm origem fora dos animais (1*ver nota no final da pagina). No entanto, os estudos experimentais da composição e função das junções celulares são amplamente restritos a animais bilaterianos, como a lombriga Caenorhabditis elegans, a mosca da fruta Drosophila melanogaster e vertebrados. Estudos recentes demonstram papéis conservados para proteínas de junção aderentes também em cnidários.
Schematic representation of integrin-mediated cell-adhesion and cell-signaling evolution. Left: The canonical metazoan integrin adhesion complex. The colors correspond to the three main steps in the evolution of the integrin adhesion mechanism, as shown in the cladogram. Dots indicate origin, and crosses indicate losses. The branch leading to Amastigomonas sp. is shown dashed, because its phylogenetic position remains unresolved (see main text for discussion).
Schematic representation of the eukaryotic tree of life showing the distribution of the different components of the integrin adhesion complex. The number of integrin homologs is shown. A black dot indicates the presence of clear homologs, whereas a hollow dot indicates the presence of putative or degenerate homologs. Absence of a dot indicates that a homolog is lacking in that taxon. The phylogenetic relationships are based in several recent phylogenetic studies.
Portanto as esponjas (Porifera) são organismos de importância crítica para reconstruir as etapas iniciais na evolução dos mecanismos de adesão de células animais (Mitchell and Nichols, 2019).
Eles são um dos grupos de animais mais divergentes filogeneticamente, sua anatomia é fundamentalmente diferente de outros animais, e há questões de longa data sobre a estrutura e homologia de seus tecidos em comparação com epitélios em outros animais. Tem sido argumentado que a adesão celular em esponjas (classe Demospongiae, em particular) depende principalmente de um complexo de proteoglicano extracelular denominado Fator de Agregação. Consequentemente, acredita-se que a integridade dos tecidos de demospongie dependa da interação das células com o fator de agregação, um componente da ECM, em vez de por meio de junções celulares como as encontradas em epitélios de outros animais (Mitchell and Nichols, 2019).
A integridade e organização dos tecidos animais dependem de complexos proteicos especializados que medeiam a adesão entre as células (junções aderentes à base de caderina) e com a matriz extracelular (aderências focais à base de integrina). Reconstruir como e quando essas junções celulares evoluíram é fundamental para compreender a evolução inicial dos tecidos em animais.
Examinamos homólogos de proteínas de adesão focal em tecidos da esponja de água doce, Ephydatia muelleri (filo Porifera; classe Demospongiae).
As principais descobertas foram:
(1) que os homólogos de adesão focal da esponja (integrina, talina, quinase de adesão focal, etc.) co-precipitam como um complexo, separado das proteínas de junção aderentes;
(2) que estruturas à base de actina que se assemelham a aderências focais se formam na interface célula-substrato e sua abundância é regulada dinamicamente em resposta ao cisalhamento de fluido;
(3) as proteínas de adesão focal localizam-se nas adesões célula-célula e célula-matriz extracelular, e;
(4) a proteína de junção aderente β-catenina é co-distribuída com proteínas de adesão focal em junções célula-célula em todos os lugares, exceto na coanoderme, e em novas junções entre células com espículas e entre células com bactérias ambientais (and between cells with environmental bacteria). Esses resultados esclarecem a diversidade, distribuição e composição molecular das junções celulares em tecidos de Ephydatia muelleri.
Adherens Junction ou junções aderentes, e estruturas semelhantes à adesão focal em tecidos de Ephydatia muelleri. (a) Topo: as células da endopinacoderma apical contêm feixes de filamentos de actina que culminam em placas densas que lembram junções aderentes em pontos de contato célula-célula. Embaixo: as células da basopinacoderme contêm feixes de filamentos de actina que se assemelham a fibras de estresse de aderências focais (pontas de flechas brancas). (b) Diagrama transversal do corpo juvenil de E. muelleri ilustrando a distribuição de Emβ-catenina (as setas azuis indicam a direção do fluxo de água no sistema aquífero). (c) Ilustração esquemática da organização molecular de uma adesão focal. As proteínas destacadas em vermelho são o assunto do estudo atual [FAK = Focal Adhesion Kinase.(Mitchell and Nichols, 2019)
[Adherens Junction- and Focal Adhesion-like structures in tissues of Ephydatia muelleri. a Top: Cells of the apical endopinacoderm contain bundles of actin filaments that culminate in dense plaques resembling spot adherens junctions at points of cell–cell contact. Bottom: Cells of the basopinacoderm contain bundles of actin filaments that resemble stress fibers of focal adhesions (white arrowheads). b Cross-sectional diagram of the juvenile E. muelleri body illustrating the distribution of Emβ-catenin (blue arrows indicate the direction of water flow in the aquiferous system). c Schematic illustration of the molecular organization of a focal adhesion. Proteins highlighted in red are the subject of the current study [FAK = Focal Adhesion Kinase. (Mitchell and Nichols, 2019)].
Basement membrane structures, or their main component, type IV collagen, have been detected in all multicellular animal species, except sponges. We cancel this exception by the demonstration of type IV collagenous sequences in a new marine sponge species by cDNA and genomic DNA studies. One of these sequences is long enough to demonstrate the specific characteristics of type IV collagen chains. The 12 cysteines are at conserved positions in the carboxyl-terminal non-helical NC1 domain, as are the interruptions in the carboxyl-terminal end of the triple helical domain. The gene organization of the region coding for the NC1 domain is similar to that of the human genes COL4A2, COL4A4 and COL4A6. An additional, shorter sequence suggests the presence of a second chain. The expected tissue localization of this collagen has been confirmed using polyclonal antibodies raised against a sponge recombinant protein. These results demonstrate that type IV collagen is representated in all animal phyla. It is actually the only known ubiquitous collagen and it has at least two different alpha chains in all the species where it has been characterized. (Boute et alii, 1996, royalsocietypublishing).
Schematic overview of the collagens and collagen-like structural proteins of poriferan origindescribed in this review.
Composição de aninoácidos da Espongina.
Diversidade de esponginas.
Filogênese do tecido conjuntivo: aspectos morfológicos e biossíntese da matriz intercelular da esponja.
(Garrone, R. (1978) Phylogenesis of Connective Tissue: Morphological Aspects and Biosynthesis of Sponge Intercellular Matrix; John Wiley & Sons: Hoboken, NJ, USA)
Diferentes morfotipos de esponjas (asconoide, leuconoides e siconoides)
e células coanócitos e amebócitos.
Coanócito e Arqueócito
e células coanócitos e amebócitos.
Fluxo de água e direção do alimento em esponjas do tipo leuconoide.


Organização geral de uma esponja.
ac: actinócito; ar: arqueócito; bs: basopinacócito; ch: coanócito; co: colêncito en: endopinacócito; ex: exopinacócito; lo: lofócito; sc: esclerócito; so: espongiócito; sp: célula esfericas (spherulous cell); spo: espongina. Reproduced from Ref 29, with permission from permission of the author.
Habitat
As esponjas são dominantes em costões rochosos, recifes de coral e em substratos artificiais (BERGQUIST, 1978), fazem parte também principalmente nos ambientes ciáfilos (pouca luminosidade), grutas submarinas e cavernas (VACELET, 1979; VAN SOEST, 2009). Atualmente as esponjas marinhas são encontradas em todos os oceanos, desde a zona do entre-marés até profundidades que chegam a mais de 8.800 metros. Nos ambientes profundos os poríferos são frequentemente dominantes, estando as maiores riquezas conhecidas associadas a locais de maior complexidade estrutural, usualmente encontrados em setores de declividade mais acentuada (talude, cânions, montes submarinos), onde os substratos são mais consolidados (HAJDU et al., 2011). Segundo este autor, nesses “oásis” profundos, os poríferos podem desempenhar um papel estruturador, conferindo maior complexidade tridimensional como fazem em ambientes rasos. São encontradas em ambientes dulcícolas sobretudo lóticas (rios e córregos) e lêntica (lagos e pantanal), aderidas a rochas ou a galhos e troncos submersos ou flutuantes.
Embora quase toda a totalidade das esponjas seja marinha, há, em todo o mundo, mais de 200 espécies de poríferos de água doce registradas, sendo pouco mais de 50 a 54 espécies encontradas no Brasil.(planetainvertebrados s/d).
Esponda de água doce, note a cor verde devido a simbiose com algas verdes.
https://youtu.be/1DIEFTkpLhY
https://youtu.be/huUEB76igYI
Na ciência, é consenso que elas surgiram a partir de esponjas marinhas e migraram ou se adaptaram de alguma maneira ao ambiente dulcícola, embora ainda não se saiba se tal fato ocorreu várias vezes ou somente uma, durante o processo evolutivo.
Alguns poríferos de água doce desempenham relações ecológicas positivas com outros organismos. Um exemplo típico é o fato de atuarem como refúgio e/ou abrigo para diversos animais. Outro fator envolve a relação simbiótica entre elas e algas verdes unicelulares. Neste caso, tais esponjas são consideradas fototróficas, já que grande parte de sua nutrição é oriunda das atividades fotossintéticas das algas simbiontes (Araguaia, s/d).
O mais abrangente estudo já realizado foi feito por Batista & VolkmerRibeiro (2002), no rio Manso, tributário do rio Cuiabá, que contribuiu para o levantamento da fauna espongológica, revelando a presença de seis espécies (Corvospongilla seekli, Eunapius fragilis, Troehospongilla repens, Oneosclera navieella, Oneosclera petrieola, Drulia uruguayensis) (Marostega, et alii, 2013).
Nutrição e digestão
As esponjas são organismos filtradores, que capturam o alimento em suspensão na corrente de água. A corrente de água ou o fluxo de água é promovido pelo batimento incessante dos coanócitos. Os coanócitos capturam por fagocitose o alimento. O alimento é englobado por um vacúolo digestivo, que se desloca no citoplasma do coanócito; esse vacúolo recebe lisossomos do complexo de Golgi com enzimas digestivas, que digerem o alimento, quebrando-o em moléculas menores. Após a digestão os nutrientes são absorvidos pelo citoplasma e parte desses nutrientes são repassados aos arqueócitos e amebócitos que distribuem o alimento para as demais células do corpo da esponja. Todas as células da esponja podem fagocitar alimentos que estão em suspensão na água. Todavia somente os coanócitos promovem a corrente de água que traz os alimentos que são fagocitados. Os resíduos da digestão intracelular são eliminados na água, que cai no átrio e sai pelo ósculo. Os excretas normalmente o CO2 e a amônia (resíduo do metabolismo das proteínas) é eliminado pelas próprias células na água.
Estarutura flagelar
As esponjas sendo organismos filtradores são capazes de ingerir partículas de tamanho entre 5 e 50 μm através de células do mesohilo e da pinacoderme, e micropartículas de 0,3 a 1 μm pelas câmaras dos coanócitos (Simpson, 1984).
Um espécime de esponja silicosa Geodia cydonium de 1kg filtra 24.000 litros de água por dia (Vogel, 1977).
O alimento e o oxigênio para as esponjas são garantidos pela capacidade de bombeamento e diltração de grandes volumes de água (Zhang et alii, 2003). Portanto, não é surpreendente que possam viver em ambientes pobre em nutrientes e que necessitem de um potente mecanismo de detoxificação.

As esponjas não apresentam órgãos para a excreção, os dejetos são eliminados na corrente de água, (os resíduos do metabolismo das proteínas (amônia) e o gás carbônico da respiração). As trocas gasosas ocorrem por difusão entre a água e as células do corpo do animal. Não apresentam sistema circulatório nem nervoso. Mas existe comunicação química entre as células do corpo da esponja.
Simbiose com algas verdes
Demonstrações da natureza dos benefícios dessa associação têm sido feitas de numerosas formas. Alguns trabalhos documentaram a transferência de fotossintatos das zooclorelas para as esponjas. Experimentos de luz-escuro demonstram, em experimentos de luz-escuro, que há maior sobrevivência, crescimento e competitividade em organismos com simbiontes ativos, com relação a aposimbiontes. Alguns autores investigaram o efeito de algas simbiontes no crescimento de esponjas de água doce, encontrando que as mesmas têm uma grande importância no desenvolvimento desses animais.
Alguns trabalhos têm enfocado o movimento de fotossintatos dos autótrofos para os heterótrofos em relações simbióticas, havendo uma boa revisão sobre o assunto. Além desse, a alga pode ter outros efeitos no hospedeiro. Alguns autores sugerem que as algas simbiontes poderiam beneficiar seu hospedeiro de várias maneiras, como por exemplo: tomando dióxido de carbono e produzindo oxigênio durante a fotossíntese, facilitando assim a respiração e a troca de gases, e tomando excretas do hospedeiro, como amônia e fosfato, criando um micro-ambiente menos tóxico para o animal. Ainda há poucas evidências diretas de que qualquer um desses benefícios seja essencial para o hospedeiro.
Alguns estudos têm demonstrado que essas esponjas, chamadas fototróficas derivam 50%, ou mais, de sua nutrição das atividades fotossintéticas das algas simbiontes.
A localização da alga dentro do hospedeiro pode variar em diferentes associações: em esponjas de água doce e suas gêmulas, elas ocorrem primariamente dentro dos arqueócitos. Em esponjas marinhas, estudos demonstraram que as algas simbiontes podem se localizar tanto no mesohilo, como dentro das células da esponja. As algas simbiontes de Metania spinata ocorrem dentro das células da esponja e, aparentemente, também no mesohilo. (Melão e Rocha, s/d)
Alguns autores, observaram que a maioria das células de Spongilla lacustris, particularmente os arqueócitos, contém um grande número de inclusões de zooclorelas simbióticas, tanto em esponjas ativas quanto em gêmulas. Para quantificar essas algas, os autores fizeram determinações de clorofila a por unidade de peso de esponja e encontraram valores de 60µg cl.a gPF-1 para S. lacustris e de 460µg cl.a gPF-1 para uma esponja de água doce não identificada.
A proporção de organismos simbiontes, a concentração de clorofila em função de diferentes espécies algais, ou ainda diferenças fisiológicas nas células algais, no entanto, variam consideravelmente de uma espécie para a outra, como pode ser evidenciado pelo conteúdo de clorofila a encontrado em dez espécies marinhas (22), que variou de 1,9 a 116,1µg cl.a gPF-1.
Os resultados da contagem das algas simbiontes de M. spinata, indicaram uma altíssima densidade por unidade de volume de esponja (5,2 109 células ml-1 esponja), sugerindo grande importância das algas para esse porífero. (Melão e Rocha s/d).
As trocas metabólicas entre alga e esponja, sugeridas por alguns autores (20) e demonstradas por outros (15). Esses autores mostraram que algas simbióticas de um ciliado, uma esponja e uma hidra, excretam 86,7% de seu fotossintato total como maltose ou glicose, enquanto que as de vida livre liberam uma quantidade bem menor (7,6%) e a maioria sob a forma de ácido glicólico. Segundo esses autores, o controle e a utilização do glicerol excretado por algas simbiontes, representa um mecanismo pelo qual as zooxantelas contribuem para a produtividade dos recifes de coral. Outros pesquisadores (10) também mostraram que há transferência de fotossintatos das zooclorelas simbiontes para as células de esponja. (Melão e Rocha s/d).
A intensidade com que a alga contribui para a nutrição da esponja depende do regime de luz e da profundidade do habitat. Até agora nenhuma quantificação desse processo foi feita.(Melão e Rocha s/d).
ANATOMIA DE UMA ESPONJA
A) Espécime sobre pequeno graveto;
B, C, D) Gêmulas discóides em detalhe
(Foto U.S. Pinheiro)
A) Megasclera; B-F) Gemoscleras; G, H) Gêmulas discóides
(Foto U.S. Pinheiro)
Microscopia eletrônica de varredura de Ephydatia sp.
A, B) Megascleras; C) Gemoscleras; D,E,F) Gêmula
(Foto U.S. Pinheiro)
Reprodução, síntese das espiculas, sistema aquífero
Gêmula
Esquema mostrando uma gêmula de uma esponja de água doce.
Pode-se ver a micrópila, as espículas anfidiscos, as fibras de espongina entre as espículas e os arqueócitos que preenchem todo o espaço interno da gêmula. As gêmulas são resistentes a dessecação (ressecamento), congelamento, e anoxia (falta de oxigênio) e podem permanecer nesse ambiente por grandes períodos de tempo. Gêmulas são similares ao endósporo bacteriano (produzido para resistir a situações desfavoráveis). As espículas são constituídas de amebócitos circundados por uma camada de espículas e pode sobreviver a condições que matariam a esponja adulta. quando o ambiente tornar-se menos hostil a gêmula regenera todo o individuo.
Na figura acima são apresentados o eixo basal-apical e o polo anterior e posterior de algumas esponjas. (Eixo apical-basal e polo anterior-posterior das larvas e adultos de algumas espécies de esponjas). (a) MEV da larva de Clathriina reticulata (Calcinea) larva. (b) MEV da larva de Halisarca dujardini. (c) Microscopia ótica de Esperiopsis koltuni parenchymella. (d) Polymastia artica do Mar Branco (White Sea). (Courtesy of M. Fedjuk). (e) Sycon sp. White Sea (Courtesia of M. Fedjuk). (f) Haliclona aquaeductus from White Sea (Courtesy of M. Fedjuk). As flechas indicam a posterior–anterior (a–c) e o eixo basal–apical (d–f). ap: polo anterior, pp: polo posterior, o: ósculo.
Síntese das espículas
Os elementos esqueléticos siliciosos das esponjas (filo: Porifera), denominados espículas, possuem várias características únicas que os distinguem dos elementos esqueléticos encontrados em outros Metazoa.
Eles são feitos de sílica [(SiO2)n] em vez de minerais à base de cálcio com uma precisão incomparável, dando origem a estruturas complexas espécie-específica. Essas estruturas geneticamente controladas e produzidas biologicamente são formadas em condições fisiológicas amenas, sem altas temperaturas, pressões ou produtos químicos cáusticos. As espículas são o determinante estrutural crítico que controla a morfologia das esponjas. No centro das espículas encontra-se um canal axial de 0,5–4,0 μm de largura que abriga o filamento axial orgânico. Desde sua descoberta, o filamento axial tem sido considerado um modelo que controla a morfologia das espículas. Um grande passo para o entendimento da morfogênese geneticamente controlada das esponjas foi a identificação da proteína estrutural das espículas, denominada silicateina, que está localizada tanto no filamento axial quanto na superfície das espículas. A silicateina é uma enzima que forma a bio-sílica necessária para a construção das espículas das esponjos. A formação das espículas é um processo rápido, que dura para uma espícula com comprimento de 190 μm e diâmetro de 6 a 8 μm a 21ºC apenas 40 horas. Por causa dessa alta taxa de crescimento, não foi claro por um longo tempo se a formação da espícula começa intra ou extracelularmente. Abaixo vemos esquematicamente a síntese de uma espícula simples e a sequencia dos passos principais no tempo e onde ocorre.
(A) A síntese da espícula (sp) começa intracelularmente nos esclerócitos (scl). As espículas primordiais estão associadas a filamentos (fi) que se presume que participam da extrusão da espícula em crescimento. Esta fase é dominada pela expressão de silicateina que, no estágio posterior, é necessária para a formação do núcleo e do cilindro da casca do manto silicioso da espícula. As moléculas de silicateina recém-formadas passam por uma organização fractal. (B) A espícula primordial é extrudada e torna-se associada no espaço extracelular com esclerócitos (scl) que intracelularmente formam os silicassomas (sis). Essas organelas contêm silicateina e silicato que são liberados no espaço extra-espicular e causam a formação de bio-sílica. (C) O crescimento da espícula (sp) continua em duas direções; alongamento axial e crescimento aposicional/espessamento (axial elongation and appositional growth/thickening). A formação da bio-sílica é mediada pela silicateina (sil) sob o consumo do substrato silicato (si). O crescimento da espícula é conduzido longitudinalmente e (subsequentemente) radialmente ao longo da protrusão celular. Durante esta fase, as extensões celulares se alongam por evaginação. O núcleo do manto da espícula é formado por silicateina, existente no canal axial, e a casca por silicateina, espalhada na superfície externa da espícula em crescimento. (D) Conclusão final do tamanho e forma da espícula. Após o término, a espícula se desconecta do esclerócito (não mostrado no esquema) e o orifício é fechado pela formação de biossílica. A direção do movimento da célula é indicada por uma seta (no interior dos retângulos) (Wang et alii, 2011).
ESPÍCULAS DE ESPONJAS
Spicules of sponges of the order Chondrosida and unassigned spherical/astrose micorscleres; A-Chondrilla nucula, family Chondrillidae; B-L-Chondrilla secunda, family Chondrillidae; M-Q-Different types of other spherical microscleres; R-U-Different types of oxyspherasters. (Lukowiak, 2015)

ESPONJA MARINHA
LARVA DE UMA ESPONJA
(Imagens: Google images)
Algumas esponjas de água doce do hemisfério norte
Principais características das quatro classes do filo Poriphera
Asconóide (A), Siconóide (B) e Leuconóide (C)

São reconhecidos três tipos estruturas de esponjas: ASCONÓIDE (A), SICONÓIDE (B) e LEUCONÓIDE (C), que diferem entre si pela complexidade da parede do corpo e numero de coanócitos. O tipo asconóide é o mias simples dos três tipos. A parede é fina e possui poros inalantes que se abrem diretamente no átrio ou espongiocele. Este tipo é apresenta apenas uma camada coanócitos que reveste o átrio. Ex. gênero Leucosoleina. já nas esponjas do tipo siconóide, a parede do corpo é formada por projeções sinuosas em forma de dedos. Identificam-se dois tipos de canais: os inalantes e os radiais. A água penetra pelas camadas radiais, indo para a espongiocele. Os canais radiais são revestidos internamente por coanócitos. No tipo leuconóide, a parede do corpo é muito espessa e percorrida por um sistema de canais. Há canais inalantes e exalantes e, entre eles, câmaras revestidas por coanócitos. A água penetra pelos canais inalantes, passa por câmaras vibráteis (repletas de coanócitos) e vai à espongiocele através dos canais exalante. Embora existam mais tipos de sistemas aquíferos como os mostrados acima (asconóide, siconóide e leuconóide) estes são os principais.
A seguir vemos outros tipos de sistemas aquíferos que ocorrem no filo das esponjas.
Reino Metazoa
Sub reino Parazoa
Filo Porifera
(Poríferos, esponjas)
Classes:
Calcarea
Homoscleromorpha
Demospongiae,
Hexactinellida
Na figura acima vemos diferentes aspectos da organização das esponjas, desde seu mutualismo com bactérias e algas, seu estágio anfiblástula, a forma de seus ancestrais hipotéticos e organização dos tipos Asconóide, Leuconóide e Siconóide, são apresentados.
Reprodução: sexuada, assexuada
e fragmentação seguida por regeneração
Gonocorismo (= dioicia ou sexos separados) e hermafroditismo, bem como viviparidade, oviparidade e ovoviparidade ocorrem em esponjas. Foi demonstrado que as esponjas ovíparas são principalmente gonocóricas (dióicas), mas as esponjas vivíparas (que "chocam") são principalmente hermafroditas.
O hermafroditismo sequencial ou sucessivo (ou reversão sexual) é um tipo de hermafroditismo que ocorre quando o indivíduo muda de sexo em algum período de sua vida. Pode ser alterado de masculino para feminino (protândria), ou de feminino para masculino (protoginia).
O hermafroditismo sucessivo foi documentado em apenas alguns casos em demospongeas. Este tipo de hermafroditismo tem sido indicado em: Polymastia mammillaris, Suberites massa, Hymeniacidon perlevis, H. heliophila, Chalinula ecbasis e Spongilla lacustris.
Uma análise cuidadosa do ciclo sexual é também necessário para evitar confusão entre espécies hermafroditas com fases sexuais distantes no tempo e espécies gonocóricas (dióicas).
Tanto a oviparidade quanto a viviparidade (ninhada) existem nas esponjas. Em contraste com o fenótipo sexual, oviparidade e viviparidade são características estáveis de indivíduos e espécies.
As esponjas vivíparas liberam larvas e as esponjas ovíparas liberam zigotos ou ovos não fertilizados.
Viviparidade e oviparidade são modos reprodutivos igualmente difundidos em esponjas.
O desenvolvimento embrionário nas esponjas ovíparas é sempre externo, levando produção de uma larva livre natante, anfiblástula, que nada livremente na coluna d'água por alguns dias (2 a 3 dias) (Mandal, 2018) . Esponjas vivíparas ou ovovivíparas são caracterizadas por incubação de embriões no mesohilo ou dentro da estrutura temporária especial, os folículos. A liberação de larvas livre natantes resultante através dos canais do sistema aquífero. O desenvolvimento direto sem estágio larval existe em algumas demospongias. Em Demospongiae algumas ordens são completamente ovíparas (Polymastiida, Clionaida, Tethyida e Verongida), enquanto outras, apresentam apenas viviparidade (Spongillida, Dendroceratida, Dictyoceratida). No entanto, alguns representantes vivíparos podem ser encontrados nas ordens ovíparas, por exemplo, os gêneros vivíparos Alectona, Thoosa, Stylocordyla (ordem Suberitida), gênero Halisarca (ordem Chondrosida), gêneros Haliclona, Xestospongia (ordem Haplosclerida).
As esponjas se reproduzem assexuadamente e sexuadamente. A maioria dos poríferos que se reproduzem por meios sexuais são hermafroditas e produzem óvulos e espermatozóides em momentos diferentes. Os espermatozoides são freqüentemente liberados na coluna d'água, ou seja, os espermatozoides são criados, concentrados e enviados para fora por aberturas excurrentes, às vezes em massas tão densas que as esponjas parecem estar fumegando. Esses espermatozoides são subsequentemente capturados por esponjas fêmeas da mesma espécie. Dentro da esponja fêmea, os espermatozoides são transportados para os óvulos por células especiais chamadas de arqueócitos. A fertilização ocorre no mesênquima e os zigotos se desenvolvem em larvas ciliadas.
Algumas esponjas liberam suas larvas na coluna d'água, enquanto outras as retêm por algum tempo.

Esponja liberando espermatozóides
As larvas podem permanecer na coluna de água por algumas horas até dias e posteriormente elas se assentam e se desenvolvem em esponjas juvenis. Esponjas que se reproduzem assexuadamente produzem brotos ou, mais frequentemente, gêmulas, que são pacotes de várias células de vários tipos dentro de uma cobertura protetora. As esponjas de água doce da família Spongillidae freqüentemente produzem gêmulas antes do inverno. Estas então se transformam em esponjas adultas a partir da primavera seguinte.
No que diz respeito à reprodução sexuada, em geral, são hermafroditas protóginos sequenciais (primeiro fêmeas e depois machos) ou protândricos (inicialmente machos e posteriormente fêmeas), e a fecundação é cruzada.
A mudança de sexo pode acontecer apenas uma ou várias vezes.
Os espermatozoides são formados a partir de coanócitos e os óvulos a partir de coanócitos ou arqueócitos.
Os espermatozóides se desenvolvem nos chamados cistos espermáticos, formados a partir de uma câmara de coanócitos, ou pela migração dos coanócitos para o mesohilo onde se unem formando um zigoto.
A fertilização é interna, salvo algumas exceções. O esperma entra pelos óstios ou poros pinacodérmicos e a fecundação acontece no mesohilo ou mesênquima.
Os coanócitos podem dar origem a espermatozóides e óvulos, estes também podem vir de arqueócitos.
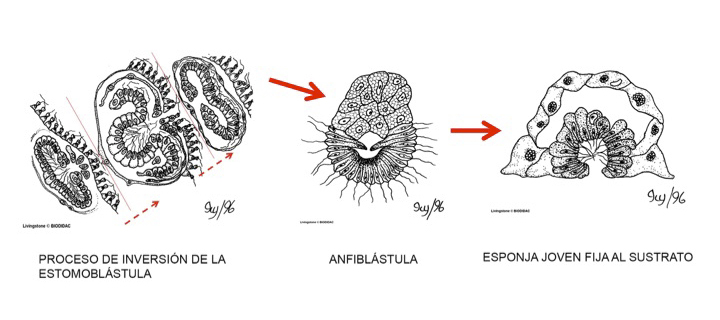
As larvas podem ser de três tipos: parenquímula, celoblástula e anfiblástula.

Micrografia de larvas de esponjas
Blastomere reorganization during the gastrulation process of the homosclerophorid Corticium candelabrum, through which the solid blastula becomes a hollow embryo by multipolar outward cell migration (i.e. multipolar egression). (cc) larval cavity, filled with symbiotic bacteria and collagen fibrils. (pp) posterior and (ap) anterior embryo pole, which will become the posterior and anterior larval pole, respectively, relative to the direction of swimming. Scale bars: 100 mm. (Wörheide et al., 2012; Modified from Maldonado and Riesgo (2008b)

As esponjas não possuem gônadas e, portanto, não apresentam a separação de uma linhagem germinativa no início do seu desenvolvimento exclusivamente para produzir os seus elementos reprodutivos (Pádua, 2016).
Sendo assim, os gametas se originam a partir das células somáticas de forma difusa no corpo do animal. Além disso, como a maioria dos animais que não apresentam separação de linhagem germinativa no início de seu desenvolvimento, as esponjas são capazes de realizar reprodução assexuada (Storer & Usinguer, 1983, Barnes, 2007, Pádua, 2016).
Em relação à reprodução sexuada, as espécies podem ser hermafroditas ou gonocóricas, apresentando, em sua grande maioria, desenvolvimento indireto com a produção de uma larva livre-natante. Existem espécies ovíparas, com fertilização e desenvolvimento externos, e espécies vivíparas, com fertilização interna, incubação e posterior liberação da larva (Maldonado & Bergquist, 2002; Maldonado & Riesgo, 2008).
No entanto, larvas de esponjas são lecitotróficas, ou seja, se alimentam do próprio vitelo armazenado, além disso, elas costumam ter pouco tempo de duração na coluna d’água e, consequentemente, apresentam uma baixa capacidade de dispersão com consequente comportamento filopátrico (do grego antigo:φύλο + πατρι = amor ao lar, a terra natal, (Philopatry is the tendency of an organism to stay in or habitually return to a particular area)) e populações com altos índices de endocruzamento (Maldonado & Bergquist, 2002; Maldonado, 2006).
A reprodução assexuada em esponjas se dá principalmente por brotamento, gemulação ou fragmentação seguido de regeneração.
No caso do brotamento, massas de células se formam no interior da esponja, são revestidas por colágeno e levadas para a superfície da esponja, de onde se destacam, aderem ao substrato e originam um novo indivíduo.
Já na gemulação as gêmulas são estruturas de resistência formadas principalmente por arqueócitos e células de reserva que são envoltos em uma estrutura de proteção (geralmente contendo espículas e material colagenoso). As gêmulas são encontradas principalmente em espécies de água doce e são fundamentais para a sobrevivência da espécie quando as condições ambientais são desfavoráveis (Simpson, 1984; Fell, 1993; Maldonado & Riesgo, 2008).

Gêmula
A fragmentação seguida por regeneração pode ser tanto um evento endógeno controlado pela própria esponja quanto ocasionada acidentalmente. Quando associada à reprodução sexuada, pode auxiliar inclusive na dispersão e colonização de novos ambientes, bem como no aumento da variabilidade genética das populações.
No entanto, a enorme capacidade de regeneração de esponjas adultas não se restringe a partes perdidas do corpo. Talvez a maior manifestação da grande plasticidade das esponjas seja sua capacidade de reagregação celular e formação de um novo indivíduo após dissociação.
Esta capacidade foi demonstrada pela primeira vez in vitro por Wilson
(1907) que foi seguido por diversos autores estudando o processo de reagregação celular e
reconstrução de um indivíduo funcional em diversas espécies. O processo de
reconstituição de esponjas funcionais a partir de células dissociadas passa por alguns
estágios morfogenéticos que são essenciais. O primeiro estágio é o de reagregação celular,
seguido do estágio de revestimento desses agregados por uma camada de pinacócitos
separando os meios interno e externo.
Tais agregados revestidos por pinacoderme foram
chamados primeiramente por termos genéricos como “esférula” ou “agregados” e depois
receberam o nome de diamorfos. Esses diamorfos representam o
estágio entre o final da agregação celular e o início do seu processo de reorganização em
uma esponja funcional (Pádua, 2016).
RESUMINHO
A reprodução assexuada dos poriferos pode ocorrer por:
Fragmentação
Esponjas apresentam uma grande capacidade de regeneração, de modo que fragmentos retirados do corpo de um organismo pode se desenvolver em um novo organismo.
Brotamento
A partir do organismo materno, brotos podem ser gerados formando uma colônia (broto + corpo materno). Com o desenvolvimento, o broto pode se separar e formar um indivíduo independente.
Gemulação
Em condições inviáveis de sobrevivência, alguns amebócitos podem se diferenciar em células chamadas de arqueócitos, que são, então, envolvidas por uma camada protetora, formando uma gêmula. Quando o ambiente passa a ter condições favoráveis de sobrevivências, essas gêmulas são liberadas no ambiente e geram novos organismos. Esse processo permite com que poríferos sobrevivam longos períodos em condições adversas, como secas e elevadas temperaturas.
A reprodução sexuada de espongiários envolve a formação dos gametas: o óvulo é formado a partir do amebócito e o espermatozóide é formado a partir do amebócito ou do coanócito.
Em espécies monóicas (hermafriditas), os gametas são formados e liberados em períodos diferentes.
Uma vez formados, os espermatozóides são liberados pelo ósculo e podem ser absorvidos pelos poros de outra esponja.
No interior do átrio, o espermatozóide é capturado por um coanócito e levado até o óvulo no mesohilo ou mesênquima, para que ocorra a fecundação. A partir da fecundação, é gerado um zigoto, que se desenvolve até formar uma larva flagelada (anfiblástula) livre natante na coluna d'água.
A larva é chamada de anfiblástula: quando possui flagelos em uma metade do seu corpo, ou é chamada de parenquímula, quando possui flagelos em todo o seu corpo.
Larva anfiblástula e parenquímula
Ao ser liberada para o ambiente ela nada até encontrar um local com condições favoráveis para se fixar e se desenvolver em uma esponja adulta.
CÉLULAS E ESTRUTURAS DAS ESPONJAS
PINACÓCITOS
Pinacócitos são células achatadas, irregulares, fortemente unidas que revestem e protegem todo o corpo da esponja.
Pinacócitos e sua terminologia
A superfície da esponja é formada por um tipo de célula plana chamada pinacócito (literalmente célula de "pavimento" e pinacoderme, um epitélio de pavimento).
Uma boa descrição da pinacoderme é dada por Simpson (1984) e De Vos et al. (1991).
Os pinacócitos são células finas (geralmente de 1 µm de espessura, exceto no núcleo) (até 20 µm de diâmetro) que formam uma camada escamosa. Em muitas esponjas, os pinacócitos têm a forma de um T, com o núcleo em um corpo celular que se projeta para baixo na camada média de colágeno.
Pinacodermes revestem a superfície da esponja e os canais e também revestem a cavidade interna e os canais das larvas das esponjas de água doce.
Pelo menos seis tipos de pinacócitos podem ser identificados por diferenças morfológicas ou posicionais. Os pinacócitos que formam a superfície externa da esponja são exopinacócitos, aqueles nas superfícies internas (em canais ou lacunas) são endopinacócitos e aqueles que formam a base da esponja e fornecem a fixação a uma superfície e que podem secretar um esqueleto calcário maciço (por exemplo Gilis, 2011) são distinguidos como basopinacócitos.
Além disso, a polaridade do sistema aquífero define os prefixos dados aos pinacócitos antes (pro) e depois (ap) das câmaras de alimentação, portanto, prosopinacócitos e apopinacócitos (Boury-Esnault e Rützler, 1997).
À medida que mais dados de expressão gênica se tornam disponíveis, com genes marcando regiões específicas de uma esponja, é cada vez mais importante usar uma terminologia que defina a localização com precisão. Podem ser esperadas diferenças, por exemplo, nas populações de canais de potássio ou receptores de glutamato em epitélios de canal incurrente e excurrente.
PORÓCITOS
Porócitos são células dotadas de um poro central que permite a passagem da água do meio externo para o átrio ou espongiocele.
COANÓCITOS
Coanócitos são células flageladas com uma expansão membranosa protéica em forma de colarinho (coana), que revestem a espongiocele e outras câmaras vibráteis internas das esponjas do tipo siconoides e leuconoides. O movimento dos seus flagelos cria a corrente de água que traz nutrientes e gases. Os nutrientes são filtrados pelo colarinho da célula, (estrutura gelatinosa semi-sólida, constituída antes por um conjunto de pequenos bastonetes eretos e separados por espaços. Qualquer partícula orgânica ou microrganismo planctônico (bacterias, algas, fungos, protozoários e resíduos) aprisionado no colarinho é encaminhado para baixo, em direção ao corpo celular onde ocorre a fagocitose. É no coanócito que ocorre a digestão intracelular, nos vacúolos digestivos que se ligam a lisossomos (organela que transporta enzimas digestivas).
MESÊNQUIMA OU MESOHILO
Mesênquina ou mesohilo é a região do corpo compreendida entre a pinacoderme (camada protetora externa) e a camada de coanócitos ou coanoderme (filtradora). É uma camada gelatinosa proteinácea onde se encontram os amebócitos, os arqueócitos, os colêncitos os escleroblastos e as espículas.
ARQUEÓCITOS
Arqueócitos são células indiferenciadas totipotentes, que podem dar origem aos diversos tipos celulares. Têm papel fundamental na distribuição de nutrientes e secundário na digestão dos alimentos. Originam brotos e gêmulas, ambos estruturas reprodutivas, bem como óvulos e espermatozóides.
AMEBÓCITOS
Amebócitos são célula totipotentes, com formato amebóide, que se movem por pseudopodes e que se originam dos arqueócitos. Podem se diferenciar nos outros tipos de células, e tem papel importante no transporte de nutrientes entre os coanócitos e os outros tipos de células do corpo da esponja.
ARQUEÓCITOS
A totipotência refere-se à capacidade da maioria, senão de todas as células do corpo das esponjas, de mudarem de forma e função de acordo com as necessidades específicas do indivíduo. As células totipotentes (como as células-tronco) ocorrem em todo o reino animal, mas sua capacidade de mudança geralmente ocorre apenas em uma direção: de uma célula-tronco para outra célula derivada (especializada). Nas esponjas, essas mudanças podem ocorrer em ambas as direções. Existem centenas de tipos diferentes de células nas esponjas, muitas cujas funções ainda não são conhecidas.
Os mais primitivos são os Arqueócitos (células fagocíticas amebóides que são as principais células de transporte para alimentação, digestão, transporte de oxigênio e reparo do corpo). Nas esponjas, os arqueócitos podem se desenvolver em qualquer outro tipo de célula e, em seguida, voltar quando necessário à forma anterior. Outras células incluem células esféricas (com funções de excreção e defesa química), espongiócitos (produzem colágeno) e escelerócitos (secretam espículas), entre muitas outras. As esponjas têm um metabolismo intracelular: elas capturam, comem, digerem alimentos e excretam produtos residuais dentro das células, e não em qualquer cavidade corporal comum. A alta mobilidade das células é, portanto, crítica para a sobrevivência da esponja.
ESCLERÓCITOS OU ESCLEROBLASTOS
Esclerócitos ou escleroblastos são células amebóides cuja função é formar as espículas.
ESPONGIÓCITOS
Espongiócitos são células encarregadas da secreção das fibras de espongina, para formação do esqueleto das esponjas.
ESPONGIOBLASTOS
originam as fibras de espongina (formada por colágeno)
ÁTRIO OU ESPONGIOCELE
Átrio ou espongiocele é o espaço ou cavidade interna nas esponjas asconóides. A parede do corpo das esponjas delimita uma cavidade central, chamada de átrio ou espongiocele que se abre no ósculo. Nas esponjas mais complexas não existe uma cavidade central, mas um labirinto de canais e câmaras revestidas de células flageladas, os coanócitos, chamadas de câmaras vibráteis.
AMEBÓCITOS
célula totipotentes, que se originam dos arqueócitos.
O esqueleto das esponjas é complexo e proporciona estrutura e sustentação para as células vivas do animal. A maioria das esponjas tem o esqueleto formado por fibras de espongina juntamente com estruturas chamadas espículas que tem formado de pequenas agulhas cristalinas de sílica ou carbonato de cálcio. O esqueleto é constituído por uma rede de espículas rígidas e fibras flexíveis, secretados por células especiais. As fibras de esponginas são secretadas pelos espongioblastos e as demais pelos esclerócitos ou escleroblastos. A combinação das dimensões, do tipo de da distribuição das espículas bem como sua relação com o esqueleto fibroso é a principal característica utilizada para identificar as esponjas (Mothes, 2003).
ESCLERÓCITOS OU ESCLEROBLASTOS: células ameboides cuja função é formar as espículas.
Espícula
(Fonte: futurascience)
Espícula como um dos elementos estruturais do esqueleto das esponjas.
(Fonte: Hannes Grobe, e sponge espicule)
COLÊNCITOS/LOFÓCITOS
Colêmcitos e ou Lofócitos são células especializadas em secretar colágeno.
Os colêncitos secretam colágeno que é importante para a sustentação e manutenção do corpo multicelular animal. (Alguns autores e artigos consultados fazem uma distinção entre colêncitos e lofócitos; sendo os colêncitos células fixas que ficam ancoradas por fibras citoplasmáticas e são especializadas em secretar colágeno, enquanto que os lofócitos são células móveis, que secretam as fibras de colágeno dispersas.
Scaning electron microscopy (SEM) image of anastomosed spongin fibers fromthe demosponge Hippospongia communis, which are organized as sets of unconnected structures withdendritic architecture.
(Imagem de microscopia eletrônica de varredura (SEM) de fibras esponjosas anastomosadas da demosponge Hippospongia communis, que são organizadas como conjuntos de estruturas não conectadas com arquitetura dendrítica) (Herlich et alii, 2018, Nielsen, 2019).
Rede de espongina vista em microscopia ótica.
A esponja marinha Hippospongia communis (Demospongiae: Porifera) é uma representante das esponjas de banho, e essa espécie possue um esqueleto fibrosos característico livres de minerais, constituído de uma proteína estrutural que como ja vimos se chama espongina. Este esqueleto fibroso é mecanicamente robusto, resistente ao tratamento ácido e termicamente estável até 160 ° C. (Szatkowski et alii, 2015).
Estrutura de uma fibra de Espongina mostrando as fibrilas individuais e uma pequena sequência de aminoácidos nas tríplice alfa-hélices.(modificado de Szatkowiski, et alii, 2018).
A photograph of H. communis marine sponge (up); colored SEM photograph of three-dimensional porous structure of H. communis spongin-based skeleton (down)(Szatkowski et alii, 2015).
Evolução e relacionamento entre
os tipos de esponjas
Esponjas são um táxon diversificado de animais aquáticos bentônicos de grande importância ecológica, comercial e biofarmacêutica.
Eles são indiscutivelmente o táxon metazoário de ramificação mais antiga e, portanto, eles têm grande significado na reconstrução da evolução inicial dos metazoários como um todo.(Dohrmann et alii, 2012)
No entanto, a filogenia e a sistemática das esponjas ainda estão, em certa medida, não resolvidas, e há um debate em andamento sobre o padrão exato de ramificação de seus clados principais e suas relações com outros animais não bilaterais.
Atualmente reconhece-se para os poríferos cinco classes, uma delas já extinta (Archaeocyata) e quatro ainda existentes (Calcarea Bowerbank, 1864, Demospongiae Sollas, 1885, Homoscleromorpha Bergquist, 1978 e Hexactinellida Schmidt, 1870).
Destas quatro classes a classe Demospongiae é a maior classe contendo 90% de todas as espécies de esponjas viventes (MURICY et al., 2008). Ao todo fazem parte do filo cerca de 22 ordens, 128 famílias e 680 gêneros, mas muitos destes táxons mais elevados estão em discussão devido a novos “insights” obtidos a partir de métodos sistemáticos moleculares e novas considerações a respeito de suas características morfológicas (MORROW; CÁRDENAS, 2015).
Para reconher-se esses taxa, o estudo das estruturas de sustentação, como fibras de espongina e espículas, é fundamental na taxonomia de Porifera, uma vez que é com base nestes caracteres que se determina a classificação destes animais (BERGQUIST, 1978).
Classe Calcarea
(calcis, calcário) (calcispongie).
Apresenta espículas de carbonato de cálcio que, frequentemente, formam uma franja ao redor do ósculo (saída principal da água); espículas aculeiformes ou com três ou quatro raios; todos os três tipos de sistemas de canais (asconoide, siconoide, leuconoide) estão representados; todas marinhas. Exemplos: Sycon, Leucosolenia, Clathrina.
Classe Hexatinelida
(hex, seis, + aktis, raio + -ellus, sufixo diminutivo) (Hyalospongiae).
Apresenta espículas silicosas de seis raios que se estendem em ângulos retos de um ponto central; espículas frequentemente unidas formando uma malha; corpo frequentemente cilíndrico ou em forma de funil; câmaras flageladas em arranjo siconoides simples ou leuconoide; maioria com habitat de águas profundas; todas marinhas. Exemplos: a cesta-de-vênus (Euplectella), Hyalonema.
Classe Demospongiae
(demos, povo, + spongos, esponja).
Apresenta espículas silicosas, ou espongina, ou ambos; sistemas de canais do tipo leuconoide; uma família encontrada em água doce; todas as outras marinhas. Exemplos: Amphimedon, Cliona, Spongilla.
Classe Homoscleromorpha
(homos, igual, + skleros, duro, + morphe, forma).
Previamente considerado como um subgrupo de Demospongiae; espículas podem estar ausentes como em Oscarella; se presentes, as espículas são pequenas, simples em relação a sua forma, e não formam ao redor de um filamento axial; pinacoderme com uma clara membrana brasal. Exemplos: Oscarella, Corticium.
Cladograma (modificado de vários autores)
Alternative scenarios for the higher-level relationships of extant sponges. Left: sponge paraphyly (e.g. Sperling et al., 2009). According to this scenario, a sponge-like body plan (white circle) was acquired in the last common ancestor of Porifera and Epitheliozoa (sensu Ax, 1996; Cnidaria, Ctenophora, Placozoa, Bilateria) and subsequently lost (red circle) from the last common ancestor of Epitheliozoa. Alternative paraphyly scenarios exist mainly in earlier studies, where homoscleromorphs were often not included (see text for details). Right: sponge monophyly (e.g. Philippe et al., 2009). According to this scenario, the sponge-like body plan (white circle) was acquired either in the stem lineage of Porifera (P) or, if choanocytes are considered homologous to choanoflagellate cells as judged by outgroup comparison to the well-established sister group of the Metazoa, the Choanoflagellata (see text for details), in stem-group metazoans (S). The latter scenario would require one gain and one loss (indicated by white/red dots marked with S), as in the paraphyly hypothesis (Dohrmann et alii, 2012).
Homoscleromorpha
Homoscleromorpha is a recently recognized class within the phylum Porifera. While molecular analyses support monophyly of Homoscleromorpha, morphological data are largely lacking. Here, we investigate and comparatively analyze the detailed morphology of kinetids (flagellar apparatus) in choanocytes of ten Oscarella species. The kinetid is known to be a phylogenetically important trait that can possibly reflect relationships of sponges at the level of orders. We also conduct a phylogenetic analysis based on previously published sequences. We found the family Oscarellidae is subdivided into two large groups, and choanocyte kinetids structure strongly supports this division. The first group includes Oscarella lobularis, O. tuberculata, O. bergenensis, O. viridis, O. rubra, O. malakhovi, O. microlobata, O. carmela, O. filipoi, and O. zoranja. These species possess nuclei located in a basal position without any connection to the kinetosome. The second group includes O. balibaloi, O. nicolae, O. kamchatkensis, O. pearsei, O. imperialis, and Pseudocorticium jarrei, whose nuclei are connected with the kinetosome. In addition, this second group also shares mesohylar spherulous cells harboring paracrystalline inclusions. The choanocyte kinetid structure seems to be an essential phylogenetic and diagnostic morphological trait, and we propose to include it in future species descriptions. Our results imply assignation of the second group to the genus Pseudocorticium. This taxonomic suggestion, however, needs additional data on the remaining Oscarella species.
Hipótese sobre o relacionamento entre os metazoários e poríferos
A phylogeny of Metazoa adapted from Philippe et al 2009 which considers Porifera monophyletic. Sponge phylogeny is adapted from [48]. Freshwater sponges belong to the group indicated with a box (G4). Letters indicate evidence of epithelial characters: (a) transepithelial resistance (TER) and transepithelial potential (TEP) in freshwater sponges; (b) septate junctions in calcareous sponges; (c) a basement membrane in homoscleromorphs; (d) absence (loss?) of a basement membrane in placozoans; (e) true epithelia with septate junctions, a basal lamina, TER and TEP in cnidarians and bilaterians. Arrows indicate three potential origins of epithelia; the solid bar indicates the most parsimonious scenario for the origin of epithelia (2*).
Structure of the sponge epithelium.
(A) Diagram of the experimental chamber, and (B) scanning electron microscopy (SEM) of sponge tissue showing: the bilayered dermal tissues (dt), suspended over the subdermal space (ss) by shafts of spicules (s); the choanosome (ch) with the choanocyte pumps; excurrent canals (ec); and an osculum (o). For transepithelial recordings, apical (AP) and basolateral (BL) compartments were effectively separated by two confluent cell layers - the basopinacoderm (bp) and endopinacoderm (enp) - surrounding a thin mesohyl (me) (inset); scale bar b, 100 µm. (C) SEM of the dermal tissue shows exopinacocytes are very close to one-another (opposing arrows show cell-cell spacing); scale 1 µm. (D) Fluorescent labelling of the basopinacoderm with the steryl dye FM 1–43 highlights the borders of cells showing that a confluent layer of cells covered culture membranes; scale 10 µm. (E) Transmission electron microscopy of exopinacocytes shows tight membrane apposition between adjacent cells (arrow). These areas were associated with 10 nm diameter cytoskeletal fibres (arrowheads); scale 200 nm. (F) Fluorescent labelling using phallacidin reveals dense plaques of actin (arrowhead) between cells; nuclei, blue; scale, 5 µm.
RESUMINHO
Estrutura Corporal e Sistema Aquífero
• Pinacoderme: superfície externa do corpo da esponja, formada pelos pinacócitos.
• Coanoderme: superfícies internas, compostas por células flageladas, coanócitos; com apenas 1 célula de espessura; pode ser simples e contínua ou dobrada e subdividida formando câmaras;
• Mesoílo: camada intermediária entre pinacoderme e coanoderme; constituído por uma matriz coloidal acelular, com fibras de colágeno, espículas e vários tipos de células; tem papel importante na digestão: transporte de nutrientes, produção de gametas, secreção do esqueleto e excretas por células amebóides.
• Porócitos: poros unicelulares. Neste tipo de célula tubular a agua entra na esponja
• Poros dérmicos ou óstios: pequenas aberturas na pinacoderme;
• Endopinacócitos: células da pinacoderme que recobrem canais internos.
Tipos celulares
1) Células delimitadoras de superfícies:
i. Pinacócitos: formam a pinacoderme – camada contínua superficial externa das esponjas e também revestimento dos canais inalantes e exalantes;
• Endopinacócitos: pinacócitos internos que revestem os canais;
• Exopinacócitos: revestimento externo dos canais;
• Basopinacócitos: células externas da região basal ou de adesão ao substrato – secretam complexo fibrilar de colágeno-polissacarídeo = lâmina basal;
• Em esponjas dulcícolas, basopinacócitos são ativos na nutrição, lançam filapódios, semelhantes às amebas.
ii. Porócitos: células cilíndricas, como tubos, localizadas na pinacoderme – forma os óstios (Lat. Ostium = porta, entrada);
• São contráteis – podem abrir e fechar o poro – regulação do diâmetro dos óstios;
iii. Coanócitos:
célula flageladas com colarinho, formam a coanoderme e criam correntes hídricas no sistema aquífero.
• Longo flagelo é rodeado pelo colar com 20 a 55 microvilos citoplasmáticos;
• Coanócitos localizam-se sobre o mesoílo (internamente ou em câmaras);
• Atuam na captura de partículas alimentares (fagocitose e pinocitose);
Habitat
Marinho e dulcícola
Nutrição
Heterotrófico por filtração
Fototrófica (simbiose com bactérias)
Espongiose
Ulisses dos Santos Pinheiro (2008)
Departamento de Zoologia – CCB/UFPE
Espongiose se refere a acidentes com esponjas que normalmente causam inflamações no tegumento atingido. Um dos indícios da espongiose é a coceira, além de forte reação alérgica, a qual pode requerer cuidados médicos urgentes. Isto normalmente ocorre por que as esponjas, ao morrerem, têm seu colágeno completamente decomposto, liberando para o ambiente todo seu esqueleto silicoso que é composto por espículas. Estas espículas penetram no tegumento causando as inflamações. Segundo Machado (1947), os Carajás (uma das tribos indígenas amazônicas) usavam espículas de esponjas de água doce para fabricar cerâmica. Esse autor descreve que “os indígenas pulverizam espongiários, calcinados previamente ou não, e adicionam à argila com que fabricam peças de sua cerâmica”. As mãos das oleiras indígenas que trabalhavam com cauxí (argila mista com espículas de esponjas) possuíam dermatite purulenta. Hilbert (1955) chama a atenção para a preferência dos caboclos pelo caripé (argila mista com cinzas de tecidos vegetais pertencentes a licania, uma rosácea) ao invés do cauxí. Os motivos por essa escolha estavam relacionados com os inchamentos das mãos causadas pelo cauxí e, ainda, porque os utensílios de cozinha fabricados com esse material causavam desarranjos estomacais.
Um dos casos de espongiose mais recente foi o surto de dermatites e cegueiras ocorrido em Araguatins (Tocantins). Sua população ao entrar em contato com a água do rio da região sofriam de vários casos de dermatite e cegueiras. O fato curioso é que estes acidentes só ocorriam na época de águas baixas, não ocorrendo sintomas na época da cheia. Após uma ampla investigação científica, Volkmer-Ribeiro et al. (2006) concluíram que tais lesões eram causadas por duas espécies de esponjas Drulia uruguayensis e Drulia ctenosclera, que ao morrerem liberam na coluna d’água muitas espículas, sendo a gemosclera (espículas das gêmulas) o principal agente causador de acidentes oculares e dermatites. No caso de Araguantins tal acumulo de espículas foi conseqüência de alterações antrópicas que geraram o desequilíbrio no meio.
Outra espécie de esponjas de água doce com as quais já foram registrados acidentes é a Sterrastrolepis brasilinesis, uma esponjas endêmica da Bacia do Paraná, conhecida popularmente como “espinho de pedra”. Esta espécie possui projeções cônicas que ficam aderidas fortemente ao substrato rochoso e por serem extremamente duras, ao inadvertidamente pisar nestas esponjas, os banhistas acabam perfurando os pés.
Parede do corpo de uma esponja e suas células e tipos morfológicos
Exercícios para voce publicar no seu blog
1) (10 escores) Faça um esquema do corpo de uma esponja em seu caderno e coloque os nomes nas estruturas constituintes e dê a função de cada uma dessas estruturas.
2) (2) Descreva a digestão nesses organismos. (Faça um esquema em seu caderno da digestão intracelular nesses organismos e explique todo o processo).
3) (2) Cite a apomorfia desses animais e faça um esquema da mesma e dê os nomes das estruturas.
4) (4) Que características ancestrais os organismos do sub-reino PARAZOA compartilham com os do sub-reino EUMETAZOA?
5) (5) Construa um cladograma dos Metazoários e coloque as apomorfias relativo a cada ramo (clado) existente.
6)(4) Leia o texto abaixo: "Espongiose" de Ulisses dos Santos Pinheiro (2008) (acima), extraído de um importante trabalho sobre esponjas publicado na Revista Eletrônica do Museu Nacional e USP Ciências e responda as seguintes questões:
a) O que tem nas esponjas que pode causar irritações nos tecidos humanos?
b) Após ler o texto, pesquise para que serve a sílica atualmente para nós humanos.
c) Como é chamada a doença causada pelas esponjas
7) (4) O tamanho e a forma das esponjas variam muito, entretanto, o fluxo de água no interior das espojas sempre segue o seguinte sentido: poros → átrio → ósculo.
Baseando-se nas informações acima, no esquema e no seu conhecimento sobre o modo de vida dos poríferos, explique a importância ecológica das esponjas para a saúde dos ambientes aquáticos, indicando o tipo mais eficiente, justificando a indicação.
8) (3) Uma esponja é capaz de movimentar um volume de água considerável. Estudos mostram que algumas esponjas grandes (2m3 de volume e um poro com 50 micrômetros de diâmetro) podem bombear seu próprio volume em água a cada 20 segundos. Sendo assim, que volume de água essa esponja bombeará em 1minuto?
9) (5) Descreva através de um esquema o desenvolvimento embrionário dos metazoários, salientando sua apomorfia.
10) (3) Explique por que o tamanho das esponjas não pode ser muito grande.
VÍDEOS PARA VER AO ESTUDAR ESPONJAS
LIVRO

Remédios do mar
Pesquisa de recursos marinhos encontra substâncias antitumorais em esponjas e tunicados do litoral
Ana Maria Fiori
Edição 67 (2001)
Didemnum granulatum Tokioka, 1954
(Fonte: INPN)
Ascídia Didemnum granulatum: substâncias contra tumores
ARQUIVO JOSÉ CARLOS FREITAS
Segundo país com a maior costa contínua no mundo, o Brasil tem um litoral que se estende por cerca de 8 mil quilômetros e só perde para o da Austrália. É uma posição privilegiada para a exploração racional de recursos marinhos, o que inclui a obtenção de substâncias com potencial de uso em sistemas biológicos, como as que foram pesquisadas num projeto temático sobre recursos renováveis do litoral paulista.
Pesquisadores de várias instituições, que se concentraram no estudo de poríferos (esponjas) e tunicados, descobriram num desses seres vivos duas substâncias com potencial farmacológico inédito em tumores, para as quais já se fez pedido de patente. Encontradas no organismo de um tunicado, a ascídia Didemnum granulatum, as substâncias granulatimida e isogranulatimida são apenas dois dos compostos inéditos que foram isolados e identificados.
Novas espécies
Antes do estudo, havia só 34 espécies de esponjas identificadas na área. Coletas que os pesquisadores fizeram no canal e na costa da ilha de São Sebastião aumentaram esse número para mais de 140 espécies – quase metade das cerca de 300 já registradas na costa brasileira. Das esponjas retiradas numa faixa de cerca de 50 quilômetros de extensão, no perímetro do canal, dez eram inéditas para a ciência, entre elas a Aplysina caissara, também com potencial antitumoral.
Para coletar e estudar esponjas e tunicados, o biólogo e taxonomista Eduardo Carlos Meduna Hadju mergulhou mais de 200 vezes na costa de Ilhabela. Por quase dois anos, ele praticamente morou em São Sebastião. Hadju, que é pesquisador do Museu Nacional da Universidade do Brasil e no início do projeto estava vinculado à Universidade de São Paulo (USP), recebia duas ou três vezes por ano a visita de Roberto Gomes de Souza Berlinck, um pós-doutorado em química de animais marinhos da USP de São Carlos. Com Hadju, que havia levantado a distribuição das espécies na região, Berlinck selecionou os animais coletados para a extração de substâncias e enviou os extratos para o laboratório do biólogo José Carlos de Freitas, coordenador do projeto, para testes farmacológicos.
Patente contra câncer
Os extratos das substâncias coletadas são feitos de modo muito simples. O animal é posto no álcool, etanol ou metanol, e as substâncias que contém se dissolvem nesse meio. Depois que o álcool evapora, o extrato é submetido a um teste farmacológico preliminar realizado pela equipe de Freitas, que dirige o Centro de Biologia Marinha (Cebimar) da USP.
Durante estágio no exterior, Berlinck também submeteu 40 extratos a um teste novo, que acabara de ser desenvolvido no Canadá. Alguns extratos se revelaram ativos e o que mostrou melhor desempenho, ou seja, maior atividade na menor concentração, foi justamente o retirado da ascídia Didemnum granulatum encontrada no litoral de São Paulo e Paraná.
Junto com Raymond J. Andersen, da Universidade da Colúmbia Britânica, no Canadá, Berlinck descobriu a granulatimida e a isogranulatimida, substâncias com potencial farmacológico inédito em tumores. Em março de 1998, a universidade canadense fez em nome de ambos um pedido de patente dessas substâncias, o que está sob avaliação.
O teste farmacológico foi feito em células humanas de câncer de mama e detectou, basicamente, a interferência das substâncias na organização do DNA (ácido desoxirribonucléico, portador do código genético) durante o processo da divisão celular. Nesse processo, as substâncias inibem o chamado ponto de checagem G2. As células fazem duas paradas para verificar a integridade do material genético. A primeira parada, ou ponto de checagem G1, acontece logo depois da divisão celular, para verificar se o material genético não foi danificado no processo. Então a célula tem um certo tempo de vida, que nos mamíferos é de 24 horas, antes de se dividir novamente.
Nesse período, cada célula faz nova verificação bioquímica, o ponto de checagem G2. “Cerca de 50% das células de tumores sólidos”, explica Berlinck, “não têm o ponto de checagem G1 ativo e esse é um dos motivos pelos quais elas são, digamos, anormais. Se você inibe o ponto de checagem G2, como fazem a granulatimida e a isogranulatimida, começa uma alta mortalidade de células durante a divisão, porque o DNA já está muito danificado e não serve mais para manter a célula viva”.
Os pesquisadores associaram radioterapia às novas substâncias, para inibir totalmente o funcionamento do DNA e garantir a morte das células. A dose de radiação foi baixa e o resultado mostrou a ação seletiva da granulatimida e da isogranulatimida.
Infecção hospitalar
Entre os compostos inéditos isolados durante as pesquisas estão quatro alcalóides, haliclonaciclamina E, arenosclerina A, B e C, obtidos na esponja Arenosclera brasiliensis, que só existe no Brasil.
Arenosclera brasiliensis
Esses compostos mostraram atividade citotóxica e antibiótica contra microrganismos resistentes a antibióticos, os que causam infecções hospitalares.
Noutra esponja, a Aplysina caissara, que também só existe aqui, a equipe detectou grande quantidade do alcalóide aeroplisinina-1, também com potencial de ação antitumoral. Nos anos 60, pesquisadores italianos já haviam encontrado noutra esponja a mesma substância, que hoje passa por testes clínicos em seres humanos. Caso os resultados sejam positivos, o Brasil poderia fazer maricultura da Aplysina caissara e se tornar fornecedor desse alcalóide.
Underwater photography. Aplysina caissara (A) and Aplysina fulva (B), both from the São Sebastião channel area, Brazil. Scale bars 2 cm.
Para o coordenador Freitas, quanto mais se conhece a biodiversidade marinha, maior a probabilidade da descoberta de substâncias com potencial farmacológico, porque a diversidade química está diretamente ligada à biológica.
Poríferos e tunicados, em especial, são fontes potenciais de compostos bioativos. O pesquisador acentua que “esses grupos também têm importância estrutural em diversos ecossistemas e são uma das prioridades globais no estudo da biodiversidade marinha”.
Presença no AZT
Muitas substâncias já foram isoladas em todo o mundo na pesquisa com organismos marinhos, mas poucas estão em testes clínicos. Todo o processo, da descoberta de uma substância até sua chegada ao mercado exige, cerca de 15 anos, entre estudos, testes e aprovação de patente. No entanto, derivados sintéticos da espongouridina e da espongotimidina, substâncias isoladas de esponjas nos anos 50, foram para o mercado como antileucêmico e antiviral e serviram de modelo para o desenvolvimento do AZT, remédio básico no tratamento da Aids.
Em tese, qualquer substância pode ser sintetizada, mas a síntese pode demorar muito tempo, enquanto num organismo cultivado e manejado a biossíntese é bem rápida. “Por isso”, acentua Freitas, “há necessidade da interação dos químicos com os biólogos marinhos, conhecedores dos ciclos de vida detalhados dos animais e do meio ambiente adequado para a sua criação”.
Busca e monitoramento
O coordenador ressalta que a pesquisa com substâncias do mar tem duas facetas: “Uma é fazer um rastreamento bioquímico de produtos naturais, para verificar atividades biológicas e identificar moléculas ainda desconhecidas da ciência, até com bioatividades também inéditas”. “A outra linha”, prossegue, “é o monitoramento dos efeitos de moléculas já conhecidas, no ambiente e na saúde das pessoas”.
Freitas, que também é pesquisador do Centro de Toxinologia Aplicada, um dos Centros de Pesquisa, Inovação e Difusão (Cepids) qualificados pela FAPESP, tem, por exemplo, um aluno encarregado de monitorar a presença de toxinas no pescado e nos frutos do mar consumidos por caiçaras e turistas no litoral de São Sebastião.
Uma das substâncias nocivas é a tetrodotoxina, que foi identificada na década de 50, existe em qualquer mar e é encontrada em peixes, algas, tunicados e outros organismos marinhos.
A tetrodotoxina já matou muitas pessoas no Japão, mas hoje, graças ao monitoramento, isso é raro. No litoral brasileiro, um peixe rico em tetrodotoxina é o baiacu-rouba-isca ou baiacu-pintado (Sphoeroides spengleri), odiado pelos pescadores tanto por roubar a isca do anzol como por sua toxicidade: ingerir 50 gramas dele é uma sentença de morte.
Por experiência e tradição, os caiçaras sabem que esse peixe não deve ser consumido, ao contrário do baiacu, de maior porte, cujos filés são encontrados nas peixarias.
Também o fenômeno ambiental da maré vermelha pode levar toxinas direta ou indiretamente ao ser humano. Trazida pela proliferação de um dos pequenos organismos do plâncton marinho, ora um, ora outro, às vezes a maré vermelha é causada por uma espécie tóxica. Organismos filtradores, como mexilhões e tunicados, acabam por concentrar a toxina em seus tecidos pois se alimentam por filtração, o que causa problemas, como diarréias, em quem os ingere.
A maioria das marés vermelhas acontece com a proliferação de alguma alga microscópica, mas também podem ser provocadas por animais: no litoral paulista, já houve uma causada pelo protozoário ciliado Mesodinium rubrum e outra pelo tunicado Weelia cilindrica.
Freitas, que nasceu em São Sebastião e é filho de pescador, pretende prosseguir com essas pesquisas. Há muitas outros outros estudos em desenvolvimento na USP para investigar novas substâncias, encontradas em algas, anêmonas e outros organismos marinhos. Para esse tipo de pesquisa, é crucial o trabalho dos taxonomistas como Hadju, que criou, com verba do projeto, a página Porifera Brasil (www.geocities.com/labpor), além de um CD-ROM em versão demo, que identificam esponjas do canal de São Sebastião.
Esponjas e tunicados, organismos filtradores
Conhecidos como esponjas, os poríferos são os animais pluricelulares mais primitivos que existem. Surgiram há mais de 1 bilhão de anos e, embora habitem quase todos os ambientes aquáticos, predominam no mar.
São animais filtradores, têm a estrutura do corpo porosa, daí o nome Poriphera dado ao seu filo, uma das divisões da taxonomia ou ciência da classificação dos seres vivos.
As esponjas habitam águas rasas ou profundas e fixam-se na areia, no lodo ou sobre as rochas ou sobre troncos, no caso de esponjas de água doce. A grande variação de formato e cores faz com que às vezes sejam confundidas com algas ou outros organismos.
Seu tamanho vai de alguns milímetros até mais de 1 metro de altura, em algumas espécies. As colônias que formam podem recobrir vários metros do substrato aquático.
Algumas, como as do gênero Spongia, encontrado no México e no Japão, têm o corpo sustentado por fibras de espongina, proteína semelhante ao colágeno, dispostas de tal modo que as tornam apropriadas ao uso como esponja de banho.
Outros grupos de esponjas não são macios: têm o esqueleto formado por espículas de sílica ou carbonato de cálcio e também há casos em que o esqueleto é de calcário maciço.
O biólogo Eduardo Hadju explica que as esponjas retiram os nutrientes necessários à sua sobrevivência de partículas orgânicas transportadas pelas correntes aquáticas. Essas partículas circulam no organismo por um sistema de canais exclusivo, o sistema aqüífero.
O pesquisador trabalha na revisão taxonômica de uma subordem de esponjas da classe Demospongiae, grupo muito abundante e pouco investigado do litoral brasileiro.
Esponjas do litoral brasileiro
Esponja Didemnum commune
1. Multicellular; body an aggregation of several types of cells differentiated for various functions, some of which are organized into incipient tissues of a low level of integration
2. Body with porocites (porus cell) and pores (ostia) cell wall apertures, canals, and chambers that form a unique system of water currents on which sponges depend for food and oxygen
3. Habitat marine and freshwater; all aquatic (lentic and lotic freshwater)
4. Assymmetry or radial body simetry
5. Outer surface covered with flat cells: pinacocytes; most interior surfaces lined with flagellated collar cells (choanocytes) that create water currents; a gelatinous protein matrix called mesohyl or mesenquime contains amebocytes of various types and skeletal elements called spicules
6. Skeletal structure of fibrillar collagen (a protein) and calcareous or siliceous crystalline spicules, often combined with variously modified collagen (spongin)
7. No organs or true tissues; digestion intracellular; excretion and respiration by diffusion.
8. Reactions to stimuli apparently local and independent in cellular sponges, but electrical signals in syncytial glass sponges; nervous system absent
9. All adults sessile and attached to substratum
1. Reproduction: asexual reproduction by buds or gemmules and sexual reproduction by eggs and sperm; free-swimming flagellated larvae
2. Body with porocites (porus cell) and pores (ostia) cell wall apertures, canals, and chambers that form a unique system of water currents on which sponges depend for food and oxygen
3. Habitat marine and freshwater; all aquatic (lentic and lotic freshwater)
4. Assymmetry or radial body simetry
5. Outer surface covered with flat cells: pinacocytes; most interior surfaces lined with flagellated collar cells (choanocytes) that create water currents; a gelatinous protein matrix called mesohyl or mesenquime contains amebocytes of various types and skeletal elements called spicules
6. Skeletal structure of fibrillar collagen (a protein) and calcareous or siliceous crystalline spicules, often combined with variously modified collagen (spongin)
7. No organs or true tissues; digestion intracellular; excretion and respiration by diffusion.
8. Reactions to stimuli apparently local and independent in cellular sponges, but electrical signals in syncytial glass sponges; nervous system absent
9. All adults sessile and attached to substratum
1. Reproduction: asexual reproduction by buds or gemmules and sexual reproduction by eggs and sperm; free-swimming flagellated larvae
Bibliografia
RUPPERT, E. E., FOX, R. S., & BARNES, R. D. Invertebrate zoology: a functional evolutionary approach. Belmont, CA, Thomson-Brooks/Cole.2004.
Mandal, Fatik Baran. Biology of non-chordates. West Bengal, Bakura Christian College. 2018.
CAMPBELL; N. RICE, J.B. e cols. Biologia. Porto Alegre, Artmed Ed. S.A.2010.
ERESKOVSKY, Alexander V. The Comparative Embryology of Sponges.
ERESKOVSKY, Alexander V. The Comparative Embryology of Sponges.
Dordrecht; St. Pertersburg Univ. Press; Springer Science, 2010.
Müller, W. E. G. and Müller I. M. Porifera: an enigmatic taxon disclosed by molecular biology. Porifera research: Biodiversity, innovationand sustainaBility. 2007 - Cell biology.
A. Padua and M. Klautau. Regeneration in calcareous sponges (Porifera).
Journal of the Marine Biological Association of the United Kingdom, 2016, 96(2), 553–558.
ESPONJAS BRASILEIRAS DE ÁGUA DOCE E MARINHAS
http://www.poriferabrasil.mn.ufrj.br/2-pesquisa/pinheirous-08/pinheirous-08-p3.htm
https://www.researchgate.net/figure/278640410_fig12_Figure-4-4-Schematic-drawings-of-different-types-of-embryonic-morphogenesis-in-sponges
https://www.lume.ufrgs.br/bitstream/handle/10183/15953/000694887.pdf?sequence=1
https://www.scielo.br/pdf/rbzool/v22n4/a07v22n4.pdf
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4265756/
https://pt.slideshare.net/guest17042e9/filo-porifera?from_action=save
https://www.youtube.com/watch?v=YjqMvMLEw60
https://www.youtube.com/watch?v=Y4uc9cSolDk
https://www.researchgate.net/figure/Habitus-of-freshwater-sponges-Spongillina-Growth-form-ranges-from-small-thin-crusts-to_fig5_282566875
http://www.planetainvertebrados.com.br/index.asp?pagina=especies_ver&id_categoria=28&id_subcategoria=0&com=1&id=138&local=2
http://biologicamente20.blogspot.com/2018/06/zoologia-ii-filo-porifera.html
https://www.ppgbbe.intranet.biologia.ufrj.br/wp-content/uploads/2019/10/Tese-A.-Padua-versa%CC%83o-final-.pdf
https://litoraldegranada.ugr.es/el-litoral/el-litoral-sumergido/fauna/esponjas/
https://www.researchgate.net/publication/322179407_Sponge_Reproduction
https://www.britannica.com/animal/sponge-animal/Regeneration
http://www.usp.br/cbm/oceano/oceano.html
http://cifonauta.cebimar.usp.br/media/11622/
http://www.poriferabrasil.mn.ufrj.br/2-pesquisa/pinheirous-08/pinheirous-08-p3.htm
https://www.researchgate.net/figure/278640410_fig12_Figure-4-4-Schematic-drawings-of-different-types-of-embryonic-morphogenesis-in-sponges
https://www.lume.ufrgs.br/bitstream/handle/10183/15953/000694887.pdf?sequence=1
https://www.scielo.br/pdf/rbzool/v22n4/a07v22n4.pdf
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4265756/
https://pt.slideshare.net/guest17042e9/filo-porifera?from_action=save
https://www.youtube.com/watch?v=YjqMvMLEw60
https://www.youtube.com/watch?v=Y4uc9cSolDk
https://www.researchgate.net/figure/Habitus-of-freshwater-sponges-Spongillina-Growth-form-ranges-from-small-thin-crusts-to_fig5_282566875
http://www.planetainvertebrados.com.br/index.asp?pagina=especies_ver&id_categoria=28&id_subcategoria=0&com=1&id=138&local=2
http://biologicamente20.blogspot.com/2018/06/zoologia-ii-filo-porifera.html
https://www.ppgbbe.intranet.biologia.ufrj.br/wp-content/uploads/2019/10/Tese-A.-Padua-versa%CC%83o-final-.pdf
https://litoraldegranada.ugr.es/el-litoral/el-litoral-sumergido/fauna/esponjas/
https://www.researchgate.net/publication/322179407_Sponge_Reproduction
https://www.britannica.com/animal/sponge-animal/Regeneration
http://www.usp.br/cbm/oceano/oceano.html
http://cifonauta.cebimar.usp.br/media/11622/
Aplicações da espongina na tecnologia
https://www.mdpi.com/1660-3397/16/3/88/htm
Geral
BARNES, R. Invertebrate Zoology (modificado)
CAMPBELL; N. RICE, J.B. e cols. 2010. Biologia. Porto Alegre, Artmed Ed. S.A.
ERESKOVSKY, Alexander V. The Comparative Embryology of Sponges
Dordrecht; St. Pertersburg Univ. Press; Springer Science, 2010.
ESPONJAS BRASILEIRAS DE ÁGUA DOCE
Para uma visão alternativa sobre tecidos em esponjas
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0015040#pone.0015040-Borchiellini1
https://segundocientista.blogspot.com/2015/05/filo-poriphera-poriferos.html
Welsh, F.S., 1975. The Peter Wentz House: 18th Century Sponge Painting in Pennsylvania. Bulletin of the Association for Preservation Technology, 7(2): 124-130.
Aristophanes, 405 B.C. (1997). Batracomachia (The Frogs). University Press, Oxford: 272 Pp. 7.
Plato, 360 B.C. (2004). Sophista (Sophist). Kessinger Publishing Co., Kila: 144 Pp. 8.
Athenaeus, N., 170-230 B.C. (1927-1941). Deipnosophistae (The Deipnosophists). University Press, Harvard: 7 Vols. 9.
Voultsiadou, E., 2007. Sponges: an historical survey of their knowledge in Greek antiquity. Journal of the Marine Biological Association of the United Kingdom, 87: 1757-1763.
Haeblerle, E.J., 1981. Fertility and infertility: a historical overview. In: Nijs P. and Brosens I. (eds), Reversibility of Sterilization. Psycho(patho)logical Aspects, Acco, Leuven: 37-50.
Edelman, D.A. North, B.B., 1987. Updated pregnancy rates for the Today contraceptive sponge. American Journal of Obstetrics and Gynecology, 157(5): 1164-1165.
McLaren, A., 1992. A history of contraception from antiquity to the present day. Blackwell Publishers Inc., Williston: 275 pp.
Stradanus, J. (Jan van der Straet), 1578. Venationes Ferarum, Avium, Piscium. Pugnae Bestiariorum:and mutuae Bestiarum, depictae a Joanne Stradano, editae a Philippe Gallaeo, carmine illustratae a C. Kiliano Duffao. Antverpiae (Antwerp), Philippus Gallaeus: 104 plates.
Al-Bakri, A.K., Takrouri, M.S.M., Ghori, S.K., Seraj, M.A., 1999. Surgical advances and practice of anesthesia in early Islamic Era. Saudi Newsletter, 10(1): 1-3.
Takrouri, M.S., 2006. Surgical, medical and anesthesia in the Middle East: Notes on ancient and medieval practice with reference to Islamic-Arabic medicine. The Internet Journal of Health, 5(1).
Keil, G., 1989. Spongia somnifera. Medieval milestones on the way to general and local anesthesia. Anesthesist, 38(12): 643-648.
Oppianus Cilicius, 2nd century B.C. (1597). De venatione (lib. 1III - Cynegenetica); De piscatu (lib. V - Halieutica). Cum Interpretation Latina, Commentariis, et Indice rerum in utroque opere memorabilium locupletissimo. Confectis studio et opera. (ed. Conradi Rittershvsii Brunswicensis), 1597 ed. I.V.D. Ludvini Batavorum: Franciscum Raphalengium ex officina Plsantiniana: 168 pp.
Aristotle, 350 B.C. (2004a). De partibus animalium (On the parts of animals). Kessinger Publishing Co., Kila: 132 pp.
Aristotle, 350 B.C. (2004b). Historia animalium (The history of animals). Kessinger Publishing Co., Kila: 304 pp.
Flegel, C., 1905. La question des pêcheurs d'éponges de la Méditerranée. Imprimerie du Gouvernement, La Cannee: 63 Pp.
Russell-Bernard, H., 1972. Kalymnos, island of the sponge fishermen. In: Russell Bernard, H. and Pertti, J. Pelto (eds), Technology and Social Change, MacMillan Publisher Co., New York: 279-316.
Kalafatas, M.N., 2003. The Bellstone: The Greek Sponge Divers of the Aegean; One American's Journey Home. Brandeis Universty Press. Hanover, New Hampshire, U.S.A.: 287 Pp.
Le Prieur, Y., 1956. Premier de plongée. France Empire, Paris: 263 pp.
Hennique, P.A., 1888. Une page d'archéologie navale. Les Caboteurs et Pêcheurs de la Cote de Tunisie. Pêche des éponges. Gauthier Villars et Fils Libraire, Paris: 83 pp.
Bidder, G., 1896. Note on prospects for the improvement of sponge-fisheries. Journal of the Marine Biology Association, 4: 195-202.
Ben Mustapha K., Vacelet, J., 1991. Etat actuel des fonds spongiferes de Tunisie. In: Boudouresque C.F., Avon M. and Gravez V. (eds), Les espèces marines a protégé en Méditerranée, GIS Posidonie, Marseille: 43-46.
Sella, M., 1912. La pesca delle spugne in Libia. Memorie del Regio comitato Talassografico Italiano, 13: 1-154.
Notas
(1*) The evolution of animals (metazoans) from their unicellular ancestors required the emergence of novel mechanisms for cell adhesion and cell–cell communication. One of the most important cell adhesion mechanisms for metazoan development is integrin-mediated adhesion and signaling. The integrin adhesion complex mediates critical interactions between cells and the extracellular matrix, modulating several aspects of cell physiology. To date this machinery has been considered strictly metazoan specific. Here we report the results of a comparative genomic analysis of the integrin adhesion machinery, using genomic data from several unicellular relatives of Metazoa and Fungi. Unexpectedly, we found that core components of the integrin adhesion complex are encoded in the genome of the apusozoan protist Amastigomonas sp., and therefore their origins predate the divergence of Opisthokonta, the clade that includes metazoans and fungi. Furthermore, our analyses suggest that key components of this apparatus have been lost independently in fungi and choanoflagellates. Our data highlight the fact that many of the key genes that had formerly been cited as crucial for metazoan origins have a much earlier origin. This underscores the importance of gene cooption in the unicellular-to-multicellular transition that led to the emergence of the Metazoa.(Pedrós et alii, 2010).
(2*) Epithelial tissue — the sealed and polarized layer of cells that regulates transport of ions and solutes between the environment and the internal milieu — is a defining characteristic of the Eumetazoa. Sponges, the most ancient metazoan phylum [1], [2], are generally believed to lack true epithelia [3], [4], [5], but their ability to occlude passage of ions has never been tested. Here we show that freshwater sponges (Demospongiae, Haplosclerida) have functional epithelia with high transepithelial electrical resistance (TER), a transepithelial potential (TEP), and low permeability to small-molecule diffusion. Curiously, the Amphimedon queenslandica sponge genome lacks the classical occluding genes [5] considered necessary to regulate sealing and control of ion transport. The fact that freshwater sponge epithelia can seal suggests that either occluding molecules have been lost in some sponge lineages, or demosponges use novel molecular complexes for epithelial occlusion; if the latter, it raises the possibility that mechanisms for occlusion used by sponges may exist in other metazoa. Importantly, our results imply that functional epithelia evolved either several times, or once, in the ancestor of the Metazoa.
(Publicado em 2017 e atualizada em 05/VIII/2021)











































































1 comentários:
material mt bom! nota 10!
Postar um comentário