MATÉRIA, SUBSTÂNCIA E MISTURA
Matéria
Tudo que tem massa e ocupa um lugar no espaço. Toda a matéria é constituída por átomos.
Matéria é tudo aquilo que tem massa e volume, sendo a unidade fundamental de todos os objetos físicos. Tudo que você pode tocar ou sentir, como o ar, a água, uma rocha, as nuvens, um pássaro, animais e você próprio, todos são feitos de matéria. Por outro lado, tudo que não é matéria é chamado de energia.
Átomos
O átomo é a unidade básica de construção da matéria. É a menor porção de um elemento químico que mantém sua identidade.
Duas regiões constituem o átomo: núcleo e eletrosfera. O núcleo é denso e possui massa, concentrando prótons e nêutrons.
O átomo é a unidade fundamental da matéria e a menor fração capaz de identificar um elemento químico.
O átomo também possui massa, e a grande maioria da massa de um átomo vem dos prótons e nêutrons que estão no núcleo e que o constituem. Logo, o núcleo dos átomos é formado por prótons e nêutrons.
O número total destas partículas (denominadas núcleons = prótons e nêutrons) em um determinado átomo denomina-se número de massa. O número de massa é um número inteiro simples e representa unidades de núcleons. Por exemplo, “carbono-12” tem doze núcleons: seis prótons e seis nêutrons (6p e 6n).
Representação esquemática de um átomo de Carbono, com seus 6 prótons e seus 6 nêutrons.
Os nêutrons (n0) são partículas sem carga elétrica que compõe o núcleo dos átomos, um nêutron possui massa praticamente idêntica à de um próton, sendo levemente maior e foram descobertos em 1932, por James Chadwick.
Não podemos confundir com neutrinos, que tem símbolo indicados pela letra grega ν (nu) e são partículas subatômicas sem carga elétrica, gerados pelas reações que acontecem nas estrelas. Os neutrinos tem massa muito menor que a massa de um elétron.
Modelo de átomo
Evolução do modelos que tentam explicar os átomos e a matéria
Leucipo de Mileto e Demócrito de Abdera são considerados os pioneiros na ideia de que a matéria é formada por algum tipo de partículas muito pequenas e indivisíveis. A base da Teoria de Leucipo-Demócrito era de que existem duas coisas: os átomos e o vácuo. O mundo era, portanto, composto de montes de matéria em um mar de vazio total.
ἄτομον, atomon, i.e. "insecável" (que não se pode cortar), indivisível.
A base da Teoria de Leucipo-Demócrito era de que existem duas coisas: os átomos, em grego: ἄτομον, atomon, a = não; tomos = parte, divisão, e o vácuo, o vazio.
O mundo era, portanto, composto de montes de matéria em um mar de vazio total. Um átomo, por ser a menor porção de matéria não poderia ser cortado ou dividido de qualquer maneira, e era completamente sólido.
(Fonte: mundoeducação)
Alteração ao longo do tempo, da compreensão do seja átomo.
Modelo atômico (rinconeducativo)
Modelos atomicos (youtube)
Como vimos nos níveis hierárquicos, a matéria é formada por átomos, os átomos se agrupam em moléculas e as moléculas se agrupam formando substâncias e misturas.
SUBSTÂNCIAS
Substância são materiais que apresentam propriedades específicas: físicas e químicas constantes e bem definidas, tais como: solubilidade, densidade, ponto de fusão, ponto de ebulição, condutividade elétrica, dureza, viscosidade...
Propriedades químicas e físicas constante
(modif. brainly)
São formados por grupos de moléculas iguais. Cada molécula pode ser formada por um grupo de átomos de um mesmo elemento químico ou por elementos diferentes.
Dessa forma as substâncias podem ser simples (formada por apenas um tipo de átomo) ou compostas formadas por átomos diferentes.
Pode-se definir substância como material puro, cuja composição é constante. Sendo
assim, mistura é material impuro, ou seja: uma mistura é um
material composto por mais de uma substância.
A compreensão das relações entre o conceito de substância, processo de purificação, pureza química, propriedades
físicas e a composição constante pode ser melhor alcançada examinando o exemplo da destilação de uma mistura
líquida.
Considere uma solução líquida composta por duas
substâncias, as quais apresentam diferentes temperaturas de
ebulição e diferentes volatilidades. Ao aquecer o material,
ambas as substâncias sofrerão
vaporização seguida de condensação, e o destilado ainda será uma
mistura.
Como a quantidade de
energia necessária para vaporizar
a substância mais volátil é menor,
no início da destilação esta vaporizará em maior quantidade que a
outra substância, de modo que as frações iniciais da mistura
obtida como destilado terão uma composição mais rica na
substância mais volátil que a mistura original.
Sucessivas
destilações das frações iniciais dos destilados tornarão o
líquido obtido cada vez mais rico em relação à substância
mais volátil. Quanto maior o número de etapas de separação
pelas quais o líquido passar, maior será o seu grau de pureza.
Um mapa conceitual para o conceito químico de substância.
Substância, então, é toda forma particular de matéria ou todo material que possui suas propriedades definidas: densidade, ponto de fusão, ponto de ebulição, etc., constantes e sua composição fixa.
Substâncias simples
Toda substância simples é composta por átomos de um mesmo elemento químico.
ex: gás oxigênio (O2), gás ozônio O3, gás hidrogênio (H2), gás nitrogênio (N2), gás Cloro Cl2, Ouro (Au), Cobre (Cu), Estanho (Sn).
Substâncias simples (modif. todamateria)
Substância simples. canos de cobre.
Substância composta
Substância Composta ou Composto: é formado por mais de um elemento químico, i.e., por mais de um tipo de átomo.
exemplos:
Água: H2O, possui dois hidrogênios e um oxigênio,
Ácido clorídrico: HCl,
Ferrugem: Fe3O4, ou Fe(OH)3 e Fe2O3·3H2O
Água oxigenada: H2O2
Dióxido de carbono: CO2
Carbonato de cálcio: CaCO3
Exemplos de substância simples e substância composta
A união de substâncias originam as misturas. As misturas podem ser homogêneas ou heterogêneas.
PROPRIEDADES GERAIS DA MATÉRIA
Propriedades gerais e específicas da matéria
Propriedades específicas da matéria
A matéria é composta por átomos e moléculas, que se ordenam de diferentes formas, garantindo assim as propriedades específicas de cada matéria. Existem ainda as propriedades gerais, que são comuns a todo tipo de matéria.
Essas propriedades gerais da matéria são em número de dez (10) propriedades, isto é, 10 características observadas em qualquer corpo, independente da substância de que ele é constituído.
Inércia, Massa, Volume, Extensão, Impenetrabilidade, Compressibilidade, Elasticidade, Divisibilidade, Descontinuidade e Indestrutibilidade. (UENF)
Inércia
A inércia é uma propriedade geral da matéria, e é a tendência natural de um corpo em resistir a alterações em seu estado original de repouso ou movimento. Em outras palavras, um objeto parado sempre tende a permanecer parado, e um corpo em movimento tende a manter o movimento.
Dizendo de outra maneira, a matéria tende a permanecer em seu estado de repouso ou de movimento, a menos que uma força atue sobre ela. Vamos visualizar essa propriedade através do esporte: em um jogo de futebol, vôlei ou basquete, por exemplo, a bola só entra em movimento quando impulsionada pelo jogador, e demora algum tempo até parar de novo. Toda a matéria conserva seu estado, seja ele de repouso ou de movimento. Seu estado só muda se houver a ação de uma força sobre ela, por ex., num jogo de sinuca uma bola só se move se voce impulsioná-la com uma determinada força. E a inércia é válida para corpos aqui na Terra como para corpos celestes (asteroides, cometas, planetas e estrelas bem como galáxias inteiras)
inércia (tenor)
Primeira lei de Kepler (flippingphisics)
Vamos considerar um corpo não submetido à ação de forças ou submetido a um conjunto de forças cuja resultante seja nula; nessa condição este corpo não sofre variação de velocidade. Isto significa que, se está parado, permanece parado, e se está em movimento, permanece em movimento em linha reta e a sua velocidade se mantém constante. Tal princípio, formulado pela primeira vez por Galileu e, posteriormente, confirmado por Newton, é conhecido como primeiro princípio da Dinâmica (1ª lei de Newton) ou princípio da Inércia.
Segunda lei do movimento planetário de Kepler
Massa
A massa é uma grandeza física fundamental. Segundo a mecânica newtoniana, a massa nos dá a medida da inércia ou da resistência de um corpo em ter seu movimento acelerado, ou se está acelerado a resistência em ser parado.
Ela também é a origem da força gravitacional, atuante sobre os corpos no Universo.
Massa não é quantidade de matéria, massa é medida em quilogramas e a quantidade de matéria é media em mols que um corpo tem. A massa é a medida da inércia em termos físicos.
Um corpo com 2kg e outro com 5kg, o corpo de 5kg tem mais inércia do que o de 2kg.
O que significa isso? Significa que para tirar um corpo de 5kg do repouso precisaremos de mais força do que para um corpo de 2kg. A mesma coisa é válida para parar: um corpo que está em movimento em MRU, e se quisermos pará-lo, precisaremos de mais força para um corpo de 5kg do que para um corpo de 2kg.
O peso e massa se confundem pois como estamos na Terra, e nunca saímos daqui, então praticamente ao pesarmos um corpo, podemos deduzir o valor da massa desse corpo através da relação do Newton uma vez que força é igual a massas vezes a aceleração (da gravidade) F=m.a.
A relação entre massa e peso é uma variante da segunda lei de Newton
F = m . a
Matematicamente, essa relação é expressa através da seguinte fórmula:
P = m . g
onde P é o peso, m é a massa e g é a aceleração da gravidade.
Um corpo que pese 100 N, a massa dele é 10 kg.
Outra diferença fundamental entre massa e peso é o fato de a massa ser uma constante, enquanto o peso varia de acordo com a aceleração da gravidade.
Na Lua, onde a aceleração da gravidade é em torno de 1,6 m/s², um objeto que tem na Terra 100 kg de massa continuaria com esses 100 kg de massa, mas seu peso seria bem diferente.
Na Terra, esse objeto teria 980 N de peso (lembrando que a gravidade na Terra é em torno de 9,8 m/s²), enquanto na Lua teria apenas 160 N. Seria muito mais fácil levantar esse objeto na Lua do que na Terra. No entanto, movimentá-lo horizontalmente seria tão difícil aqui como lá, pois a massa permanece a mesma.
Para pesarmos um corpo usamos uma balança de pratos. Mede-se a massa, pesa o peso e avalia a quantidade de matéria.
Mede-se a massa em kg ou g, pesa-se a massa em Newton, e a quantidade de matéria medimos em mols.
O entendimento do que seja massa é bem difícil de separar e abstrair, devido a nossa situação gravitacional na superfície da Terra. As balanças estão "erradas" pois marcam uma normal, quando subimos numa balança ela esta me dando uma normal (n), pois se colocarmos a balança inclinada ela não vai marcar o que marcava estando na posição horizontal.
A balança de mola não mede a massa, para medirmos massa precisamos de uma balança de pratos. Nesse caso independente do campo gravitacional que tiver o g (força da gravidade se anula nos dois pratos), logo o peso do prato da esquerda é igual ao peso do prato da direita, como o peso é calculado
m1.g/m2g os g se simplificam teremos a comparação da massa 1 e da massa 2 independente do campo gravitacional. Uma balança de pratos pode ser usada na Terra, na Lua, em Júpiter ou na superfície do Sol, pois o campo gravitacional esta "puxando" os dois pratos igualmente. Se o corpo tiver uma massa de 5kg, aqui na Terra numa balança de pratos, ele terá esse mesmo valor na Lua ou em Júpiter ou na superfície do Sol, pois os diferentes campos atuam igualmente sobre os dois pratos (Gomes, comunicação pessoal).
Um quilo de laranjas, de açúcar ou de sequilhos, pesa, por definição, o mesmo que o cilindro de platino-irídio guardado sob várias redomas protetoras e trancado a três chaves no porão do Pavilhão de Breteuil, na periferia de Paris. Esse Protótipo Internacional do Quilograma (IPK, na sigla em inglês), usado para calibrar os padrões oficiais da unidade de massa, teve sua aposentadoria anunciada oficialmente nesta sexta-feira, após 129 anos de serviços prestados. Na última sessão da 26ª. Conferência Geral de Pesos e Medidas realizada nesta sexta em Versalhes, os 60 Estados membros votaram unanimemente por redefinir o quilograma: a partir do ano que vem (2019), a unidade de massa não será um objeto físico, e sim um valor derivado de uma constante da natureza. Essa mudança não terá nenhuma implicação no carrinho de compras e não será notada no dia a dia, mas talvez seja muito importante em âmbitos científicos, como o desenvolvimento de medicamentos. as mudanças aprovadas entrarem em efeito, em 20 de maio de 2019, aniversário do Tratado do Metro de 1875. "Em 20 de maio de 2019 se viverá a maior revolução na medição desde a Revolução Francesa", disse o prêmio Nobel Bill Phillips sobre o palco da convenção. Em vez da velocidade da luz, a cifra imutável escolhida para definir a unidade de massa é a constante de Planck, um valor que descreve os pacotes de energia emitidos em forma de radiação. A aprovação dessa definição do quilo demorou tantos anos porque até recentemente não havia meios tecnológicos para levá-la à prática. Agora, graças a um aparelho chamado balança de Watt (às vezes balança de Kibble, ou balança de potência), podem-se calibrar padrões do quilograma, já que o valor da constante de Planck é conhecido. (elpais, 2018).
Atualmente usamos a unidade padrão de massa no Sistema Internacional de unidades (SI) é o quilograma (kg). O quilograma é definido com base na constante de Planck, cujo valor é 6,62 × 10−34 m2kg/s.
A massa é uma grandeza que pode ser medida e normalmente usamos o quilograma (Kg) como unidade de massa, pois é a unidade padrão segundo o Sistema Internacional (SI), sistema que “rotula” qual unidade deve ser usada em cada grandeza para que haja um padrão universal. Outra unidade derivada do quilograma é o grama (g) muito utilizado para medir pequenas quantidades.
A massa, como vimos, tem grande relação com a propriedade que discutimos anteriormente: a inércia. Quanto maior a massa de um corpo, maior a sua inércia, ou seja, maior será sua capacidade de se manter em movimento ou em repouso.
Volume
O volume é uma grandeza que indica o espaço ocupado por uma quantidade de matéria. No sistema internacional (SI), a unidade de volume é o metro cúbico (m3). Também é comum a utilização do litro (L) ou do mililitro (mL) na medida de volume.
Volume
Extensão
É a capacidade de ocupar lugar no espaço, toda matéria ocupa um lugar no espaço que pode ser conhecido. Todo corpo que possui massa ocupa lugar no espaço. Todo corpo tem extensão. Seu corpo, por exemplo, tem a extensão do espaço que você ocupa. Portanto, extensão é a capacidade da matéria de ocupar um espaço.
Impenetrabilidade
Duas porções de matéria não podem ocupar o mesmo lugar ao mesmo tempo. Podemos ver isso quando colocamos nossa mão em um copo cheio de água. O volume de água que transborda do copo é o mesmo volume que nossa mão ocupa dentro do copo.
Compressibilidade
É a capacidade que toda matéria tem de diminuir seu volume quando uma força é exercida sobre ela.
Elasticidade
Por mais que a gente estique um elástico até o seu limite (antes que ele se rompa) ao pararmos de fazer força ele volta a forma de quando o pegamos inicialmente, isso é uma propriedade da matéria chamada elasticidade. Em outras palavras, é a capacidade da matéria voltar ao seu volume e forma inicial depois que a força exercida sobre ela acaba.
Divisibilidade
É a propriedade que toda matéria possui de poder ser dividida em partes cada vez menores sem alterar sua constituição ou propriedades. Qualquer matéria pode ser dividida em pedaços menores. Quando quebramos algum objeto estamos partindo-o em pedaços menores que o inicial.
Divisibilidade em pedaços cada vez menores (professor)
Descontinuidade
Essa propriedade explica que toda matéria possui espaços vazios que a tornam irregular em sua forma. Esses espaços vazios estão formados entre as moléculas.
Por exemplo, a madeira, mesmo parecendo uma matéria compacta e sem espaços, possui descontinuidade em sua estrutura, vistas através de um microscópio.
Indestrutibilidade
Nenhuma matéria é destruída nem criada. Ela se transforma em alguma outra matéria. (UENF)
Da queima da madeira sai o CO2, H2O, calor, sobram as cinzas e o carvão.
(g1)
MISTURA
Vimos o que é substância e agora vamos estudar como essas substâncias podem ser encontradas na natureza, i.e., no universo.
As ciências Químicas Físicas estudam todos os tipos de matéria existente no Cosmo desde sua formação, e as transformações pelas quais essa matéria passou e ainda passa desde o início, i.e., desde o Big Bang.
Como já vimos a matéria, é tudo aquilo que é formado por átomos e moléculas, ocupa lugar no espaço e que, portanto, possui massa e volume.
A matéria no universo pode ser encontrada em duas formas básicas:
substâncias e misturas.
Uma substância caracteriza-se por ser formada somente por um tipo de componente (que podem ser partículas como átomos e moléculas; além de todas as formas que esses componentes se apresentam) e, como resultado, apresenta propriedades físicas, como ponto de fusão, ponto de ebulição e densidade, fixas e bem definidas.
Já as misturas são sistemas formados por duas ou mais substâncias simples (somente um tipo de átomo) ou compostas (mais de um tipo de átomo) que sejam diferentes.
Dessa forma, as misturas, apresentam as propriedades físicas não definidas e variáveis. Essas propriedades dependem da quantidade de cada substância presentes na mistura.
Uma mistura é formada por duas ou mais substâncias puras. As misturas têm composição química variável, não podendo ser expressa por uma fórmula química.
Diferenças entre substância e mistura (brasilescola)
MISTURAS
Mistura é a associação de dois ou mais componentes diferentes. Uma grande parte dos elementos encontrados na natureza não são puros, se constituem como misturas com mais de um tipo de elemento. As misturas podem ser classificadas de acordo com os aspectos visuais que apresentam, e podem ter fases distintas ou não.
Na natureza, como já vimos em nossas aulas, encontramos poucas substâncias puras; o que mais facilmente encontramos são as misturas. As misturas são a união de duas ou mais substâncias. Cada uma dessas substância são chamadas de componente da mistura.
Assim, todo material que é constituído por duas ou mais substâncias são chamadas de misturas. As misturas apresentam composição e propriedades variáveis.
Granito, uma mistura
Elas são formadas por dois materiais, o dispersante (solvente) e o disperso (soluto).
O solvente ou dispersante é a substância presente em maior quantidade na mistura; já o soluto ou disperso é o componente presente em menor quantidade.
TIPOS DE MISTURAS
CLASSIFICAÇÃO DAS MISTURAS
Fase
Em uma mistura, chamamos de fase cada uma das porções que apresenta aspecto homogêneo ou uniforme.
Mistura homogênea
Mistura homogênea é toda mistura que apresenta uma única fase.
Mistura heterogênea
Mistura heterogênea é toda mistura que apresenta pelo menos duas fases.
As misturas homogêneas são aquelas que apresentam um aspecto uniforme, com uma única fase; já as misturas heterogêneas são aquelas que apresentam mais de uma fase.
Na maioria das vezes, os componentes das misturas heterogêneas aparecem em estados físicos diferentes e podem ser separados por métodos físicos.
MISTURAS HOMOGÊNEAS
Uma mistura homogênea (também chamada de solução) apresenta as mesmas propriedades em qualquer parte de sua extensão, e é impossível distinguir a superfície de separação entre os componentes.
Apresenta (1) uma fase (região com aparência uniforme e propriedades constantes em toda a sua extensão).
Exemplos de misturas homogêneas
Água e açúcar: H2O + C6H12O6
Água e sal: H20 + NaCl
Água do mar: 35g de sais para cada litro de água.
Aço: mistura de 98,3 a 98,5% de Fe (ferro) e 1,7% a 0,5% de C (carbono): 98,5% Fe + 1,5% C.
Latão: mistura de 55% a 95% cobre e 5% a 45% de zinco: (55% Cu + 45% Zn);
Bronze: mistura de 67% de cobre e 33% de estanho: (67% Cu + 33% Zn);
Alpaca: 65% de cobre, 18% de níquel e 17% de zinco (65%Cu+18%Ni+17%Zn)
Ouro 18K: 75% de ouro, e o restante outros mentais (Au + Ag, Cu, Pt, etc...)
Composição e cor da liga de ouro:
Ouro amarelo = Ouro puro (75%) + Prata (12,5%) + Cobre (12,5%)
Ouro vermelho = Ouro puro (75%) + Cobre (25%)
Ouro rosé = Ouro puro (75%) + Cobre (22,5%) + Prata (2,75%)
Ouro branco = Ouro puro (75%) + Paládio (25%)
Ouro verde = Ouro puro (75%) + Prata (15%) + Cobre (6%) + Cádmio (4%)
As ligas de ouro tradicionais já estavam bem estudadas até o início da década de 30. Elas foram classificadas em 4 tipos em função da dureza, que por sua vez é função da composição (Tabela acima). Verifica-se pela composição que elas se enquadrariam entre as ligas altamente nobres. (USP)
Ligas de ouro (fonte: atelielabriola)
Ligas de ouro (fonte: comprajoias)
Ouro branco
O ouro branco é conseguido pelos ourives empregando metais como o manganês, a prata e o paládio.
Em A temos ouro branco com banho de Ródio, um metal muito claro e brilhoso em B joia sem o banho de ródio.
Quando se pensa em ouro, imediatamente todo mundo imagina pilhas de barras douradas, em cofres, como nos filmes. Todavia, o ouro branco é uma junção do ouro puro 24K, somado com 39% de liga. Essa “Liga” é usada para deixar a composição mais maleável e assim facilitar a moldagem das joias sem que a peça amasse e ajude a mudar a cor do ouro (amarelo) para o branco. Esses 39% de liga é composto por 22% de Paládio, mais 12% de Prata, mais 5% de Cobre. Além disso, em joalheria é comum utilizar o ródio líquido, e é através de um processo chamado eletrólise, o ródio é depositado em volta do ouro branco, formando uma camada fina. Esse processo é feito para promover um acabamento na joia tirando o excesso do amarelo natural do ouro. O banho de ródio é o processo que acentua o tom prateado na joia de ouro branco. Isso porque, o ródio é um metal nobre que faz parte da família da platina. Ele dá um brilho maior e também mais resistência à joia feita em ouro branco. Entretanto, o banho de ródio não é eterno, e, com o passar do tempo e manipulação (uso), essa camada vai saindo da joia e ela vai voltando para o tom amarelado. Assim, um anel vai perdendo esse acabamento entre seis meses e dois anos. Joias como brincos, por exemplo, podem ficar com esse revestimento do ródio por até 10 anos, por ser uma joia que não é usada com tanta frequência como é o caso do anel (casa).
Vinagre: mistura de ácido acético e água: CH3COOH + H20;
Soro fisiológico: mistura de 0,9 g de cloreto de sódio e 100 mL de água: NaCl + H2O;
Álcool etílico 96º GL: mistura formada por 96% de álcool etílico e 4% de água destilada: C2H6O + H2O;
Ar atmosférico: mistura de gases, como nitrogênio e oxigênio, gás carbônico, argônio e outros gases (desconsiderando as partículas sólidas): 78% N2, 21% O2, 0,035% CO2, Ar 0,93% e outros gases.
Sal de cozinha: O sal que utilizamos para preparar alimentos é mistura homogênea sólida. No sal de cozinha há principalmente cloreto de sódio (NaCl), mas também pode haver cloreto de potássio (KCl) e adição de iodeto de potássio (KI).
Mistura água + sal (todamateria)
Substância pura
Quando um material possui propriedades fixas e invariáveis em toda a sua extensão, dizemos que se trata de uma substância pura. Ao colocarmos sal de cozinha, o cloreto de sódio (NaCl), dentro de um copo com água e mexermos ocorrerá uma mudança (o sal se dissolve na água). O resultado é um produto com densidade intermediária entre a densidade da água e densidade do sal. Isso ocorre porque a água deixou de ser uma substância pura e se tornou uma mistura. Ao tentar congelar essa mistura, você perceberá que a temperatura de fusão será menor que 0 ºC e que também essa mistura não entrará em ebulição à 100 ºC, mais calor será necessário para evaporar esse produto.
Água e açúcar
No caso da água e açúcar, essa mistura é homogênea, pois o açúcar se dissolve na água, sendo possível visualizar uma única fase, embora tenha dois componentes água + açúcar. Quando não se pode diferenciar nenhum dos componentes específicos dizemos que essa mistura homogênea é uma solução.
Água e sal de cozinha: H2O + NaCl
(Fonte: todamatéria)
(Font: educação)
Os sais, não possuem sempre o mesmo cátion ou ânion, como os ácidos e, por esse motivo, não revelam propriedades funcionais bem definidas.
Podemos dizer que no geral, os sais se dissolvem na água e formam soluções que:
1) São compostos iônicos (formados por aglomerados de íons e não por moléculas);
2) Muitos apresentam sabor salgado característico (quase sempre venenosos);
3) São sólidos e cristalinos;
4) Conduzem corrente elétrica em solução;
5) Sofrem fusão e ebulição em altas temperaturas;
6) Solúveis em água (exceções: alguns sulfetos; os cloretos, brometos e iodetos com os cátions Ag+, Hg2+ e Pb2+, entre outros).
Mistura homogênea sólida (bronze: CU+Zn ou latão: Cu+Zn).
MISTURAS HETEROGÊNEAS
Na maioria das vezes, é possível observar as distinções de fases (duas ou mais) de uma mistura heterogênea sem a necessidade de utilizar instrumentos como microscópios. As fases deste tipo de mistura podem ser percebidas pelos estados físicos, densidade ou cores diferentes.
Alguns exemplos de misturas heterogêneas são a água e óleo, água e areia, a rocha granito, água e limalha de ferro.
No geral, as misturas heterogêneas são classificadas em suspensões ou coloides, levando-se em consideração o tamanho das partículas que formam a substância que está presente em menor quantidade na mistura.
A bauxita e o granito são rochas formadas por minerais que podemos visualizar a olho nu. A bauxita são minerais hidratados de alumínio, enquanto o granito é formado por quartzo, mica e feldspato.
No caso da bauxita seus minerais são formados nos processos de intemperismo e alteração de rochas aluminosas, em clima tropical e subtropical (Villar 2002). Como uma mistura é rica em ferro e alumínio e pobre em silício e metais alcalinos, quando comparada à composição da rocha mãe. Pode ser maciça, coesa, terrosa ou argilosa, com coloração variando entre vermelho, amarelo, marrom e branco. Segundo Sampaio et al. (2008) a proporção de óxidos de ferro determina a cor da rocha. A bauxita branca contém de 2 a 4% de minerais de ferro, ao passo que, quando avermelhada pode conter até 25%. Além das impurezas de ferro, é comum a ocorrência de óxidos e hidróxidos de titânio e manganês, além de argilominerais e fragmentos de rocha (Villar 2002). O granito resulta da solidificação do magma a grandes profundidades (sua classificação é rocha magmática plutônica). As rochas que o envolvem, impedindo a libertação do calor, não permitem um rápido resfriamento do magma, retardando a sua solidificação. Desta forma, os minerais que o constituem têm tempo necessário para se desenvolver, apresentando-se assim, esta rocha, com uma textura granular em que os minerais constituintes são bem visíveis e identificáveis: o quartzo, os feldspatos (ortoclase, sanidina e microclina) e as micas (biotite e moscovite).
Mistura é um sistema formado por duas ou mais substâncias puras, chamadas componentes. As misturas podem ser classificadas em homogêneas e heterogêneas. A diferença entre elas é que a mistura homogênea é uma solução que apresenta uma única fase enquanto a heterogênea pode apresentar duas ou mais fases.
Veja os exemplo a seguir de Misturas homogêneas e Misturas Heterogêneas:
Exemplo de misturas heterogêneas
Água e gelo: água em dois estados, i.e., a mistura tem duas fases e apenas um componente
Água e óleo
Pepitas de ouro e areia
Areia e sal de cozinha
Açúcar e farinha
Enxofre e limalha de ferro
Granito: mistura de feldspato, mica e quartzo
Basalto: augita, plagioclásios (labradorita) e magnetita.
Basalto amigdaloidal (amigdaloide)
Basalto porfirítico
Basalto é uma rocha ígnea vulcânica ou extrusiva, escura e muito finamente cristalina. É o principal constituinte da crosta oceânica. O magma que dá origem ao basalto é produto direto da fusão parcial do manto superior terrestre. O magma basáltico é relativamente mais quente (1000 – 1200 °C) que o magma granítico (700-900 °C), e também mais pobre em sílica (45 – 52% de SiO2), o que lhe confere uma característica mais fluida, menos viscosa, facilitando assim que chegue até à superfície. Quando o magma extravasa até a superfície, e entra em contato com as condições de pressão e temperatura atmosféricas, resfria rapidamente. O rápido resfriamento da lava dificulta que os minerais cristalizados aumentem de tamanho, desenvolvendo assim uma textura denominada de afanítica, com grãos muito finos, não distinguíveis a olho nu. O basalto também pode apresentar uma textura porfirítica, ou seja, com grandes cristais precocemente cristalizados (fenocristais), imersos em uma massa mais fina de cristais não visíveis à olho nu. O rápido resfriamento do magma basáltico também pode impedir a cristalização de minerais, resultando em um vidro vulcânico. Já o gabro é o equivalente plutônico do basalto, ou seja, uma rocha de mesma composição mineralógica, mas com textura fanerítica, isto é, com grãos visíveis a olho nu (> 1mm).
Plagioclásio e piroxênio são os minerais essenciais do basalto, que também pode conter olivina. Por isso, o basalto é considerado uma rocha máfica, ou seja, uma rocha escura. Quando o basalto é rico em olivina esse é denominado de picrito. Os minerais acessórios mais comuns no basalto são espinélio, magnetita, ilmenita e apatita. (USP)
Água gaseificada: (conseguimos distinguir as bolhas de gás carbônico na água).
Observando a figura a seguir, percebemos que temos uma mistura heterogênea é uma
mistura homogênea. A água e o óleo formam duas fases (mistura heterogênea). O sal e a
água formam apenas uma fase (mistura homogênea).
Misturas
O processo de separação de misturas é essencial em diversa atividades humanas, como no tratamento da água ou no tratamento de esgoto.
1) IDENTIFICAÇÃO DE SUBSTÂNCIAS PURAS
O que o leite, a água mineral potável e o granito têm em comum?
Leite, água mineral e um fragmento de granito rosa.
Fragmento de uma rocha de granito (unipanpa).
Fragmento de uma rocha de granito, que é uma mistura de três diferentes minerais: quartzo, mica e feldspato. Cada um dos constituintes apresenta propriedades distintas e a mistura apresenta propriedades intermediárias (modif. unipanpa).
O leite, a água mineral e o granito: todos são misturas de substâncias. O leite é uma mistura de água, lactose (um tipo de açúcar), sais minerais, proteínas, gorduras, vitaminas e muitas outras substâncias.
A Água. Quando bebemos água, estamos ingerindo vários sais minerais, além de gases dissolvidos na água.
O granito, como vimos quando estudamos a crosta terrestre, é uma rocha formada por uma mistura de minerais: quartzo (cor incolor), feldspato (leitoso ou cinza) e mica (preta). Minerais: são a substâncias inorgânicas naturais de composição química definida e de estrutura sólida cristalina determinada ou amorfa, com arranjo atômico ordenado, que às vezes se apresentam em formas geométricas mais ou menos regulares (blog).
Quando pensamos em algo puro, ou no termo “pureza”, associamos a algo que não está misturado. Em Ciência, substâncias puras são aquelas formadas por um único componente, como é o caso do gás oxigênio. Para transformar a água potável, por exemplo, em água pura, é preciso ferve-la em um aparelho especial, recolhendo e condensando seu vapor, como você verá mais adiante. Ao retirarmos da água os sais minerais e os gases nela dissolvidos, teremos uma substância pura.
Vamos chamar as substâncias puras simplesmente de substâncias. Essas substancias podem ser reconhecidas e separadas por meio de suas propriedades específicas como: Densidade, Ponto de fusão, Ponto de ebulição etc.
PONTO DE FUSÃO E EBULIÇÃO
Como já vimos, durante o ciclo da água ela passa por mudanças de estado físico. Assim como a água, outros materiais passam por mudanças de estado físico.
Ciclo da água
A medida que se fornece energia em forma de calor a um pedaço de gelo, sua temperatura vai subindo até chegar a zero grau Celsius (0°C). Essa temperatura é válida para água pura sob pressão de 1atm. Como vimos a camada de ar que envolve a terra exerce uma pressão, a pressão atmosférica, no nível do mar a pressão equivale a 1atm.
No momento em que a agua atinge 0ºC, o calor passa a provocar mudança do estado sólido para o líquido (fusão).
Enquanto houver água nos dois estados, a temperatura, líquido e sólido, a temperatura desse sistema vai se manter em 0 ºC. Somente quando o gelo estiver derretido é que a temperatura vai começar a subir.
O mesmo vale para o processo inverso: durante a passagem da água do estado liquido para o sólido (solidificação) o sistema se mantém em 0ºC. Portanto, durante a fusão ou a solidificação, a temperatura do sistema formado por água líquida e gelo permanece constante. A temperatura de todas as substâncias puras permanece constante durante a fusão ou a solidificação, i.e., durante a mudança de estado.
Mudanças de fase para a água (cursoenemgratuito)
Mudança de fases da água
Mudanças de fase para a água (Paim)
A temperatura de toda as substâncias puras permanece constante durante a fusão ou a solidificação. A temperatura de fusão do ouro, no nível do mar, p.ex. é 1064ºC. Dizemos então que o ponto de fusão, ou a temperatura de fusão ou de solidificação do ouro é 1064ºC
Cada substância tem um ponto de fusão específico. O ponto de fusão a água é 0°C; o do ferro é 1535°C; o do ouro é 1063°C. Portanto o ponto de fusão é uma propriedade que ajuda a identificar as substâncias.
Além de ter um ponto de fusão específico, cada substância tem um ponto de ebulição específico ou uma temperatura de ebulição. Essa propriedade nos ajuda, a identificar a substância: sob pressão de 1atm, o ponto de ebulição da água é 100°C; o do mercúrio é 357°C; e o do ferro 3000°C.
Da mesma forma, cada substância entra em ebulição a uma temperatura em determinada pressão (pressão atmosférica ao nível do mar).
Agora voce já deve ter compreendido que uma maneira de diferenciar substâncias bem parecidas é pela análise de suas propriedades, chamadas propriedades específicas da matéria.
Os pontos de fusão e de ebulição mudam quando se misturam substâncias. O ponto de ebulição da água por exemplo, aumenta quando se acrescenta a ela um pouco de sal. Por isso essas propriedades específicas também são usadas para saber se a substância é pura.
Diagrama de mudança de fase da água pura.
Neste gráfico notamos dois trechos horizontais (dois patamares). O primeiro patamar do gráfico exprime o fato de que a fusão do gelo ocorre à temperatura constante de 0 °C, que é a temperatura de fusão ou ponto de fusão (P.F.) do gelo. Do mesmo modo, o segundo patamar indica que a ebulição da água ocorre à temperatura constante de 100 °C, que é a temperatura de ebulição ou ponto de ebulição (P.E.) da água. No resfriamento da água, o gráfico será “invertido”:
Aquecimento de resfriamento da água
Diagrama de mudança de fases
Diagrama de mudança de fases
Se tivermos uma mistura (ou substância impura), os patamares mostrados acima não serão mais encontrados. Assim, por exemplo, uma mistura de água e sal terá um intervalo (ou faixa) de fusão abaixo de 0 °C e um intervalo (ou faixa) de ebulição acima de 100 °C, ao nível do mar, como se vê abaixo.(Feltre, 2004)
Para finalizar, devemos fazer uma generalização importante: tudo o que acabamos de explicar para a água pura ocorre também com outros materiais puros. De fato, ao nível do mar, cada líquido (álcool, acetona etc.) e também cada sólido (como os metais chumbo, ferro etc.), desde que puros, irão se fundir e ferver em temperaturas bem definidas. Ao nível do mar, por exemplo, temos:
DENSIDADE
Densidade, é uma grandeza que articula a massa de uma unidade de volume de uma substância material. A fórmula para densidade é d = M/V, onde d é densidade, M massa e V é volume. A densidade é comumente expressa em unidades de gramas por centímetro cúbico.
Por exemplo, a densidade da água é de 1 grama por centímetro cúbico (1g/cm3) e a densidade do planeta Terra é de 5,51 gramas por centímetro cúbico. A densidade também pode ser expressa em quilogramas por metro cúbico (em metros-quilograma-segundo ou unidades SI = Sistema Internacional).
Por exemplo, a densidade do ar é de 1,2 quilogramas por metro cúbico. As densidades de sólidos, líquidos e gases comuns estão listadas em livros didáticos e manuais.
A densidade oferece um meio conveniente de obter a massa de um corpo a partir do seu volume ou vice-versa; a massa é igual ao volume multiplicado pela densidade (M = Vd), enquanto o volume é igual à massa dividida pela densidade (V = M/d).
O peso de um corpo, que geralmente tem mais interesse prático do que sua massa, pode ser obtido multiplicando-se a massa pela aceleração da gravidade.
Também em livros estão disponíveis tabelas que listam o peso por unidade de volume das substâncias; essa quantidade tem vários títulos, como densidade de peso, peso específico ou peso unitário. (britannica)
Para satisfazer as exigências da vida diária (e também da ciência), novas medições foram criadas,
ao longo do tempo. No cotidiano é comum dizermos, por exemplo, que o chumbo “pesa” mais do que
a madeira. No entanto, 1 kg de chumbo afunda, enquanto 1 kg de madeira flutua na água. (Feltre, 2004).
É fácil
perceber, porém, que tal comparação só se torna justa e racional quando feita entre volumes iguais:
Surge dessa comparação o conceito de densidade dos materiais, entendida como a massa dos “pedaços” iguais (volumes iguais) dos vários materiais (no exemplo acima, pequenos cubos de volume igual a 1 cm3 ). Matematicamente, essa idéia corresponde à seguinte definição:
Um caso particular importante é o da medição das densidades dos líquidos, que é feita diretamente pelos densímetros. Esse instrumento é um tubo de vidro, como mostrado a seguir, cuja parte inferior é mais larga e “pesada” do que a superior, que consiste em uma haste graduada em densidades. Colocado num líquido o densímetro afunda mais ou menos, e a graduação da haste, que coincide com o nível líquido, dá diretamente a densidade do líquido. Os densímetros são usados, por exemplo, em postos de gasolina, para medir a densidade do álcool vendido; em cooperativas de leite, para comprovar a qualidade do leite negociado, e assim por diante.(Feltre, 2004).
A densidade dos líquidos é medida com um instrumento chamado densímetro que é um equipamento para laboratório utilizado para medir a densidade desses corpos, que é o que determina a quantidade de matéria que está presente em uma unidade de volume. O instrumento mede a densidade dos líquidos, ou seja, a massa dividida pelo volume.
O densímetro indicado na figura A, flutua na água de modo que sua escala marca 1,0 g/mL (densidade da água pura) na superfície do líquido. O densímetro da figura B flutua numa solução de bateria de automóvel carregada de modo que sua escala marca 1,3 g/mL (densidade da solução de bateria carregada). O líquido da bateria é uma solução de ácido sulfúrico em água, apresentando densidade maior que a água
A densidade é outra propriedade especifica dos materiais. Para conhecê-la vamos falar sobre duas propriedades gerais da matéria., i.e., propriedades que todos os corpos possuem: a massa e o volume. (Corpo é uma porção limitada de matéria como um cubo de gelo ou pedaço de madeira. O termo objeto é empregado para designar o corpo com determinado uso, como uma cadeira de madeira ou um martelo de ferro.
Toda matéria tem massa, que pode ser medida em uma balança (de pratos), e toda matéria ocupa lugar no espaço, ou seja, tem volume.
Por exemplo, em relação a massa, pode-se ter um quilograma de arroz e um quilograma de água; em relação ao volume, pode-se ter um litro de água e um litro de leite.
Se colocarmos em uma balança de prato, um cubo de chumbo e, no outro um cubo de alumínio; ambos os cubos com o mesmo volume. A balança e prato funciona como uma gangorra.
O prato que contém a maior massa fica em um nível mais baixo do que o outro prato. Isso acontece porque a massa do chumbo é maior do que a do alumínio.
Esses matérias diferem, portanto, na relação entre massa e volume, a qual chamamos de densidade. No exemplo, o chumbo é mais denso que o alumínio, pois tem mais massa em um mesmo volume.
Para encontrar a densidade de um material, dividimos sua massa pelo seu volume, da seguinte forma:
d=m/v
d= densidade
m= massa
v= volume
Por ser uma relação entre massa e volume, a densidade possui unidades que correlacionam essas duas grandezas, como:
g/mL ou g.mL-1
kg/L ou kg.L-1
Também é comum utilizar unidades cúbicas para designar a parte volumétrica, assim sendo, é possível usar também:
g/cm3 ou g.cm-3
kg/m3 ou kg.m-3
Vale lembrar que 1 cm3 (um centímetro cúbico) é equivalente a 1 mL, enquanto 1 dm3 corresponde a 1 litro e 1 m3 corresponde a 1000 L.
A densidade tem relação com a flutuação dos corpos. O gelo e o óleo de soja, por exemplo, flutuam na água líquida por que são menos densos que ela.
A densidade pode ser expressa em diferentes unidades de medida, por exemplo: g/mL (grama por mililitro), kg/m3 (quilograma por metro cúbico) ou g/cm3 (grama por centímetro cúbico).
Veja mais este exemplo:
Se pusermos um recipiente de vidro cheio de água em um dos pratos de uma balança e, no outro prato, colocarmos um recipiente igual, mas cheio de óleo de soja, a balança vai inclinar-se para o lado da água.
Isso porque a massa de 1 L de óleo de soja é 0,8 kg, e a massa de 1 L de água é 1 kg.
Então, a densidade do óleo de soja é 0,8 kg/L e a densidade da água é 1 kg/L: a água é mais densa do que o óleo de soja.
Voce consegue perceber a diferença?
Há mais massa em um litro de água do que em um litro de óleo de soja. A densidade tem relação com a flutuação dos corpos. O gelo e o óleo de soja, por exemplo, flutuam na água líquida porque são menos densos que ela.
Se a densidade de determinada substância for maior, ela irá afundar na que tem menor densidade e vice-versa. A densidade da água é 1,0 g/mL, do gelo é 0,9 g/mL e do álcool é 0,7 g/mL. Dessa forma, entre o gelo e a água, o gelo tem menor densidade, por isso ele flutua. No entanto, entre o gelo e o álcool, o gelo é mais denso, por isso ele afunda.
Note que o gelo não fica totalmente em cima da água. Visto que sua densidade é 0,9 g/mL e da água é 1,0 g/mL, isso quer dizer que 90% do gelo fica debaixo da água e apenas 10% dele fica acima da superfície do líquido. Isso pode ser visto nos icebergs, que parecem ser grandes acima da superfície; no entanto, a maior parte deles está encoberta pela água.
As substâncias costumam ser mais densas quanto estão no estado sólido do que quando no estado líquido. Isso porque suas suas moléculas ficam mais agrupadas; então por que a água contraria essa regra?
Isso se dá em razão do tipo de força intermolecular que existe entre as moléculas de água, que é a ligação de hidrogênio. A ligação de hidrogênio na água ocorre porque ela é polar, ou seja, apresenta dipolos elétricos entre seus átomos. O oxigênio é mais eletronegativo, por isso ele adquire uma carga parcial negativa (δ-), enquanto os hidrogênios possuem uma carga parcial positiva (δ+).
Por isso as suas moléculas se atraem: os hidrogênios são atraídos pelos átomos de oxigênio das moléculas vizinhas, conforme é possível visualizar na figura abaixo:
Ligações entre as moléculas de agua no estado sólido, durante a fusão e no estado líquido (casaamericana).
Estrutura da água no estado sólido (slideplayer)
Estrutura da água no estado sólido (químicaresponde)
O gelo (sólido) por ter menor densidade do que a agua no estado líquido.
O petróleo também é menos denso que a água. É por isso que em caso de acidente com navios petroleiros esse composto flutua na água do mar. Na figura abaixo é possível ver o resultado do vazamento de petróleo na bahia de Santo Agostinho no Nordeste brasileiro no ano de 2019.
Mancha de óleo é encontrada em Suape, no Cabo de Santo Agostinho
(Foto: Salve Maracaípe/Reprodução, g1).
"É comum utilizar valores de densidade para determinar se uma substância flutuará ou afundará em outra substância em um sistema heterogêneo, já que a densidade influencia diretamente na força peso de cada corpo ou substância. Quanto maior a densidade, maior a força peso; assim, objetos ou fluidos de maior densidade possuem uma força peso maior e, por isso, direcionam-se para o fundo dos recipientes em que estão. Você já deve ter notado que, em derramamentos de petróleo no oceano, o petróleo nunca afunda, pois é uma substância menos densa que as águas salgadas. O mesmo ocorre no Mar Morto, uma vez que a alta concentração de sais faz com que a densidade da água seja maior, favorecendo a flutuabilidade dos nadadores." (brasilescola)

O gráfico mostra a variação da densidade da água pela temperatura. (casaamericana).
Isso acontece pelo fato da água ter o que chamamos de densidade irregular, ou seja, ela se comporta de maneira diferente de outros elementos.
A densidade da água no estado líquido, em temperatura ambiente de aproximadamente 20 °C, é de 0,99 g/cm³, ou 1g/cm³.
Atinge sua máxima densidade quando está na temperatura de 4 °C, com 1,000 g/cm³.
Quando passa para o estado sólido, na temperatura de 0 °C, sua densidade diminui para 0,92 g/cm³.
Através desses dados, é possível observar como a densidade da água realmente tem um comportamento irregular, uma vez que aumenta no estado líquido e decresce para o sólido.
Vemos então que a densidade, assim como o ponto de fusão e ebulição, é uma característica especifica dos materiais e, portanto, nos ajuda a saber se uma substância é pura ou se é uma mistura de substâncias. A densidade da água, por exemplo, é 1g/mL, enquanto a mistura de água e sal de cozinha (NaCl) apresenta densidade diferente: quanto maior a concentração de sal, maior será a densidade da mistura.
A densidade é um fator primordial para determinar se um corpo é capaz de flutuar, juntamente com a força de empuxo. Basicamente, para que haja flutuação, a densidade do corpo deve ser menor que a densidade do líquido no qual o corpo deverá flutuar.
No primeiro caso, da esquerda, a densidade do corpo (dc) é menor que a densidade do líquido (água) dL. No meio temos que a densidade do corpo é igual a densidade do líquido (dc=dL) e no caso da direita a densidade do corpo, dc, é maior do que a densidade do líquido dL, nesse caso o corpo afunda.
Basicamente, para que haja flutuação, a densidade do corpo deve ser menor que a densidade do líquido. Se as densidades forem iguais, o corpo permanece totalmente submerso, mas em equilíbrio (velocidade nula ou com velocidade constante). Se a densidade do corpo for maior que a do líquido, o corpo desce acelerado até o fundo.
Ainda, se um corpo de densidade menor que a do líquido for forçado a submergir completamente (enquanto sua tendência natural é flutuar), ele sobe, acelerado pela força de empuxo (esse é o caso de uma boia ao ser afundada em uma piscina).
Vale observar que a relação entre as densidades que determina a flutuação, e não o peso ou a massa do corpo. Assim, um navio (mesmo um cargueiro muito pesado) consegue flutuar devido ao volume preenchido somente com ar no interior de seu casco, que lhe confere uma densidade total menor que a da água.
(fazcomex)
(ebanataw)
É interessante notar que a relação entre as densidades também vale para a flutuação entre líquidos imiscíveis. Por exemplo, ao se misturar no mesmo recipiente óleo e água, eles não se solubilizam. Em vez disso, o óleo flutua por cima da água, por ter densidade menor.
O sal que utilizamos para preparar alimentos é mistura homogênea sólida. No sal de cozinha há principalmente cloreto de sódio (NaCl), mas também pode haver cloreto de potássio (KCl) e adição de iodeto de potássio (KI).
Resumo da densidade
1) A densidade é uma propriedade da matéria que relaciona a massa e o volume de um corpo, ou seja, é calculada ao se dividir a massa do corpo pelo seu volume.
2) É um parâmetro importante na Química, não só para identificar substâncias mas também para caracterizá-las.
3) A densidade pode ser utilizada em testes de controle de qualidade de produtos por ex.: a gasolina.
4) Quanto mais denso for um corpo, mais ao fundo do sistema ele se posiciona.
5) A temperatura e a composição química da substância são fatores que influenciam no valor da densidade. Por isso, seu cálculo se faz a 20°C ao nível do mar (1atm).
6) A densidade, quando se fala de uma substância pura, é conhecida como massa específica ou densidade absoluta.
7) Entre os elementos da Tabela Periódica, o ósmio é o elemento mais denso, enquanto o hidrogênio é o menos denso.
2) MISTURAS HOMOGÊNEAS E HETEROGÊNEAS
A mistura homogênea é uma solução que apresenta uma única fase enquanto a heterogênea pode apresentar duas ou mais fases. Fase é cada porção que apresenta aspecto visual uniforme.
A mistura homogênea é também chamada de solução. Ex. o soro fisiológico (mistura de água e sal).
Soluto e solvente
Solução, do latim solutĭo, é um termo com duas grandes acepções. Por um lado, trata-se da ação e do efeito de resolver uma dificuldade ou uma dúvida ou problema, por outro, solução é a ação e o efeito de dissolver, uma substância em outra.
Uma solução ou dissolução é uma mistura homogênea de duas ou mais substâncias.
A substância presente em menor quantidade e que se dissolve na mistura é conhecida pelo nome de soluto; a substância na qual se dissolve o soluto chama-se solvente.
Por exemplo na mistura:
Uma colher de sopa de sal em 200 ml de água (1 copo)
O sal (uma colher de sopa) é o soluto e
200ml de água é o solvente.
A relação entre a quantidade de soluto e a quantidade de solvente recebe o nome de concentração da solução.
Convém lembrar sempre que as propriedades químicas dos componentes das substâncias não se alteram numa solução. Porém, as propriedades físicas da solução diferem das propriedades físicas do solvente puro.
Nas soluções, como as de água e sal ou de água e açúcar, há um soluto (o sal ou o açúcar), que é a substância que se dissolve (e está presente em menor quantidade), e um solvente (a água), a substância que dissolve o soluto.
As soluções em que a água é o solvente são chamadas soluções aquosas.
Também há soluções gasosas, como o ar não poluído, e soluções sólidas, como as ligas metálicas, por ex.: bronze, liga de estanho e cobre, latão: liga de zinco e cobre, aço: 98,5% ferro, 0,5 a 1,7 % de carbono e o restante (traços) de silício (Si), enxofre (S) e fósforo (P).
A quantidade de soluto em relação à quantidade de solvente pode variar em uma mistura.
Se adicionarmos uma quantidade muito grande de sal à água, chegaremos a um ponto em que o soluto não se dissolve mais, e se deposita no fundo do recipiente.
A mistura passa então a ser heterogênea. Você pode fazer esse experimento em casa.
Separação de misturas homogêneas (todamateria)
Separação de misturas heterogêneas (todamateria)
3) SEPARAÇÃO DOS COMPONENTES
DE UMA MISTURA
Veja o seu livro texto página 203 a 208
Os processos de separação de misturas são muito importantes, pois a maioria dos materiais encontrados na natureza não são substâncias puras, ou seja, não são constituídos de um único tipo de partículas ou moléculas; mas, na verdade, trata-se de misturas compostas de duas ou mais substâncias diferentes.
Para a obtenção separada de cada uma das suas substâncias puras que deram origem à mistura, utilizamos um conjunto de processos físicos denominados análise imediata. Esses processos não alteram a composição das substâncias que formam uma dada mistura.
Os métodos de separação são utilizados para separar os componentes de misturas homogêneas e heterogêneas. Entre os principais métodos estão:
1) Catação
É o processo de separação dos componentes de uma mistura heterogênea de sólidos, feijão com as mãos com pinça (separação sólido - sólido ).
Método manual de separação, como quando escolhemos os feijões para cozinhar.
A catação é um tipo de separação manual de sistemas do tipo "sólido-sólido". As substâncias são separadas manualmente e pode utilizar uma pinça, colher, ou outro objeto auxiliador para a separação. É utilizada na separação de grãos bons de feijão dos carunchos e pedrinhas. Também é utilizada na separação dos diferentes tipos de materiais que compõem os resíduos sólidos recicláveis como vidro, metais, papel, plásticos e entre outros. Trabalho desempenhado por catadores de materiais recicláveis que buscam dar uma destinação ambientalmente adequada para estes materiais.
Catando feijão (universo)
Catação (fenixonline)
2) Peneiração ou tamisação
A peneiração, é usada para separar componentes sólido de uma mistura heterogênea com base no tamanho. As peneiras deixam passar um componente menor que o espaçamento de sua malha, retendo os componentes maiores.
É usada para separar sólidos de diferentes tamanhos, geralmente passando por uma peneira, sendo que os sólidos menores passam por sua malha, sendo separados dos maiores. É muito usada em construções para separar a areia do cascalho e na cozinha quando se quer separar impurezas na farinha de trigo.
A tamisação ou peneiração é um dos métodos mecânicos existentes, para separar sólidos ou partes de uma substância sólida que apresente grãos com dimensões diferentes, podendo ser separados pela malha de uma peneira.
3) Levigação
Consiste em usar uma corrente de água para separar corpos mais densos de corpos menos densos em uma mistura heterogênea de sólidos.
Levigação como um método de separação, é usado para separação de misturas heterogêneas de sólidos. Quando uma mistura se forma por substâncias sólidas de densidades diferentes, pode-se utilizar uma corrente de água para separá-las. É o caso do ouro, que nos garimpos normalmente é encontrado junto a uma porção de terra ou areia. Usa-se uma rampa de madeira ou uma bacia em que se passa uma corrente de água que serve para separar essas substâncias.
Garimpo usando bateia (para levigação)
Batéia (garrett)
Levigação (infoescola)
4) Ventilação
A mistura d café e folhas da planta do café pode por exemplo, ser separados lançando-a para cima deixando que a corrente de ar arraste as folhas. Na ventilação a mistura acaba submetida a uma corrente de ar. Desse modo, o componente menos denso da mistura acaba levado pelo vento enquanto o componente mais denso fica. Trata-se de um modelo de separação de misturas heterogêneas entre sólidos. Possui como principal utilidade a ventilação na separação de grãos da sua casca e demais impurezas. A ventilação acaba sendo bastante utilizada na indústria de grãos, justamente para manter a qualidade do produto. Durante muito tempo esse processo era realizado de maneira manual, por meio de peneiras em que eram colocados os grãos com a casca. Então essa mistura era agitada em uma corrente de ar (vento), e o vento levava a casca menos densa embora e os grãos ficam no recipiente.
Ventilação (fenixonline)
5) Separação magnética ou Imantação
É usada em misturas heterogêneas nas quais um dos componentes e atraído por um imã.
Separação magnética (makeagif)
Separação magnética (makeagif)
Imantação (slideplayer)
6) Dissolução fracionada
A dissolução fracionada (também conhecida por extração por solvente) é um método empregado para separar uma mistura heterogênea de dois ou mais sólidos, sendo que apenas um deles é solúvel em determinado solvente. Um bom exemplo para esse processo seria sal + areia. Nesse caso usamos água, pois o sal se dissolve na água, e a areia não. Depois, com sal dissolvido na água podemos retirar a fase líquida (sal+água), e o que sobra é a areia. Se quisermos recuperar o componente solúvelo, o sal (diluido na água) podemos fazer uma evaporação do líquido usado. Assim, a água evapora e o que sobra é o sal.
7) Filtração
É muito usado nas residências para filtrar água da torneira antes de bebê-la. A vela de porcelana do filtro retém as partículas maiores (como partículas de solo ou microrganismos) e deixa passar a água com sais minerais e outras partículas muito pequenas.
Filtração, usando um tecido para coar o café (behance).
Filtração (brasilescola)
8) Coagulação
Coagulação é o método no qual uma substância é adicionada a uma mistura com o intuito de se unir à componentes sólidos que estejam em suspensão em um líquido. Exemplo: adicionar sulfato de alumínio na água em uma estação de tratamento de água.
A coagulação está baseada no conjunto de ações físicas e reações químicas, que ocorrem com duração de poucos segundos, entre o agente coagulante, (usualmente sais de alumínio ou de ferro), as impurezas presentes e a água (MUSIKAVONG et al., 2005).
As etapas que constituem o processo de coagulação ocorrem em três fases:
• Adição do agente coagulante que engloba espécies químicas que possuem capacidade de produzir precipitados e espécies hidrolisadas e dissociadas em meio aquoso.
• Desestabilização das partículas coloidais suspensas e dispersas na massa líquida.
• Agregação dessas partículas para formação dos flocos que posteriormente serão removidos por sedimentação ou nas unidades de filtração (MOGHADDAMA et al., 2010).
9) Floculação
Processo físico de separação de misturas heterogêneas.
Método de separação de mistura que se baseia na adição de um agente floculante, como Al2(SO4)3 (sulfato de alumínio) ou FeCl3 (cloreto férrico), que aglutina (se liga) às impurezas sólidas formando pequenos flóculos mais densos do que a fase líquida, os quais decantarão lentamente, pela ação da gravidade. Exemplos: Nas estações de tratamento de água e na limpeza de piscinas.
A floculação é um método que complementa a coagulação, já que nele a mistura é agitada para favorecer a ação do coagulante (Martins, 2016).
A floculação é o processo que envolve a adição de produto químico formador de flocos, geralmente após a coagulação, os flocos começam a se aglomerar, iniciando-se a lenta sedimentação de sólidos coloidais, o que desempenha um papel importante no destino e transporte de contaminantes em ambientes aquáticos por colmatar os flocos agregados para formar aglomerados maiores na presença de materiais, como exemplo, poliméricos (SOMASUNDARAN et al., 2005, Martins, 2016).
A operação unitária coagulação-floculação é influenciada pelo tipo de coagulante, dosagem, concentração de partículas, pH da solução, a velocidade de agitação, natureza do auxiliar de floculação e o tempo de mistura rápida e lenta (CHAKRABORTI et al., 2003).
Floculação e decantação (mixtura)
Processo de coagulação-floculação (paginas)
10) Decantação
Se você deixar uma mistura de areia e água em repouso ou enxofre e água verá que a areia e o enxofre, que são mais densos vão se depositando no fundo do recipiente. Após a decantação, pode-se usar um sifão, um tubo cheio de água que transfere o líquido de um recipiente em um nível mais alto para outro, em um nível inferior, ou simplesmente verter o líquido para outro recipiente. O que sobra no frasco é o componente mais denso.
O processo de sedimentação auxilia na separação das partículas sólidas em suspensão através da diferença de solubilidade e densidade entre estas partículas presentes na água a ser tratada.
A sedimentação destas partículas em suspensão exige determinada demanda de tempo, que pode estar relacionada a fatores como: repouso da água nos decantadores, o tamanho e estabilidade dos flocos formados, entre outros (ALLEGRE, 2004, Martins, 2016).
Os flocos formados com o auxílio do coagulante são separados da água pela ação da gravidade, tendendo ao acúmulo e sedimentação no fundo de tanques, normalmente de formato retangular em estações de tratamento de água.
Decantação (modif. de maissoja)
Sedimentação, Decantação e Sifonação (mundoeducação)
Decantação com funil de bromo
11) Evaporação
É quando colocamos água com sal e a água, ao receber energia do sol, evapora restando somente o sal. O sal de cozinha vem a água do mar, que é colocada em tanques rasos para que evapore, ficando só o sal, que é coletado.
Evaporação é o método mais simples para separar um sólido de um líquido. Consiste em deixar a mistura em repouso ou aquecê-la até que o líquido, por ser mais volátil, evapore, restando somente o sólido no recipiente. É aplicado nas salinas, para obter o sal de cozinha a partir da água salgada.
Evaporação da água salgada para a produção do sal de cozinha, salinas. (brasilescola).
Salinas (professorinterativo)
12) Destilação ou Destilação simples
É usado para separar componentes de uma mistura homogênea formada por um líquido e um sólido dissolvido, como uma mistura de água e sal. Na destilação simples, é usado um aparelho chamado destilador.
Para separar uma mistura de água e sal, cujos pontos de ebulição são muito diferentes emprega-se a destilação simples (ponto de ebulição da água é 100 ºC ao nível do mar, e a do NaCl é 1465 ºC). Nesse processo os dois componentes são recuperados. A mistura é aquecida e a água entra em ebulição (100 ºC), mas o sal de cozinha ainda não. O vapor de água passa pelo interior de um condensador, que é resfriado por água corrente fria. Com esse resfriamento, o vapor condensa-se. A água liquida, isenta de sal, é recolhida em um recipiente. Ao final do processo, restará apenas sal sólido no frasco original onde estava a mistura.
O líquido purificado que é recolhido no processo de destilação, recebe o nome de destilado.
Destilador usado na destilação simples (todoestudo)
A destilação simples serve para a separação de uma mistura homogênea de sólido e líquido, como sal e água, por exemplo. É importante que os pontos de ebulição das duas substâncias sejam bastante diferentes. A solução é colocada em um balão de destilação, feito de vidro com fundo redondo e plano, que é aquecido por uma chama. A boca do balão é tampada com uma rolha, junto com um termômetro. O balão possui uma saída lateral, inclinada para baixo, na sua parte superior. Nessa saída é acoplado o condensador.
Equipamento: destilador, usado na destilação simples (kimyaali)
Destilação simples
13) Destilação fracionada ou Coluna de fracionamento
Para separar uma mistura homogênea de líquidos com pontos de ebulição próximos, pode-se usar a destilação fracionada. Por esse método, é possível separar misturas compostas por muitas substancias coo o petróleo.
Coluna de fracionamento (universe)
O petróleo é um líquido viscoso, escuro e oleoso, extraído de depósitos subterrâneos. É formado por uma mistura de substâncias orgânicas resultantes da transformação, ao longo de milhões de anos, de restos de algas e outros seres microscópicos aquáticos que foram soterrados. Depois de sua extração, o petróleo é transportado para refinarias, onde seus componentes são separados e purificados nas chamadas torres de fracionamento. O petróleo é aquecido em uma fornalha, vaporiza-se e sobe pela torre. Os vapores com temperatura de ebulição mais alta se condensam nas partes mais baixas da torre, que é mais quente, e o líquido é recolhido. No alto da torre, os vapores que têm temperatura de ebulição mais baixa se condensam. Reveja a figura acima. Assim, em cada nível da torre, condensa uma fração de petróleo, resultando em vários produtos: gasolina, querosene, óleo diesel e gás de cozinha, conhecido como gás liquefeito do petróleo (GLP).
O petróleo é um líquido viscoso, menos denso que a água e formado por uma mistura complexa de compostos orgânicos, principalmente hidrocarbonetos (compostos cujas moléculas são formadas somente por átomos de carbono e de hidrogênio) associados a pequenas quantidades de outras classes de compostos que contêm nitrogênio, oxigênio e enxofre.
A teoria mais aceita para a formação do petróleo é a de que ele se originou de restos de seres vivos, animais e vegetais, ao longo de milhões de anos (estima-se que as reservas de petróleo tenham entre 10 e 500 milhões de anos). Ocorreu que principalmente pequenos seres marinhos, como animais e vegetais unicelulares, acabaram se depositando no fundo de lagos e mares. Com o tempo, houve acumulação de sedimentos e essa matéria orgânica foi empurrada para partes ainda mais profundas, onde condições elevadíssimas de pressões e temperatura, bem como ausência de oxigênio, impediram que bactérias realizassem a decomposição rápida dessa matéria orgânica. (brasilescola).
GLP Gás liquefeito do petróleo
(gás de cozinha)
Nafta (gases e solvente)
Gasolina
Querosene (combustíveis de avião e parafina)
Óleo diesel
Óleos lubrificantes e ceras
Óleos combustíveis
Resíduo (asfaltos para estradas e telhados)
Os sistemas homogêneos de dois ou mais líquidos oferecem uma razoável dificuldade para sua separação. A técnica da destilação fracionada pode ser usada com sucesso para separar algumas misturas desse tipo.
A destilação fracionada é um aprimoramento da destilação simples, na qual uma coluna de vidro cheia de obstáculos é colocada entre o condensador e o balão na qual a mistura é aquecida.
Os obstáculos permitem que o componente de menor ponto de ebulição chegue mais rapidamente ao condensador e destile primeiro. Assim que ele destilar totalmente, destilará o próximo componente líquido da mistura, que é recolhido em outro frasco.
Destilação fracionada (makeagif)
Destilação fracionada do petróleo é baseada no ponto de ebulição de cada substância. (preparaenem).
Refino do petróleo (qambiental)
Destilação (quimicaparaovestibular)
14) Centrifugação
A centrifugação ocorre através da força centrífuga, a qual separa o componente mais denso do que é menos denso pela rotação do equipamento em alta velocidade.Características da centrifugação:
1) A centrifugação é um método de separação de misturas heterogêneas.
2) A centrifugação se aplica à separação de sólidos dispersos em líquidos e líquidos com diferentes densidades.
3) A centrifugação se baseia na diferença de densidade.
4) A centrifugação é útil para a separação de soluções coloidais, como o sangue.
5) Ao término da centrifugação, obtém-se uma fração inferior de maior densidade e o sobrenadante, que é a fração superior de menor densidade.
6) A centrifugação é usada em diversos segmentos industriais e químicos, em laboratório de análises clínicas e biológicas.
7) Em ambientes domésticos, a centrifugação é usada para retirar excesso de água das roupas e alimentos, por exemplo.
Exemplos:
Centrifugação do sangue para separar os elementos figurados (hemácias, glóbulos brancos, plaquetas e plasma sanguíneo).
Centrifugação no processo de lavagem de roupas (máquina de lavar), a qual separa a água suja das peças de vestuário, ou simplesmente separa a água das roupas.
15) Sifonação
Método de separação de substâncias líquidas, no qual utilizamos uma mangueira, ou uma pipeta, um canudo, seringa e etc, para retirar o líquido mais denso ou o menos denso de uma mistura formada por apenas líquidos.
Exemplo: Separar os componentes da mistura formada por água e óleo.
Uso de um sifão para separar misturas (makeagif)
16) Flotação
Flotação é o método no qual um líquido é adicionado a uma mistura formada por dois sólidos, os quais não se dissolvem e um deles é mais denso, enquanto o outro é mais denso que o líquido. Em seguida uma decantação é realizada. Exemplo: adicionar água em uma mistura formada por areia e isopor.
I
Utiliza-se um líquido, normalmente a água, como elemento de separação de dois sólidos em que um deles possui densidade menor que a desse líquido. Isso faz com que o sólido menos denso fique sobrenadando. Vale lembrar que esses sólidos não podem ser solúveis nesse líquido. Exemplos: Separação da serragem da areia e do alpiste da areia pela água (edinamarquimica).
17) Fusão fracionada (S + S)
O método de fusão fracionada, é usado principalmente na separação de soluções sólidas. É o processo no qual se aquece a mistura até que esta atinja o ponto de fusão de um dos componentes. O componente de menor ponto de fusão derrete primeiro e é consequentemente separado.(dex)
18) Liquefação fracionada
Neste processo diminui-se a temperatura e aumenta-se a pressão. O ponto de condensação é o fator decisivo.
Ex.: Separação dos componentes do ar puro. O2 + N2 (do ar).
Coloca-se ar numa esfera, retira-se o calor (diminuindo a temperatura) e aumentamos a pressão, assim o ar liquefaz-se. A seguir reduz-se a pressão e mantém-se a temperatura constante. O N2 por ter menor P.E. retorna ao estado gasoso, enquanto o oxigênio permanece líquido e pode ser separado.
Fonte
TRANSFORMAÇÕES QUÍMICAS
Transformações químicas são ações que resultam na formação de novas substâncias. Além da mudança de estado, as variações de cheiro, de cor, de densidade e de temperatura podem ser evidências de transformações químicas. Nelas podem acontecer explosão e liberação de gases.
É possível confirmar a origem de novas substâncias comparando-se as características apresentadas por produtos e reagentes.
Produto é a nova substância, enquanto reagente é a substância que lhe dá origem, ou seja, a substância inicial.
Uma transformação química ocorre quando as substâncias iniciais se rompem e os átomos presentes se rearranjam e formam novas substâncias.
Nas misturas que estudamos até aqui, cada substância mantém suas propriedades originais mesmo após ser misturada a outras. Ao misturarmos água com areia, por exemplo, a água e a areia mantêm as propriedades que tinham antes de serem misturadas. Dizemos que houve apenas um fenômeno físico.
Agora, imagine a seguinte situação: misture farinha de trigo, açúcar, ovos, manteiga e fermento, e então você terá, pelo menos no início, apenas uma mistura de ingredientes, cada um com suas propriedades. Mas, ao levar a mistura ao forno, após algum tempo ela ficará bem diferente, transformando-se em um bolo. Nesse caso, ocorreram transformações químicas, isto é, reações químicas entre os ingredientes do bolo, produzindo novas substâncias com novas propriedades.
Neste caso, houve um fenômeno químico. Veja mais alguns exemplos de transformações químicas.
Observe as fotos abaixo.
Rasgando papel (tenor)
(tenor)
(gifer)
Na primeira foto, uma pessoa está rasgando um papel e, na segunda, papéis estão sendo queimados. Você sabe dizer qual das duas situações é um exemplo de transformação química?
A fumaça e o calor produzidos pela queima do papel são evidências de que ocorreu uma transformação. As moléculas de gás carbônico que são liberadas foram produzidas pela queima da celulose e pelo consumo de oxigênio do ar por meio da combustão.
As transformações químicas diferenciam-se das transformações físicas pelo fato de que as transformações físicas apenas alteram estado e as substâncias continuam sendo as mesmas.
As transformações químicas, ou reações químicas, alteram a natureza da matéria e, consequentemente, suas propriedades específicas, como densidade e pontos de fusão e de ebulição. Em outras palavras, uma transformação química ocorre quando novas substâncias são formadas. Entretanto devemos lembrar que a massa da nova substância é igual a massa dos reagentes.
É o caso do papel (feito de celulose) que, ao ser queimado, se transforma em fuligem (carbono) e em alguns gases (entre eles, o gás carbônico).
(giphy)
Observe agora a figura acima. Ela mostra bolhas resultantes da formação de um gás, o gás carbônico, após a reação química entre ácido acético, uma substância do vinagre (CH3COOH), e uma solução de bicarbonato de sódio (NaCl). Em certos casos, é possível enxergar a olho nu evidências da ocorrência de uma transformação química. Na foto, formação de bolhas de gás carbônico depois da adição de vinagre a uma solução de bicarbonato de sódio.
EXERCÍCIOS
1) Soluções são sistemas homogêneos formados pela mistura de duas ou mais substâncias. As soluções são constituídas de dois componentes: o soluto, que é o que se dissolve e se encontra em menor quantidade, e o solvente, que é o componente em maior quantidade e que atua dissolvendo o soluto.
De três exemplos de soluções e apresente duas maneiras de separar uma mistura heterogênea.
O soro fisiológico solução aquosa se NaCl dissolvido na água.
A água sanitária soluções aquosas hipoclorito de sódio (NaClO).
Solução formada por gases e líquidos: podemos citar a bebida gaseificada como exemplo em nosso cotidiano de substância no estado gasoso dissolvida em um líquido.
2) Conceitue soluto e solvente
O soluto, que é o que se dissolve e se encontra em menor quantidade, e o solvente, é o componente em maior quantidade e que atua dissolvendo o soluto.
3) De três exemplos de transformações químicas
Queima ou combustão da madeira
Formação da ferrugem
Azedar o leite (coagulação das proteínas)
Cozimento do ovo.
4) Qual a principal característica das soluções?
A principal característica das soluções é serem homogêneas, isso significa que o soluto está dissolvido de modo uniforme por toda a sua extensão. Isso é importante porque mostra que as soluções possuem propriedades iguais em todos os seus pontos. Se um técnico colher várias amostras de determinada solução, todas terão as mesmas propriedades, pontos de fusão e ebulição, densidade e composição.
5) O que o leite, a água mineral e o granito tem em comum?
O leite, a água e o granito: todos são misturas de substâncias. O leite é uma mistura de água, lactose (um tipo de açúcar), sais minerais, proteínas, gorduras, vitaminas e muitas outras substâncias. A Água. Quando bebemos água, estamos ingerindo vários sais minerais, além de gases dissolvidos na água. O granito é uma rocha formada por uma mistura de minerais: quartzo (cor incolor), feldspato (leitoso ou cinza) e mica (preta). Minerais: são a substâncias inorgânicas naturais de composição química definida e de estrutura sólida cristalina determinada ou amorfa, com arranjo atômico ordenado, que às vezes se apresentam em formas geométricas mais ou menos regulares.
a) duração da ebulição de 10 min.
b) duração da fusão de 40 min.
c) ponto de fusão de 40 °C.
d) ponto de fusão de 70 °C.
e) ponto de ebulição de 50 °C.
7)
A 20 °C, o oxigênio é gasoso, o fenol é sólido e o pentano é líquido.
8) Em uma indústria, um operário misturou, inadvertidamente, polietileno (PE), policloreto de vinila (PVC) e poliestireno (PS), limpos e moídos. Para recuperar cada um destes polímeros, utilizou o seguinte método de separação: jogou a mistura em um tanque contendo água (densidade = 1,00 g/cm3), separando, então, a fração que flutuou (fração A) daquela que foi ao fundo (fração B). Depois, recolheu a fração B, secou-a e jogou-a em outro tanque contendo solução salina (densidade = 1,10g/cm3), separando o material que flutuou (fração C) daquele que afundou (fração D).
(Dados: densidade na temperatura de trabalho em g/cm3: polietileno = 0,91 a 0,98; poliestireno = 1,04 a 1,06; policloreto de vinila = 1,5 a 1,42)
As frações A, C e D eram, respectivamente:
a) PE, PS e PVC
b) PS, PE e PVC
c) PVC, PS e PE
d) PS, PVC e PE
e) PE, PVC e PS
A fração A, que flutuou na água (d = 1,00 g/cm3), foi o polietileno (densidade entre 0,91 e 0,98). A fração C, que flutuou na solução salina (d = 1,10 g/cm3), foi o poliestireno (densidade entre 1,04 e 1,06). A fração D, portanto, é o policloreto de vinila, cuja densidade é maior que a da solução salina, ou seja, entre 1,5 g/cm3 e 1,42 g/cm3.
9) (Enem PPL 2015) O quadro apresenta a composição do petróleo.
Para a separação dos constituintes com o objetivo de produzir a gasolina qual seria o método a ser utilizado? Justifique.
Destilação fracionada pois através de seus pontos de ebulição podemos separar os componentes e entre eles a gasolina.
10) O fluxograma a seguir representa a separação de uma mistura heterogênea. Analise e identifique quais são as técnicas de separação utilizadas que representam os números de 1 a 4.
(1) Catação, pois é possível separar com a mão os grãos de milho dos demais constituintes da amostra.
(2) Peneiração, pois há diferença de gramatura dos grãos.
(3) Dissolução fracionada, pois se adiciona água à mistura para separar a areia do sal de cozinha.
(4) Decantação ou filtração, pois a solução água mais sal passa pelo filtro, enquanto a areia é retida; ou esta decanta e a solução de água com sal fica acima, podendo ser retirada com cuidado.
(5) Destilação simples, pois, ao aquecer a água, ela evapora (sendo condensada em seguida) e então é separada do sal; uma opção mais simples é apenas evaporar a água, restando o sal.
11) A fim de separar todos os componentes de uma mistura contendo areia, ferro em pó e uma solução salina aquosa, foi proposto o seguinte esquema:
Os processos de separação mais indicados em I, II e III são, respectivamente:
(A) filtração, destilação e imantação.
(B) filtração, evaporação e decantação.
(C) destilação, levigação e filtração.
(D) catação, evaporação e imantação.
(E) imantação, catação e evaporação
Substância e mistura
Propriedades da matéria
Empuxo e densidade
conversor
Exercícios
Massa
Experimentos
Escólios
Primeira Lei de Newton
Todo corpo continua em seu estado de repouso ou de movimento uniforme em uma linha reta, a menos que seja forçado a mudar aquele estado por forças aplicadas sobre ele.
Segunda Lei de Newton
A mudança de movimento é proporcional à força motora impressa, e é produzida na direção de linha reta na qual aquela força é aplicada.
Terceira Lei de Newton
A toda ação há sempre uma reação oposta e de igual intensidade: as ações mútuas de dois corpos um sobre o outro são sempre iguais e dirigidas em sentidos opostos.
Variações e aplicações das ligas de bronze
A liga de bronze é um material muito abrangente com relação às suas composições e aplicações. Em suas diferentes estruturações químicas, o bronze pode ser utilizado para a produção de parafusos, objetos de decoração e até em mancais e engrenagens. As fórmulas de composição do bronze precisam variar para atender diferentes demandas de produção, algumas delas são:
Cobre (Cu), Estanho (Sn) e Zinco (Zn)
Nessa composição, com cerca de 2% de zinco, as ligas de bronze são mais usadas na fabricação de parafusos, porcas e válvulas. Na presença de umidade, o zinco tem uma propriedade química que forma uma “capa” superficial de óxido de carbono, e essa característica acaba fornecendo ao bronze uma resistência extra à corrosão.
Cobre (Cu), Estanho (Sn) e Chumbo (Pb)
As ligas de bronze produzidas com chumbo na composição também são conhecidas como “bronze vermelho”. A presença do chumbo pode variar entre 7%, 8%, 12% e 15%, e nessas formações a liga metálica recebe propriedades de resistência mecânica, térmica e química. Com essas características, o bronze vermelho passa a ser bastante requisitado para a fabricação de peças artesanais e instrumentos musicais.
Cobre (Cu), Estanho (Sn) e Alumínio (Al)
Com variações que vão de 6%, 12% até 20% de alumínio na composição, essa liga de bronze é muito útil para a fabricação de equipamentos e válvulas que exigem alta dureza combinada com a leveza desse elemento. As características acima são somadas à resistência mecânica e química do bronze, o que torna essa composição muito procurada para a produção de peças resistentes ao atrito como hélices de equipamentos variados, canhões de irrigação agrícola, bombas d’água e até na produção de equipamentos para aplicação de agrotóxicos.
Cobre (Cu), Estanho (Sn) e Manganês (Mn)
Nessa mistura, geralmente é utilizado 15% do elemento manganês, que é caracterizado por sua elevada resistência química. Por esse motivo, essa composição de bronze é muito utilizada em tubulações de esgoto, equipamentos de tratamento de água e até mesmo em indústrias químicas com propósitos estratégicos.
Cobre (Cu), Estanho (Sn) e Fósforo (P)
Também conhecido como bronze fosforoso, o bronze fica com cerca de 15% de fósforo nesta composição, o que concede à liga excelentes propriedades de usinabilidade, conformabilidade e elevada diminuição dos efeitos de atrito (antifricção). Essa liga é fundamental em equipamentos que exigem lubrificação por tempos prolongados, como anéis de pistão, material hidráulico, buchas, mancais e engrenagens. (coppermetal, metalnista)





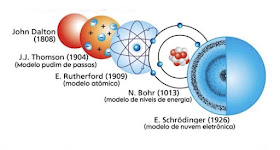
































.gif)


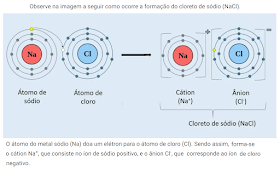






































































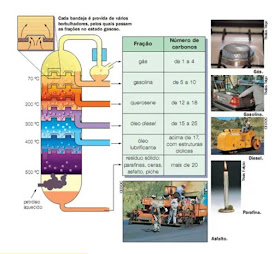





.gif)















Nenhum comentário:
Postar um comentário