TIPOS DE VACINAS
Vacina com virus inativado
Coronavac
Sinovac
Butantan
Vacina Vetores virais
Astrazeneca
Oxford
Fiocruz
Jensen
Vacina de mRNA
Pfizer
BioNTech
Moderna (Modified mRNA)
Tipos de vacinas
Vacina à base de proteína: o método tradicional
Vírus atenuado, Vírus inativado, proteínas virais purificadas
Quando os cientistas estavam desenvolvendo a vacina contra a hepatite B na década de 1980, eles descobriram que podiam cultivar a proteína de superfície do vírus por conta própria em um laboratório.
Usando essa ideia os pesquisadores agora estão tentando fazer algo semelhante com o coronavírus.
Tanto a Novavax quanto a Sanofi-GSK estão desenvolvendo vacinas usando uma versão sintetizada da proteína spike, que são cultivadas em células de insetos.
A proteína é então purificada e injetada no corpo. O Dr. Francis Collins, diretor do National Institutes of Health, disse em uma audiência no Senado norte-americano em setembro que o processo é "testado e aprovado". Mas é um pouco mais lento do que as tecnologias usadas por outros candidatos.
A Novavax e a Sanofi-GSK ainda não iniciaram os testes de fase três nos EUA para suas vacinas à base de proteínas. O primeiro planeja iniciar um estudo de fase três apoiado pela Warp Speed em novembro, enquanto a Sanofi-GSK espera iniciar seu estudo de fase três em dezembro.
Ambas as vacinas requerem um adjuvante, um agente químico que aumenta a resposta imunológica. Mas a vantagem das injeções é que podem ser armazenadas na temperatura normal da geladeira, o que as torna mais fáceis de enviar do que outros candidatos importantes. (C)
TIPOS DE VACINAS EM DESENVOLVIMIENTO NO MUNDO CONTRA O CORONAVIRUS (Nature)
Virus vaccines
At least seven teams are developing vaccines using the virus itself, in a weakened or inactivated form. Many existing vaccines are made in this way, such as those against measles and polio, but they require extensive safety testing.
Sinovac Biotech in Beijing Butantan (Brazil) has started to test an inactivated version of SARS-CoV-2 in humans.
Viral-vector vaccines
Around 25 groups say they are working on viral-vector vaccines. A virus such as measles or adenovirus is genetically engineered so that it can produce coronavirus proteins in the body. These viruses are weakened so they cannot cause disease. There are two types: those that can still replicate within cells and those that cannot because key genes have been disabled.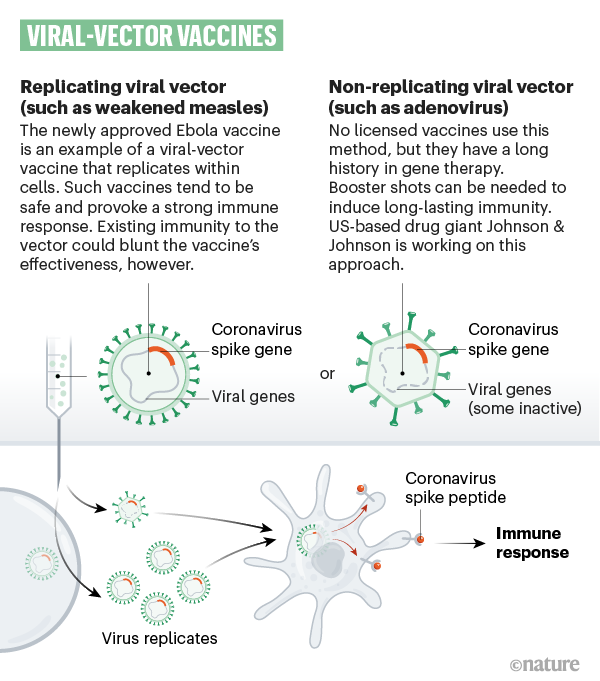
Nucleic-acid vaccines
At least 20 teams are aiming to use genetic instructions (in the form of DNA or RNA) for a coronavirus protein that prompts an immune response. The nucleic acid is inserted into human cells, which then churn out copies of the virus protein; most of these vaccines encode the virus’s spike protein.
Protein-based vaccines
Many researchers want to inject coronavirus proteins directly into the body. Fragments of proteins or protein shells that mimic the coronavirus’s outer coat can also be used.
QUESTÕES
A vacina da Moderna (Modified RNA) funciona?
A vacina da Moderna foi eficaz na prevenção de casos de Covid-19 no total e na limitação de Covid-19 grave durante os testes. A eficácia da vacina contra a Covid-19 foi de 94,1%, ocorrendo pelo menos 14 dias após a segunda dose, de acordo com um documento informativo divulgado por um comitê consultivo da FDA.
No ensaio da Moderna, 15 mil participantes do estudo receberam um placebo, que é uma injeção de solução salina sem efeito. Ao longo de vários meses, 185 deles desenvolveram Covid-19, com 30 desenvolvendo formas graves da doença. Um deles morreu.
Outros 15 mil participantes receberam a vacina, e apenas 11 deles desenvolveram Covid-19. Nenhum dos 11 ficou gravemente doente.
A vacina foi eficaz em todas as faixas etárias, sexos, grupos raciais e étnicos e participantes com comorbidades médicas associadas ao alto risco de Covid-19 grave, de acordo com o documento informativo. Cerca de 10% dos participantes do estudo eram negros e 20% eram hispânicos ou latinos.
METODOLOGIA DA VACINA
Assim como a vacina da Pfizer, a da Moderna é feita usando o RNA mensageiro, ou mRNA, que é uma receita genética para fazer um pedaço dos espinhos que caracterizam o aspecto externo do coronavírus. Uma vez injetado, o sistema imunológico da pessoa vacina produz anticorpos contra os espinhos. Se uma pessoa vacinada for exposta posteriormente ao coronavírus, esses anticorpos devem estar prontos para atacar o vírus.
A vacina da Moderna, em particular, contém um mRNA sintético que codifica uma estrutura chamada “glicoproteína de espinho estabilizada em pré-fusão” do vírus.
A vacina também contém materiais gordurosos chamados lipídios, trometamina, cloridrato de trometamina, ácido acético, acetato de sódio e sacarose.
Qual a diferença entre a vacina da Moderna e a da Pfizer?
As duas vacinas são muito semelhantes, mas têm algumas diferenças importantes que tornam a vacina da Moderna “mais flexível”, segundo o Secretário de Saúde e Serviços Humanos (HHS) dos Estados Unidos, Alex Azar, disse no mês passado.
Eficácia: Tanto a vacina da Moderna quanto a da Pfizer-BioNTech mostraram níveis de eficácia semelhantes de quase 95%.
“Elas parecem ser mais ou menos equivalentes”, afirmou o doutor Paul Offit, membro do comitê consultivo de vacinas da FDA, durante uma aparição no programa “New Day” da CNN norte-americana na terça-feira (15).
Estrutura: Ambas as vacinas dependem do mRNA, ou RNA mensageiro, para funcionar, embora com estruturas e composições ligeiramente diferentes.
“Embora ambas sejam vacinas de RNA mensageiro, são moléculas de RNA mensageiro bem diferentes, com diferentes sistemas de entrega de lipídios, ou seja, o tipo de gota de gordura na qual o RNA mensageiro está localizado”, disse Offit. “É por isso que elas têm diferentes características de armazenamento e manuseio”.
Armazenamento a frio: Mais importante ainda, a vacina da Moderna não precisa ser mantida em temperaturas superfrias, como a da Pfizer.
A vacina da Pfizer precisa ser armazenada a cerca de -75 graus Celsius, cerca de 50 graus abaixo do que qualquer vacina atualmente usada nos Estados Unidos. A vacina pode ser colocada no geladeira por apenas até cinco dias antes que expire. Para acomodar isso, o CDC criou um conjunto complexo de requisitos de manuseio e armazenamento conhecidos como “cadeia de frio”, que incluem congeladores ultrafrios caros e muito gelo seco.
Em contraste, a vacina da Moderna pode ser mantida em cerca de -20 graus Celsius, valor próximo da temperatura de um freezer doméstico, de acordo com Moncef Slaoui, chefe do esforço dos EUA para desenvolver uma vacina para Covid-19. A vacina da Moderna também pode ser mantida na geladeira por 30 dias antes de expirar.
“Isso é mais administrável e muito mais comumente disponível”, afirmou Slaoui na terça-feira.
Essas diferenças sugerem que a vacina da Pfizer pode ser usada mais para grandes instituições com infraestrutura estabelecida, como hospitais, enquanto a da Moderna pode ser mais útil para instalações menores, como uma rede local ou as farmácias.
Dosagem e tempo: A vacina da Moderna é administrada em duas doses de 100 microgramas aplicadas com 28 dias de intervalo. A vacina da Pfizer é administrada em duas doses de 30 microgramas, aplicadas com 21 dias de intervalo.
Idade: Se autorizada, a vacina da Moderna seria usada em pessoas com 18 anos ou mais, enquanto a vacina Pfizer é autorizada para pessoas com 16 anos ou mais.
Essas são apenas uma parte das possibilidades para uma vacina, apesar de serem reconhecidamente as mais tradicionais, com resultados comprovados ao longo de décadas de estudos. Com a Covid-19, no entanto, as empresas decidiram abrir a caixa de ferramentas e apostar em novas abordagens, como as genéticas.
Em vez de injetar um vírus no paciente, essas vacinas contam com um método diferente de “enganar” o organismo. Elas contêm apenas uma série de instruções em uma sequência de RNA sintético envolta por nanopartículas lipídicas (ou uma pequena capa de gordura, para usarmos termos mais próximos do cotidiano).
Esse RNA sintético é absorvido pelas células, que interpretam as instruções e começam a produzir proteínas virais. Ou seja: um pedacinho do vírus é gerado pelo organismo do paciente vacinado. O sistema imunológico então entende que as partículas são uma ameaça e começa a produzir a resposta, que também será válida para neutralizar um ataque real.
Não afeta o seu genoma
A expressão “genética” vinculada a esse tipo de vacina cria alguma confusão, mas é necessário que fique claro: ela não afeta o genoma dos pacientes. Ela não chega nem perto de alterar seu código genético, e se mantém dentro das células por apenas algumas horas antes de se desfazer.
Neste período, a única coisa que ele fará será alterar o funcionamento de algumas células diretamente afetadas por um tempo, permitindo a produção de proteínas virais. Ela não afeta todo o organismo, nem traz alterações permanentes, como explica Brent R. Stockwell, professor de biologia e química na Universidade de Columbia nos Estados Unidos, em entrevista à Associated Press. Ela não vai invadir o núcleo da célula para afetar o código genético, e se a célula se duplicar, apenas o material original será multiplicado.
A utilização do mRNA replica o processo de uma infecção viral. Quando um vírus entra nas células, ele não afeta o material genético do hospedeiro (pelo menos na maioria dos casos), mas apenas “sequestra” seus sistemas para produzir cópias. No caso da vacina, não há instruções para a multiplicação do vírus, apenas da sua proteína externa.
Não há risco de desenvolver a doença
Como mencionado acima, as vacinas de mRNA contam apenas com instruções para produção da “casca” do coronavírus, como explica Alta Charo, professora de bioética na Universidade de Wisconsin em Madison, nos Estados Unidos, em entrevista à Deutsche Welle. Mais especificamente as proteínas que formam os espinhos que você pode ver em qualquer ilustração do vírus.
Os espinhos do vírus são produzidos pelas células e passam a ser alvo do sistema imunológico
Isso significa que a pessoa vacinada não corre o risco de produzir o vírus por conta própria, já que não há instruções para que suas células façam isso.
Neste ponto, as vacinas de mRNA são seguras. Existem outras técnicas, mais especificamente a de vírus atenuados, que não estão totalmente inativos, que trazem algum risco para pessoas com imunodeficiência, crianças e idosos. Em casos raríssimos, nestas pessoas que já tem o sistema imunológico prejudicado, é possível haver uma mutação que pode fazer com que a vacina induza o desenvolvimento da doença que deveria evitar. Não é um risco que exista com a técnica de mRNA.
Questões técnicas
Uma dificuldade que precisará ser enfrentada para a distribuição em grande escala da vacina da Pfizer é a logística. A tecnologia de RNA depende de armazenamento muito frio para que o composto não se degrade, com temperaturas abaixo de -75 graus Celsius, o que depende de equipamento potente e especializado.
Esse requisito deve dificultar bastante a distribuição da vacina em regiões com pouca infraestrutura, como acontece em boa parte do interior do Brasil.
A empresa diz em entrevista à revista brasileira Veja que tem trabalhado na embalagem da vacina para facilitar a distribuição. A caixa é projetada para manter a temperatura estável por um período de 15 dias; após o prazo, é possível renovar o gelo seco na embalagem por mais 15 dias e repetir o procedimento mais uma vez, garantindo até 45 dias de estabilidade. A empresa também diz que o composto consegue se manter por até 5 dias em condições normais de refrigeração.
Já a Moderna, outra companhia que está liderando os esforços de vacinas com mRNA diz que o seu composto pode manter a estabilidade com temperaturas de -20 graus. É menos complicado, mas também não é simples.
Arma poderosa contra outras pandemias
Se a vacina de mRNA se provar tão eficaz quanto a análise preliminar da Pfizer índica, será uma boa notícia não só para o combate à Covid-19, mas também para outras pandemias que podem ocorrer no futuro. Isso porque seu desenvolvimento tem potencial para ser mais rápido, permitindo uma resposta mais ágil contra a ameaça.
Primeiro, porque essas vacinas são relativamente simples de serem produzidas, encurtando o período de ensaios pré-clínicos, antes dos testes com humanos, permitindo selecionar múltiplas cadeias de mRNA e testar rapidamente se elas produzem o resultado que se espera.
Robin Shattock, pesquisador do Imperial College, explica à Wired que, quando o coronavírus apareceu, após a publicação do sequenciamento genético do vírus, sua equipe se comprometeu a experimentar a tecnologia de mRNA e ele define o processo como “plug-and-play”. Os pesquisadores já trabalhavam com a plataforma para pesquisar outras vacinas, como Ebola e HIV. Quando decidiram atacar o Sars-Cov-2, bastou trocar as informações genéticas do vírus do Ebola para as do coronavírus. O mesmo aconteceu com a Moderna, uma companhia que pegou o mundo de surpresa no início do ano pela agilidade com que seus testes pré-clínicos avançaram para os testes com humanos.
Também é mais fácil de escalar sua produção, já que se trata apenas um produto químico sintético, e não um vírus que precisa ser produzido em ovos ou células. Pensando na urgência da vacina em uma situação como a atual, não é um ponto que pode ser ignorado.
Busca pela vacina
Governos em todo o mundo estão fazendo uma grande aposta de que as primeiras vacinas para COVID-19 poderiam ser feitas com vírus geneticamente modificados. Os vírus projetados, chamados de vetores adenovirais, são projetados para transportar um gene do SARS-CoV-2, o novo coronavírus que causa o COVID-19, para dentro de nossos corpos, onde nossas células irão lê-lo e produzir proteínas de de ligação do coronavírus, as proteínas S (spike protein).
Como acontece com todas as vacinas, a ideia é fazer nosso corpo pensar que foi infectado. Essas proteínas de ligação (proteínas spike) fabricadas pelo nosso próprio corpo treinariam nosso organismo para detectar e destruir qualquer infecção real de SARS-CoV-2 antes que o vírus cause estragos. A técnica está em desenvolvimento há mais de 3 décadas, mas graças ao COVID-19, ela está prestes a ser posta à prova como nunca antes.
Assim que a sequência genética de SARS-CoV-2 foi postada online em janeiro, três grupos começaram a trabalhar independentemente em vacinas de vetor adenoviral para COVID-19: CanSino Biologics, da Universidade de Oxford e Johnson & Johnson. Todas as três equipes estão abarrotadas de veteranos de vacinas e seus programas COVID-19 têm atraído atenção global por sua escala e velocidade.
Muitos cientistas acreditam que uma vacina COVID-19 será necessária para impedir a propagação do coronavírus e acabar com a pandemia, que já ceifou mais de 270.000 vidas até agora. Nos últimos 4 meses, mais de 100 grupos aderiram à corrida para desenvolver as vacinas COVID-19. Seus esforços cobrem um espectro de tecnologias, incluindo vírus convencionais, inativados e novas tecnologias não comprovadas, como vacinas de RNA mensageiro (mRNA).
Em meio a essa corrida, as vacinas de vetor adenoviral têm a distinção de chegar primeiro aos humanos.
A vacina de vetor adenoviral da CanSino foi testada em humanos na China em março. Mais tarde naquele mês, o governo dos EUA prometeu mais de US $ 500 milhões para ajudar a J&J a preparar até 1 bilhão de doses de sua vacina, que não deve entrar em testes clínicos até setembro. A Universidade de Oxford, por sua vez, está adotando a abordagem mais ambiciosa: no final de abril, ela começou um teste de 1.100 pessoas para provar a segurança de sua vacina enquanto procurava sinais de que ela funcionava. Seu objetivo é concluir esse estudo em apenas um mês e, em seguida, iniciar um estudo de Fase III com 5.000 pessoas já em junho. Se for bem-sucedido, o programa de Oxford ultrapassará todas as outras vacinas COVID-19 em desenvolvimento.
“Eles têm o cronograma mais agressivo de qualquer grupo”, diz Thomas G. Evans, diretor científico da Vaccitech, uma empresa fundada em 2016 para comercializar a tecnologia de vetor adenoviral de Oxford. Em abril, a Vaccitech e a grande empresa farmacêutica AstraZeneca anunciaram uma parceria para desenvolver e comercializar a vacina Oxford. “Oxford provavelmente terá os primeiros dados de eficácia do mundo” para uma vacina COVID-19, possivelmente já em agosto, o que significa que a distribuição da vacina pode começar no outono, Evans diz.
Alguns cientistas dizem que as vacinas de vetores adenovirais, e a vacina de Oxford em particular, podem ser a melhor chance da sociedade para um retorno à normalidade. “Pelo que vi por aí, eles são provavelmente a plataforma mais promissora”, diz Hildegund Ertl, que estuda vacinas de vetores adenovirais no Instituto Wistar na Filadélfia.
As vacinas de adenovírus podem estar ganhando destaque em meio à pandemia de coronavírus, mas têm um passado confuso.
Quando os cientistas começaram a criar vetores adenovirais na década de 1980, a maioria trabalhava com um tipo específico de adenovírus chamado Ad5, que infecta humanos de forma ubíqua e causa o resfriado comum. Os pesquisadores retiraram do Ad5 os genes necessários para replicar e inseriram esses genes em linhas celulares geneticamente modificadas. Isso garantiu que os vírus modificados pudessem ser cultivados apenas nessas células especiais do laboratório. Também abriu espaço no genoma do Ad5 para os cientistas costurarem novos genes de sua escolha.
Muitos cientistas esperavam usar o Ad5 para entregar um gene humano que pudesse corrigir mutações genéticas raras - uma abordagem chamada terapia genética. Esses esforços foram interrompidos em 1999, quando um adolescente com uma rara doença genética do fígado morreu após receber uma injeção de uma terapia genética baseada em Ad5, que havia sido projetada no laboratório de James Wilson na Universidade da Pensilvânia.
A grande dose de 38 trilhões de vírus que o paciente recebeu provocou uma inflamação maciça em todo o corpo e deixou seu sistema imunológico acelerado. Depois disso, os cientistas pararam de usar vetores adenovirais para terapia genética, em que a dose precisa ser alta para atingir muitas células do corpo.
Mas os desenvolvedores de vacinas viram a inflamação induzida por adenovírus como um ativo.
“Existe uma expressão por aí que uma terapia gênica fracassada torna uma boa vacina”, diz Luk Vandenberghe, um especialista em vetores virais na Harvard Medical School.
Uma característica atraente é que os efeitos inflamatórios dos adenovírus significam que os desenvolvedores não precisam usar adjuvantes, moléculas adicionadas a vacinas convencionais para direcionar a atenção do sistema imunológico para a proteína viral. Os próprios adenovírus estimulam a inflamação, que é mantida sob controle com a administração de vacinas em doses baixas.
E todas as vacinas genéticas: vacinas de DNA, vacinas de mRNA e vacinas de vetor adenoviral, imitam uma infecção viral natural, forçando nossos corpos a produzir proteínas virais dentro de nossas células. Isso estimula as células T do nosso sistema imunológico a atacar essas células vacinadas e, no processo, elas aprendem a procurar e destruir células infectadas com o vírus real no futuro.
As vacinas tradicionais, feitas de vírus enfraquecidos, inativados ou proteínas virais, estimulam as células B a produzir anticorpos contra o vírus. Esses anticorpos se prendem aos vírus invasores e os impedem de entrar em nossas células, causando a doença.
O problema é que, uma vez que o vírus se infiltra em nossas células, os anticorpos de uma vacina tradicional são inúteis. É nessa fase que as células T precisam se lançar. Os vetores de adenovírus "são as melhores de todas as vacinas na indução de uma resposta de células T", diz Ertl da Wistar.
É por isso que alguns desenvolvedores de vacinas se voltaram para vetores adenovirais no início de 2000 para combater doenças, como AIDS, malária e tuberculose, causadas por patógenos que se escondem nas células. O maior e mais infame esforço foi liderado pela Merck & Co., que desenvolveu uma vacina baseada em Ad5 para o HIV. Dois grandes ensaios clínicos foram interrompidos no início de 2007, quando ficou claro que a vacina não estava funcionando - e, de forma alarmante, pode até ter aumentado o risco de infecções por HIV em um subconjunto de pessoas com imunidade preexistente ao Ad5.
“Isso acabou com os adenovírus pelos próximos 5 anos”, diz Evans, da Vaccitech.
O National Institutes of Health, que financiou parcialmente os testes, convocou uma reunião para decidir se deve prosseguir com os testes de vacinas baseadas em Ad5. Em 2009, decidiu avançar com uma versão modificada de um ensaio planejado de vacina contra o HIV, desde que os participantes não tivessem imunidade preexistente ao Ad5. Os resultados do estudo de 2.500 pessoas mostraram que a vacina era segura, mas ainda não funcionou.
Esse estudo restringiu o entusiasmo pelo Ad5, mas não o eliminou completamente. CanSino, uma empresa chinesa fundada por ex-desenvolvedores de vacinas da Sanofi, desenvolveu uma vacina baseada em Ad5 para Ebola durante o surto de 2014, e um estudo de Fase II mostrou que a vacina induziu uma resposta de anticorpos 4 semanas após a injeção.
Em 2017, a China aprovou a vacina, mas apenas para uso emergencial e estocagem nacional. Isso a tornou a primeira, e ainda a única, vacina de vetor adenoviral aprovada para humanos, com a grande ressalva de que o estudo de Fase II não provou que a vacina preveniu infecções por Ebola. Além disso, os níveis de anticorpos caíram drasticamente em 6 meses após a vacinação. A maioria dos participantes tinha imunidade preexistente ao Ad5, que alguns cientistas acreditam que pode ter reduzido a capacidade da vacina de induzir uma resposta imunológica de longa duração.
A experiência da empresa com o Ebola permitiu que ela adotasse rapidamente uma vacina COVID-19 usando Ad5. Em 16 de março, a CanSino se tornou a primeira empresa a iniciar um ensaio clínico de uma vacina COVID-19. O estudo de segurança de Fase I com 108 pessoas foi concluído, embora os resultados ainda não tenham sido divulgados. Um estudo de Fase II de 500 pessoas está em andamento.
Alguns cientistas lançaram dúvidas sobre as chances de sucesso do CanSino, mas os veteranos da indústria dizem que a imunidade preexistente ao Ad5 pode ser superada com uma dose mais alta da vacina, o que exigirá um monitoramento mais rigoroso dos efeitos colaterais.
“Eles têm mais chance nisso do que ninguém, porque têm uma enorme instalação de fabricação, grande experiência e o apoio financeiro e de mão de obra do governo chinês”, diz Evans. “Se você está descontando o CanSino, está cometendo um grande erro.”
Várias empresas menores também estão desenvolvendo vacinas COVID-19 com base no Ad5. Um deles é o ImmunityBio, que usa vetores Ad5 com deleções adicionais de genes. O CEO Patrick Soon-Shiong diz que a modificação reduz drasticamente as respostas imunológicas tóxicas do corpo ao vírus e até permite que o vetor seja dosado várias vezes. A empresa testou o vetor em cerca de 200 pessoas em vários pequenos ensaios clínicos, principalmente para câncer.
Outras empresas, incluindo Altimmune, Stabilitech BioPharma e Vaxart, acreditam que podem contornar a imunidade preexistente ao Ad5 na corrente sanguínea administrando suas vacinas como sprays nasais ou pílulas em vez de injeções. As formulações experimentais também podem ser mais fáceis de fabricar, armazenar, distribuir e usar.
“Em uma pandemia como essa, não é apenas conveniente, mas quase essencial, ter algo que você possa administrar facilmente”, disse o diretor científico da Altimmune, Scot Roberts. “Você pode até imaginar mandar a vacina pelo correio para alguém.”
ALTERNATIVAS PARA AD5
Mesmo antes do fracasso dos testes de HIV, alguns cientistas acreditavam que a imunidade preexistente ao Ad5 seria um problema, então eles procuraram na natureza por adenovírus menos comuns aos quais menos pessoas teriam sido expostas. A empresa de vacinas Crucell Holland e Dan Barouch, do Beth Israel Deaconess Medical Center e da Harvard Medical School, usaram um dos vírus naturais mais promissores, chamado Ad26, para fazer um novo vetor adenoviral. A J&J, que adquiriu a Crucell em 2011, desenvolveu várias vacinas baseadas em Ad26 para vírus como HIV, vírus sincicial respiratório (RSV), vírus Zika e vírus Ebola.
A J&J desde então administrou milhares de doses de sua vacina experimental contra o Ebola em pessoas na República Democrática do Congo e em Ruanda. A vacina está sendo revisada por reguladores de medicamentos na Europa, o que significa que pode se tornar a primeira vacina de vetor adenoviral comercial comprovada para prevenir uma doença em humanos.
Em janeiro, Barouch começou a trabalhar com a J&J em uma vacina COVID-19 baseada em Ad26. Embora a J&J não vá iniciar os estudos em humanos de sua vacina até o outono, ela tem uma vantagem na capacidade de fabricação. Além de suas próprias instalações de produção, recrutou a Emergent BioSolutions e a Catalent para ajudar a preparar até 1 bilhão de doses da vacina.
Mas a vacina da J&J tem desvantagens potenciais. Os regimes de vacinas de Ebola, HIV e RSV da empresa usam uma injeção de uma vacina baseada em Ad26 mais uma injeção de reforço de uma vacina diferente. Essa combinação torna difícil fazer comparações com sua vacina COVID-19, que usa apenas Ad26. E Barouch descobriu que cerca de metade dos adultos em alguns países da África Subsaariana e do Sudeste Asiático têm imunidade preexistente ao Ad26, o que significa que a vacina pode não funcionar bem para essas pessoas.
Alguns laboratórios têm procurado evitar o problema da imunidade preexistente usando adenovírus que normalmente não infectam humanos, mas infectam nossos parentes mais próximos. No início dos anos 2000, o laboratório de Wilson em Penn começou a caçar adenovírus de chimpanzés, que os pesquisadores isolaram das fezes do animal. Logo depois, o laboratório de Ertl em Wistar começou a colaborar com Wilson para usar os adenovírus de chimpanzé como um novo vetor de vacina.
Outros grupos também adotaram a ideia. “Os chimpanzés são muito protegidos, mas as fezes podem ser facilmente coletadas”, diz Stefano Colloca, que trabalhou em vetores adenovirais no centro de Laboratórios de Pesquisa da Merck em Roma no início dos anos 2000. Posteriormente, ele ajudou a formar uma empresa, a Okairos, que foi desmembrada desse trabalho quando a Merck interrompeu seus programas Ad5 em 2007.
Okairos se concentrou no desenvolvimento de vetores adenovirais de chimpanzés que se assemelhavam muito ao Ad5 humano e logo formou uma colaboração com um centro de vacinas recém-fundado na Universidade de Oxford, chamado Jenner Institut. A equipe de Oxford usou um dos vetores derivados do chimpanzé da Okairos para desenvolver uma vacina contra a malária, que se tornou o primeiro vetor derivado do chimpanzé a ser testado em humanos.
Em 2012, o grupo Oxford desenvolveu seu próprio vetor derivado de chimpanzé, denominado ChAdOx1, (O adenovírus usado pela Universidade de Oxford costuma infectar chimpanzés e tem o nome de ChAdOx1 (acrônimo de Chimpanzee Adenovirus Oxford 1), com base em um adenovírus descoberto nas fezes de chimpanzé.
A equipe de Oxford criou a empresa Vaccitech em 2016 e desenvolveu vacinas experimentais para uma série de doenças, incluindo AIDS, malária, tuberculose e Middle East respiratory syndrome (síndrome respiratória do Oriente Médio), que é causada pelo coronavírus MERS.
Esse adenovírus é modificado (no caso da vacina Oxford/AstraZeneca) e leva para dentro das células humanas material genético do SARS-CoV-2 que produz uma proteína (proteína de ligação) usada pelo coronavírus para se ligar às céluas e invadí-las, provocando a Covid-19. Essa proteína se chama proteína S (de "spike", espícula). Quando o adenovius ChAdOx1 entra no corpo de quem foi vacinado, (ele) induz as células humanas a produzirem somente a proteína S. Por ser um material estranho, a proteína ativa o sistema de defesa, que cria barreiras imunológicas contra essa proteína.
A vacina da Oxford é eficiente?
Estudo publicado na revista científica Lancet indica que a vacina é segura e tem eficácia de 70% para proteger contra a doença pessoas abaixo de 55 anos.
O número supera a eficácia mínima de 50% estabelecida pela Anvisa para dar aprovação a um imunizante contra a Covid-19.
Um artigo publicado em 19 de novembro indicou que a vacina é segura para todas as faixas etárias, inclusive para idosos, e gerou menos reações adversas nos voluntários mais velhos. As reações mais comuns à aplicação da substância foram dor no local da vacinação, febre e dor de cabeça, todas de intensidade leve ou moderada. Nenhuma reação grave relacionada à imunização foi registrada.
Dá para confiar em uma vacina desenvolvida em tão pouco tempo?
Sim. Para serem aplicadas na população, as vacinas precisam passar por testes de segurança, e essa avaliação continua sendo rígida mesmo na pandemia.
Além disso, as tecnologias-base usadas para os imunizantes já estavam em desenvolvimento há muito tempo. A ideia e a técnica por trás da vacina de Oxford e da AstraZeneca já tinham sido descritas em 2012, em artigo na revista Plos One, segundo Ricardo Parolin Schnekenberg, pesquisador da Universidade de Oxford. (B)
Um pequeno estudo de segurança dessa vacina MERS foi realizado em 2018. Os resultados, publicados em abril deste ano (2020), mostraram que a maioria das 24 pessoas no teste ainda tinha células T direcionadas ao vírus MERS, 12 meses após uma única injeção da vacina. Eles também ainda tinham níveis elevados de anticorpos um ano depois. Mas apenas cerca de metade das pessoas que receberam a dose mais alta da vacina tinham anticorpos que neutralizaram o vírus que produz a MERS em experimentos de laboratório.
Esse trabalho com a MERS permitiu à equipe de Oxford avançar rapidamente em uma vacina COVID-19, que essencialmente troca as instruções genéticas pela proteína spike do SARS-CoV-2. Para melhorar o processo de fabricação de sua vacina, a Oxford contou com a ajuda da MilliporeSigma, que fornecerá equipamentos para vários fabricantes contratados que poderiam desenvolver coletivamente dezenas de milhões de doses da vacina.
Em julho, a Okairos, que desde então se transformou em uma empresa agora chamada ReiThera, planeja iniciar um ensaio clínico de sua própria vacina COVID-19, que é baseada em um adenovírus descoberto nas fezes de gorila.
A maior desvantagem das vacinas de vetor adenoviral de grandes macacos pode ser a falta de testes anteriores em humanos. Antes da pandemia de coronavírus, o vetor ChAdOx1 de Oxford foi dado a apenas cerca de 320 pessoas, e o novo vetor derivado de gorila de ReiThera nunca foi testado em humanos. Embora a imunidade preexistente possa limitar a eficácia das vacinas baseadas em Ad5 e Ad26, pelo menos seus desenvolvedores têm uma ideia melhor da segurança de seus vetores.
E embora a maioria dos cientistas de vacinas concorde que as vacinas de vetor adenoviral são ótimas para estimular a imunidade das células T, eles discordam sobre a importância disso para a prevenção de COVID-19. A maioria das pesquisas se concentrou na resposta de anticorpos do sistema imunológico ao vírus. As vacinas de vetores adenovirais podem induzir respostas de anticorpos, mas geralmente não são tão fortes quanto aquelas induzidas por vacinas mais tradicionais.
Os cientistas estarão observando de perto os testes da vacina do vetor adenoviral nos próximos meses para ver como eles se comparam às vacinas de mRNA e DNA para COVID-19. Se os resultados preliminares forem promissores e tudo correr perfeitamente, um número limitado de vacinas pode estar disponível para grupos selecionados, como profissionais de saúde, já no outono. Muitas empresas esperam que um número maior de vacinas esteja disponível ao longo de 2021.
“É possível que muitas dessas modalidades de vacina funcionem ou que nenhuma delas funcione”, diz Vandenberghe de Harvard. “Quase qualquer modalidade não vai marcar todas as caixas, e nem mesmo sabemos quais caixas precisamos verificar. Todas as apostas podem ser necessárias.”
“Almost any modality is not going to check all the boxes, and we don’t even know what boxes we need to check. All bets may be needed.”






0 comentários:
Postar um comentário