Clado AMPHIBIA
Desde o alvorecer da história, os anfíbios fazem parte da cultura humana. Europeus ocidentais construíram fogueiras para cozinhar e aquecer, acrescentando grandes toras conforme necessário. O que ocasionalmente emergia era surpreendente: grandes animais negros (que haviam encontrado abrigo nos troncos) com quatro patas e uma cauda, pretos como azeviche com marcantes manchas amarelas brilhantes. Essas salamandras de fogo eram, de várias maneiras, consideradas produto do próprio fogo ou, como relatou Aristóteles, capazes de extinguir o fogo.
(What occasionally emerged was astounding: large black animals (which had found shelter in the logs) with four legs and a tail, jet black with striking bright yellow spots. These fire salamanders were variously thought to be the product of the fire itself, or, as Aristotle reported, capable of extinguishing fire.)
Diz-se que Plínio, o Velho, (Caio Plínio Segundo 23-79) testou essa ideia, jogando uma salamandra nas chamas, a salamandra morreu! No entanto, a associação desses animais com o fogo persistiu. Plínio perpetuou outras alegações fantásticas, que se espalharam; até mesmo Leonardo da Vinci contribuiu para a lenda, e mitos de diferentes regiões se fundiram. Em algum ponto, o amianto foi alegado como sendo lã das salamandras.
As salamandras receberam grandes poderes; uma única salamandra rio acima era considerada suficiente para matar um exército. O rei Francisco I da França escolheu uma salamandra como seu emblema, um símbolo poderoso, nascido do fogo, cheio de veneno, imune a queimaduras e até mesmo capaz de apagar as chamas.
Francis I coat of arms
Antes do surgimento de grandes cidades e conurbações, as pessoas cresciam rodeadas pela natureza. Salamandras e tritões, sapos e rãs faziam parte da experiência humana normal. Mitos como os que cercam as salamandras de fogo eram comuns. As bruxas de Shakespeare fermentavam com olho de tritão e rabo de rã (Shakespeare’s witches brewed with an
eye of newt and tail of frog.) Quando crianças, criamos girinos e fomos ensinados a estremecer com o aparecimento de uma salamandra tigre em um porão. Em geral, os anfíbios são vistos como benignos e inofensivos, até mesmo úteis como criaturas que devoram insetos nocivos e servem como fonte alternativa de alimento.
Voltando um pouco mais no passado, no antigo Egito era venerada a deusa Heqet na forma de uma rã, e sua imagem era usada como amuleto. Os sapos têm uma conexão mágica com o mundo espiritual dos egípcios. Na mente dos antigos egípcios eram gerados espontaneamente pela lama deixada para trás após as enchentes do rio Nilo. Um hieróglifos na forma de girino também simbolizava o número 100.000. Ele está associado à abundância e ao nascimento. No entanto, o hieróglifo do girino é usado junto com a frase "Ankh Wajet Seneb" sentença que significa “a repetição da vida”, um conceito de renascimento e vida após a morte. No mito de Osíris, Heqet ficou ao lado de seu e soprava vida no rei para que ele pudesse ressuscitar dos mortos. Atuando como a parteira divina em seu renascimento, Heqet permitiu que o Rei voltasse a ser o Rei do Mundo Inferior. Amuletos em forma de sapo foram passados na cerimônia de enterro na esperança de que Heqet ajudasse em seu renascimento na vida após a morte. Assim como Khnum criou o corpo físico, Heqet ajuda as almas a entrarem nele. Assim como o renascimento de um corpo físico, as facas de Heqet são usadas para cortar os cordões de amarração. Quando a morte chega, Heket corta as amarras que a vida coloca na alma e fica de guarda para guiar o corpo para a vida após a morte. O culto de Heqet foi muito ativo durante o início do período dinástico por volta de 3100 a. C., e o nome dela foi tomado como seu pelo príncipe da Segunda Dinastia, Nisu-Heqet.
Para os egípcios, o sapo era um símbolo de vida e fertilidade, uma que milhões deles aparesciam após a inundação anual do Nilo, que trazia fertilidade para as terras que de outra forma seriam áridas, incultiváveis e inóspitas. Consequentemente, na mitologia egípcia, começou a haver uma deusa-rã, que representava a fertilidade, referida pelos egiptólogos como Heqet (também ḥqtyt Heqtit, Heqat, Hekit, Heqet, e mais raramente Hegit, Heget), escrito com o determinante sapo. Heqet, também é considerada a deusa dos partos e da ressurreição, sua aparência anfíbia denuncia seu forte vínculo com a água. A deusa rã é uma das mais antigas de toda a mitologia egípcia, sendo que seus hieróglifos são encontrados em pirâmides por todo o Egito. Ela vinha para ajudar o recém falecido a ascender ao pós-vida. O amuleto milenar, na forma de sapo, simbolizava a deusa Heket, relacionada à vida e a fertilidade. O amuleto de Heket era usado pelos vivos e tambem colocado junto aos mortos, nas múmias e nos túmulos, simbolizando a vida mortal, o renascimento e a ressureição. Esses amuletos na forma de rãs ou sapos eram confeccionados de variados materiais, como ouro, cobre, pedras coloridas, esteatita, lapis-lazuli, terracota e vidro, especialmente nas cores verde ou turquesa.
Os antigos egípcios usavam o sinal da rã para escrever após os nomes dos que morreram. O termo benevolente significava "viva novamente". Uma vez que a rã era um símbolo de renascimento e ressureição dos mortos.
As rãs eram associadas à ressurreição porque, durante seu período de hibernação no inverno, elas param todas as suas atividades e se escondem entre as pedras.
Eles permaneceram imóveis, sem emitir sons, em piscinas ou nas margens de rios até o amanhecer o despertar da primavera. Essas rãs em hibernação não precisavam de nenhum alimento para permanecerem vivas. Parecia como se estivessem mortas. Quando a primavera chega, essas rãs pulam da lama e do limo e voltam a ser ativas novamente. como se voltassem à vida estando mortas.
Dessa forma eles eram vistos como símbolos do nascimento, morte e ressurreição na cultura egípcia antiga.
Heket porta as facas que cortaos laços da alma com a vida
Heket era a esposa de Khnum, o deus da reprodução. Ele moldou a criança e sua alma dentro do útero da esposa, dando-lhe o fôlego da vida e mantendo sua saúde após o nascimento. Heket era a deusa protetora das gestantes, parturientes e das crianças pequenas, e também do desenvolvimento e da transformação, da morte e do renascimento. Podemos vê-la retratada especialmente em pinturas e estátuas em forma humana com a cabeça de um sapo nos locais designados para o parto ou o trabalho com gestantes e bebês.
Os gregos antigos tinham contos sobre essas criaturas tão importantes para a evolução e para o meioambiente. Esopo que viveu no sec. VI a.C. deixou-nos um conto entre tantos outros sobre as rãs. Chama-se Os garotos e as rãs. Essa fábula é mais ou menos assim:
Alguns garotos brincavam às margens de uma lagoa, onde vivia uma família de Rãs. E todos se divertiam atirando pedras na lagoa, de modo que estas saíssem planando sobre a superfície da água, de uma margem à outra. Logo a superfície da lagoa estava repleta de pedras que voavam por todos os lados, e os garotos mal conseguiam se conter de tanta alegria. Mas, para as pobres Rãs dentro da água, a situação era desesperadora, de verdadeiro pavor. Por fim uma delas, a mais velha e corajosa do grupo, colocou a cabeça para fora da água e pediu aos garotos: "Por favor, caras crianças, parem com tão cruel brincadeira... Ainda que isso pareça divertido para vocês, para nós pode significar a morte sumária..."
Moral da História 1: É duas vezes anti-ético e imoral a autossatisfação às custas do infortúnio alheio...
Moral da História 2: Grande crueldade há quando nossa satisfação depende da insatisfação dos outros...
Na América do Sul o povo Mochica notabilizou-se pela sua cerâmica realista e funcional, eles confeccionava podes, vasos e cantis de argila (terracota) no formato de rãs e sapos, todavia, apesar da representação extremamente realistas não sabemos nada sobre o seu significado.
No sul do Brasil a Teiniaguá, uma princesa moura transformada em salamandra, veio na forma de uma velha da Espanha para o sul do Brasil. (Leia no final desta página do Blog um resumo dessa lenda do nosso estado).
Bandeira e brasão do Município de Quaraí.
(Fonte: Quaraí)
Portanto, foi um choque para a maioria dos biólogos e para o público em geral na década de 1980 saber que os anfíbios em todo o mundo estivam em declínio e correm grande risco de extinção como táxon do que qualquer outro grupo de vertebrados do planeta. Um estudo de todas as espécies de anfíbios conhecidas em 2004 mostrou que cerca de 40% estavam em alto risco de extinção e, em 2008, o declínio dos anfíbios foi visto como evidência de uma sexta extinção em massa iminente. (Bibliografia: Wake, D.B. & Koo, M.S., Current Bio. Mag., 2018) e (Simon, Matt, 08.27.14), .
Ordem Anura
(sapos, pererecas e rãs)
Ordem Anura
(sapos, pererecas e rãs)
Lithobates pipiens (Schreber, 1872)
Lithobates pipiens (Schreber, 1782)
Northern leopard frog
Lithobates pipiens (Schreber, 1782)
Espécie: Rana pipiens
Classe: Amphibia
Subclasse: Lissamphibia
Superordem: Salientia ou Urodela
Ordem: Diplasiocoela
Família: Ranidae
Nome popular: Rã comum
Características
As rãs são animais aquáticos de pele fina e úmida, patas fortes e dedos longos. Em geral, alimentam se de caramujos, lesmas e insetos. As rãs comuns não possuem muitos meios de defesa e são presas fáceis de peixes carnívoros, aves pernaltas e cobras. A reprodução começa no fim do inverno, logo após a ibernação em regiões frias. A fêmea põe de 3.000 a 6.000 ovos as vezes mais.
Atualmente são criadas pelo homem por apresentarem uma carne muito saborosa. Rãs tem um amplo espectro de habitats, sendo encontradas em lagoas permanentes, pântanos, pântanos, riachos lentos em toda a floresta ou bosques, áreas abertas e urbanas. Normalmente habitam corpos d'água com abundante vegetação aquática. No verão, eles geralmente abandonam os lagos e se mudam para áreas gramadas e campos com vegetação baixa. Eles são bem adaptados ao frio e podem ser encontrados acima de 3.000 m de altura nas montanhas.
Produz ribonucleases específicas nos seus ovócitos. Essas enzimas tem sido estudadas pela potencial aplicação no tratamento de câncer. Uma dessas moléculas chamada ranpirnase (onconase) está sendo testada clinicamente como tratamento de tumores do mesotelioma e de pulmão. Uma outra, amphinase foi recentemente descrita como um potencial tratamento para tumores cerebrais.
Bufo spp
Bufo spp
Espécie: Bufo spp
Classe: Amphibia
Subclasse: Lissanfibia
Superordem: Salienta
Ordem: Procoela
Família: Bufonidae
Habitat: Matas tropicais
Hábitos: noturnos
Nome popular: Sapo cururu
Características
O sapo cururu é o mais comum anfíbio da fauna brasileira.
Possui duas glândulas de veneno (glândulas paratóides) na parte posterior da cabeça que, quando acionadas, espirram um líquido de odor desagradável. O predador que ingerir esse veneno, certamente morrerá, pois é altamente tóxico.
Os machos são menores que as fêmeas. Medem cerca de 140 mm enquanto as fêmeas medem 170 mm. O período de reprodução é no início da primavera. Os ovos são postos em fileiras que podem alcançar até 5 m de comprimento. Os girinos nascem dez dias depois, e passam por uma série de mudanças, a metamorfose, ao longo do seu desenvolvimento até se transformar em sapinhos.
Alimentam-se de insetos, camundongos, cobras e caracóis.
Para a reprodução a fêmea do sapo cururu, necessita do macho não só para a fecundação dos seus óvulos (com o esperma que este produz) mas também do abraço do macho, sem esse abraço os óvulos não são expulsos do ovário, o que pode levar uma patologia chamada pelos veterinários de "distocia" que é a difuculadade de expulsar os óvulos (dos ovários) para que sejam fecundados. Veja essa reportagem:
(Em humanos, na hora do parto o bebê pode não conseguir sair (deixar o útero materno) por uma obstrução física do canal do parto, condição também conhecida como "parto distócico"). No caso dos anfíbios são os ovulos que não saem do sistema reprodutor.
Ordem Caudadata
(salamandras e tritões)
Ordem Caudadata
(salamandras e tritões)
Ordem Caudadata
(salamandras e tritões)
Salamandra de fogo
Ordem Caudadata
(salamandras e tritões)
Esppécie: Salamandra salamandra terrestris
Classe: Amphibia
Subclasse: Lissamphibia
Ordem: Caudata
Família: Salamandridae
Habitat: Regiões arborizadas
Hábitos: Noturnos
Nome popular: Salamandra de fogo
Características
As lavas são aquáticas e se tornam terrestres quando adultas. Sua pele tem coloração preta e amarela. Medem entre 140 e 200 milímetros.
Possui glândulas excretoras na parte de trás da cabeça e seu veneno é altamente tóxico. A reprodução ocorre na primavera. Os ovos se desenvolvem no órgão genital da fêmea e nascem dentro d’água. Na fase adulta, as salamandras perdem a capacidade de viver dentro da água. Existem várias subespécies de salamandras que diferem entre si pelas cores e tamanhos. Vivem principalmente na Europa e norte da África.
Ordem Caudadata
(salamandras e tritões)
Família Sirenidae
Os sirenídeos (família Sirenidae) constituem uma família de anfíbios pertencentes à ordem Caudata. São salamandras aquáticas que possuem pequenas extremidades anteriores, não possuindo extremidades posteriores. Possuem brânquias externas durante a vida toda. A sua distribuição está limitada à América do Norte.
Tritão
Espécie: Triturus alpestris
Classe: Amphibia
Subclasse: Lissamphibia
Ordem: Caudata
Subordem: Salamandroida
Família: Salamandridae
Nome popular: Tritão
Características
O Tritão tem a pele lisa e coberta por um muco venenoso que, além de proteger contra predadores, mantém sua umidade. Medem entre 8 e 14 centímetros.
As larvas são vegetarianas e conforme seu crescimento se torna carnívora. Na fase adulta se alimentam de insetos, vermes, crustáceos e moluscos.
A reprodução acontece na primavera. Nessa fase, o macho desenvolvem membranas natatórias nos pés e uma espécie de crista no dorso, que somem assim que termina a fase do acasalamento. podem viver até 18 anos.
Proteu
Espécie: Proteus anguineus
Classe: Amphibia
Subclasse: Lissamphibia
Ordem: Caudata
Família: Poteidae
Nome popular: Proteu
Características
Tem o corpo alongado e possui duas brânquias vermelhas que parecem penas.
Mede entre 20 e 30 centímetros. Possui dois minúsculos olhos quando nascem que, depois de três meses penetram na pele e desaparecem.
O proteu é um anfíbio subterrâneo e parente próximo da Salamandra.
A reprodução é semelhante a da salamandra, mas não há acasalamento.
O macho produz um "saco de esperma" ou espermatóforo, que é colhido pela fêmea. Os ovos são fecundados a medida que são postos. Passa toda sua vida como larva. Alimentam-se de camarões de água doce e resíduo de animais.
Ordem Gymnophiona
(cecilias ou cobras cegas)
Ordem Gymnophiona
(nova família de vertebrado descoberta em 2012)
Uma cecília ou cobra-cega, Siphonops annulatus.
Imagem: Carlos Jared, Instituto Butantan
VÍDEO IMPERDÍVEL
https://youtu.be/MuWxyggnQMs
SEGREDOS DAS CECÍLIAS
https://youtu.be/7FljvSPOxxI
Cecílias adultas se alimentando (em cativeiro)
Nascimento de uma Cecíla aquática
https://youtu.be/1lAfOTR9tY4
Aquatic Caecilian birth at the Tenessee Aquarium
https://youtu.be/DMvL4zOLSeM
Caecilians David Atentborough
Para ver em casa:
https://youtu.be/Halbw72p5q8
Amphiuma sp
Caudata
(complemento de DNA 25 vezes maior do que o dos humanos e um pulmão muito ancestral
Três espécies de salamandras
são descobertas na
Amazônia brasileira
B. caldwellae sp. nov.,
B. madeira sp. nov.
e B. tapajonica sp. nov.
Bolitoglossa paraensis (Unterstein, 1930)
Caudata:Plethodontidae (Silva et all, 2014)
As salamandras sul americanas são pequenos anfíbios, que podem medir de 3 a 12 centímetros de comprimento, respiram pela pele devido a ausência de pulmões e vivem geralmente em ambientes úmidos, na vegetação baixa, onde se alimentam de pequenos invertebrados, como cupins, formigas, besouros e insetos em geral. Seus predadores são serpentes, gaviões e gambás. No Brasil só ocorrem na região amazônica. As salamandras vieram da América do Norte há aproximadamente 23 milhões de anos. “Partindo de lá, passaram pelo istmo do Panamá e seguiram pelos Andes até a foz do Rio Amazonas, onde, em função do isolamento na floresta tropical, deu origem a novas espécies”. (Oliveira et all., 2013). Havendo possivelmente cinco especies registrada para o Brasil.
Bolitoglossa paraensis (Unterstein, 1930)
(Fonte Bioorbis)
Bolitoglossa paraensis (Unterstein, 1930)
(Fonte Bioorbis)
Bolitoglossa paraensis (Unterstein, 1930)
(Fonte Info-Escola)
Bolitoglossa altamazonica (Cope, 1874)
Bolitoglossa tapajonica
(Fonte: Selvino Neckel de Oliveira)
https://youtu.be/a8Weyl6LDH8
Bolitoglossa paraensis
"Recém nascidas" para a ciência e ja ameaçadas de extinção pela ganância do homem e pela irracionalidade dos gestores públicos, essas especies de salamandras necessitam de toda a ajuda que puderem ter. Como pudemos ver são animais penquenos que necessitam da floresta e do clima criado pela floresta para sobreviver e evoluir.
Distribution map of Bolitoglossa paraensis and Bolitoglossa tapajonica sp. nov. Type-localities: B. paraensis (Santa Isabel do Pará, black cross), B. tapajonica sp. nov. (Juruti, black triangle). Other localities: B. paraensis (open crosses: 1 Primavera, 2 Bragança, 3 Ilha de Mosqueiro, 4 Santa Bárbara do Pará, 5 Benevides, 6 Belém, 7 Ourém, 8 Barcarena, 9 Mojú, 10 Tailândia); B. tapajonica sp. nov. (open triangles: 11 Juruti localities, 12 Vitória do Xingú, 13 Itaituba localities. Specimen from Serra do Tumucumaque, Amapá indicated with asterisk. Specimens from Canindé, Pará indicated with circle with cross inside.
(ISABELA CARVALHO BRCKO, MARINUS STEVEN HOOGMOED & SELVINO NECKEL-OLIVEIRA (2013) Taxonomy and distribution of the salamander genus Bolitoglossa Duméril, Bibron & Duméril, 1854 (Amphibia, Caudata, Plethodontidae) in Brazilian Amazonia. Zootaxa, 3686 (4), 401–431.). (Ver também: o gênero Bolitoglossa no Mexico; e na Cordilhera oriental dos Andes colombianos)
Anfíbio, (classe Amphibia), é qualquer membro do grupo de animais cordados, craniados, gnatostomados, vertebrados caracterizado por sua capacidade de explorar habitats aquáticos e terrestres. Esses animais apresentam uma estratégia de vida dupla: parte da vida é passada na água e outra parte na terra em locais úmidos. Algumas espécies são habitantes permanentes da terra, enquanto outras espécies têm um modo de existência completamente aquático.
Amphibia. A palavra anfíbio, deriva do grego anfíbios, que significa “viver uma vida dupla”, (do grego antigo αμφι, amphi, anfi: ambos e βιο, bio vida,) e significa: ambas vidas (vida dupla), ou vida em ambos meios (água e terra).
Seu design corporal reflete essa estratégia de uma vida dupla, embora algumas espécies sejam habitantes permanentes da terra, enquanto outras espécies têm um modo de existência completamente aquático.
Lissamphibia integra todos os anfíbios viventes
Do grego antigo λισσός (lissós, “liso”) + ἀμφίβια (amphíbia), plural nominativo neutro de ἀμφίβιος (amphíbios, “dois tipos de vida”), de: ἀμφί, amphí, “de dois tipos”) + βίος (bíos, “vida”).
Esta subclasse inclui as salamandras (mais de 500 espécies), rãs, sapos e pererecas (cerca de 4.800 espécies) e cobras-cegas ou cecílias (aproximadamente 165 espécies).
O grupo esta limitado à água doce, sendo predominante em regiões tropicais de clima úmido. Os adultos de todas as espécies de anfíbios Vertebrados 183 são carnívoros e, relativamente poucas, especializações morfológicas estão associadas com hábitos alimentares diferentes dentro de cada grupo.
No passado outras subclasses existiram, todavia, hoje todas estão extintas.
Subclasse Labyrinthodontia
Subclasse Lepospondyli
Subclasse Lissamphibia
Características das salamandras
Sinapomorfias do Clado Amphibia
(Lissamphibia - Amphibia atuais)
Pele úmida, glandular e permeável
Tegumento dos anfíbios
O tegumento dos anfíbios é responsável pela umidade da pele, que facilita as trocas gasosas, auxilia na termorregulação (ectotérmicos), as glândulas mucosas lubrificam a pele para facilitar a natação e para que o gás oxigênio se difunda pela pele e chegue aos capilares sanguíneos. Além disso, as glândulas granulosas produzem veneno que atuam contra predadores e contra parasitas que tentam se fixar na pele.
As glândulas granulosas (de veneno) atuam na defesa química que caracteriza os anfíbios, secretando uma grande diversidade de compostos. A presença de secreções de alta toxicidade está frequentemente associada a padrões de colorido chamativos, ditos apossemáticos, reconhecidos e evitado por predadores. O colorido de espécies apossemáticas pode estar presente também em certas espécies indefesas, que assim adquirem proteção, um fenômeno designado mimetismo batesiano. Por outro lado, um conjunto de espécies tóxicas pode apresentar colorido semelhante, caracterizando o chamado mimetismo mulleriano. Dentre os anfíbios, muitos casos de mimetismo envolvem rãs tóxicas e apossemáticas da família Dendrobatidae.(Prates e Jared, 2010).
Dentição pedicelada
Dentes constituídos por uma coroa e uma base de dentina, entre as quais se situa uma área estreita sem dentina ou tecido conectivo fibroso;
Em espécies não mamíferas estudadas até agora, o desenvolvimento de um dente de primeira geração termina com a ancoragem do dente base (o pedicelo ou osso de fixação) a um suporte ósseo (pré-maxilares, maxilares, dentários, vômers, palatinos, ossos faríngeos, etc.). No entanto, a matriz óssea do suporte não está presente quando o dente é iniciado (Sire et al., 2002). A osteogênese e a odontogênese progridem aproximadamente simultaneamente. Isso é conseguido de forma que, na região dentígera, tanto o osso quanto a matriz dentária parecem convergir um para o outro. Eventualmente, ambas as matrizes (superfície óssea e base do pedicelo) fundem-se, formando a chamada fixação do dente decíduo (versus fixação secundária do dente, que ocorre quando o suporte ósseo já está presente quando o dente se fixa). Esse processo sugere a existência de coordenação entre os odontoblastos na base do pedicelo e os osteoblastos na superfície óssea voltado para o dente em desenvolvimento (mediado por moléculas de sinalização?)
Cecilianos possuem numerosos dentes pedicelados na parte inferior e superior da mandíbula que geralmente são dispostas em duas fileiras. o
dentição é geralmente homodonte, mas existem exceções, para
exemplo em fetos (Wake, 1980) e em adultos de alguns
espécies que têm diferentes graus de bicuspidalidade na
mandíbula superior e dentes monocúspides na mandíbula inferior (por exemplo
Gegeneophis ramaswamii Taylor, 1964 (Greven, 1984).
Dentes pedicelados de Cecílias
(Amphibia:Gymnophiona)
Dentes de Gymnophiona
(Fonte Wired)
Os dentes pedicelados são a morfologia dentária hoje exclusiva dos anfíbios modernos, mas também observada em uma variedade de labirintodontes extintos. Os dentes pedicelados consistem em uma coroa e uma base (ambas compostas de dentina) separadas por uma camada de dentina não calcificada.
Tipo de dente dos anfíbios
Dente pedicelado (note o pedicelo com um dente novo se formando)
Exemplos de dentes pedicelados de Lissanfíbios
Examples of tooth morphology in lissamphibians. (A, B, C) Tooth shape throughout ontogeny in the caudate, Pleurodeles waltl. (A) First-generation tooth in a larva, stage 44. The tooth is monocuspid and the dividing zone is lacking. (B) Third- (left) and fourth- (right) generation tooth in a five-month-old, postmetamorphosed specimen. The teeth are bicuspid and the dividing zone is visible. (C) Detail of the tooth tip in an adult showing the two cusps. The main cusp is lingually oriented. (D, E, F) Teeth in Gymniophona. (D) Typical tooth morphology in an embryo of Geotrypetes seraphini (left) and in a foetus of Nectocaecilia petersi (right). (E) Adult tooth in Hypogeophis rostratus. (F) Adult tooth in Geotrypetes seraphini. (G) Adult tooth in the anuran Bombina bombina (Linnaeus, 1761). D modified from Parker & Dunn (1964); E, F from Wake & Wurst (1979): G from Clemen & Greven (1980). Scale bars: A, B, D-G ¼ 100 mm; C ¼ 10 mm. (Davit-Béal et all, 2007. Biological Reviews 82 (2007) 49–81)
(Para uma discussão mais aprofundada sobre dentes veja: Amphibiam teeth: current knowledge...2007)
Papilla amphibiorum
Área sensorial localizada no ouvido, sensível a frequências abaixo de 1.000 hertz (ciclos por segundo).
Papila amphibiorum
Ouvido dos anfíbios
Ouvido
Os ouvidos dos anfíbios existentes são notavelmente diversificados e quando taxa fósseis são considerados, o quadro se torna ainda mais complicado. Os anuros têm estribo diferenciado dentro de uma cavidade do ouvido médio associado a uma tuba auditiva e tímpano. Em vez disso, salamandras e cecilianos têm estribo rudimentar conectado à bochecha ou articulação da mandíbula e não têm o tímpano e a cavidade do ouvido médio. Ao mesmo tempo, os batráquios (salamandras e rãs) compartilham um segundo ossículo da orelha, o opérculo de batráquio, enquanto todos os lissamfíbios têm um segundo receptor no ouvido interno, a papila anfíbia "papilla amphibiorum". O maior clado fóssil e provável grupo ancestral (stem group) de Lissamphibia, os temnospondylis, tinham um estribo semelhante ao dos anuros, consistente na posse de um processo ventral e uma haste distal alongada e delgada que provavelmente se ligava a um tímpano. A sequência evolutiva dos tipos de orelha forma um quebra-cabeça com vários dos grupos principais, cada um compartilhando características que os outros não têm. A condição primitiva é exemplificada pela orelha temnospondilis, especialmente a dos dissorofóides. (Argumentamos que a perda do sistema timpânico foi uma opção evolutiva disponível apenas após a evolução do opérculo batráquio) (Amphibia: A Case of Diversity and Convergence in the Auditory Region, Scoch and Anderson, 2016).
Crânio revisado da salamandra gigante chinesa Andrias japonicas.
Informações de estudos recentes de Necturus.
Revised skull of , the giant Chinese salamander. This was informed by recent studies of the mudpuppy, Necturus.
Bastonetes verdes
Tipo especial de célula da retina presentes em Urodela e Anura e provavelmente perdia em Gymnophiona.
Bastonetes verdes na retina (green rods in the retina)
Glândulas Paratóides
Glândulas exócrinas produtoras de veneno na pele (região dorsal)
Complexo opérculo-columela: dois ossos envolvidos na transmissão de sons para o ouvido interno; especula-se que esteja envolvido na transmissão do som da água para o ouvido e vibrações do solo para o ouvido e desde para a ára do cérebro que interpretará esses impulsos eletricos.
Quando comparamos as três linhagens da classe Amphibia que vivem atulamente notamos que apresentam uma forma corporal bastante diversa. Todavia, mesmo com essa grande diferença corporal pertencem a um grupo monofilético, formando um clado.
Características anatômicas que suportam a monofilia dos anfíbios
A pele úmida dos anfíbios é fundamental para muitos aspectos da vida desses animais. A evaporação de água pela pele (fina) limita a atividade da maioria dos anfíbios a microambientes relativamente úmidos e a noite. A pele contém glândulas que produzem substâncias usadas durante os comportamentos reprodutivos, bem como outros tipos de glândulas, que produzem substâncias extremamente tóxicas.
Estudos de restos fósseis sugerem que o grupo teria evoluído a partir de um ramo dos peixes de nadadeiras lobadas (Sarcopterygii) e servido de ancestral para os répteis, além de ser o primeiro grupo vertebrado a ocupar o ambiente terrestre. Em relação aos peixes, os anfíbios possuem maior independência da água, contudo ainda não representam seres verdadeiramente terrestres, tendo a necessidade de viver em locais úmidos mesmo quando adultos.
Os anfíbios caracterizam-se por possuir quatro membros locomotores, evoluídos a partir de nadadeiras peitorais e pélvicas dos peixes (perdidos secundariamente nas cecílias).
A pele é glandular (glândulas exócrinas), a respiração branquial, pulmonar, bucofaringeana e cutânea (através da pele).
O coração possui três câmaras (dois átrios e um ventrículo).
A fecundação pode ser interna ou externa; os ovos são desprovidos de casca e recobertos com uma série de camadas gelatinosas. Nesta fase, excretam amônia. A circulação nos anfíbios é fechada, dupla (há o circuito corpóreo e o circuito pulmonar) e incompleta (já que há mistura do sangue venoso e arterial no coração).
O seu sistema excretor apresenta rins mesonéfricos que são ligados por ureteres à bexiga, que por sua vez está ligada à cloaca.
Com relação aos órgãos dos sentidos, apresentam boa visão, com exceção das cobrascegas, e tato em toda superfície corporal. O seu sistema olfativo apresenta narinas e os órgãos de Jacobson, no teto da cavidade nasal. Em sua língua se encontram botões gustativos.
Na fase larval, a maioria das espécies de anfíbios vive exclusivamente em ambiente aquático dulcícola, possui cauda e realiza respiração branquial. Esta fase se completa com a metamorfose do anfíbio, que lhe permitirá sair do ambiente aquático e fazer parte do ambiente terrestre. Na fase adulta, a dependência da água é superada parcialmente e os animais podem deixar a água e viver em ambiente terrestre. Apesar de pulmonados, os anfíbios realizam a respiração cutânea como complemento à respiração pulmonar. Para tanto possuem a pele bastante vascularizada e úmida. Nesta fase, os anfíbios excretam ureia.
Os anfíbios viventes pertencem a uma de três ordens:
Ordem Anura ou Salientia (rãs, incluindo sapos),
Ordem Caudata ou Urodela (salamandras, incluindo tritões) e
Ordem Gymnophiona ou Apoda (cobras cegas ou cobras de duas cabeças)
As relações de parentesco de cada uma das ordens reconhecidas ainda guarda alguma controversa. Pesquisas recentes apontam como grupos irmãos Caudata e Anura. E os Gymnophiona divergindo ancestralmente.
Todavia Lissamphibia é reconhecido como um grupo monofilético. Quanto à locomoção, os anuros são, em sua maioria, saltadores, as salamandras são cursoriais (caminham) e as cobras-cegas arrastam-se por contrações musculares. Na água são nadadores, sendo que na fase larval utilizam a cauda e quando adultas, rãs utilizam as patas, que possuem membranas interdigitais e as pererecas apresentam discos adesivos nos dedos para subir e fixarem-se em superficies verticais.
Os anfíbios apareceram pela primeira vez há cerca de 370 milhões de anos durante o Missipiano médio, eles foram um dos primeiros grupos a divergir do estoque ancestral de peixes ósseos que teriam dado origem aos tetrápodes durante a evolução de formas estritamente aquáticas para tipos terrestres.
Acredita-se que essas três ordens de anfíbios vivos derivem de uma única radiação de anfíbios antigos e, embora notavelmente diferentes na forma corporal, são muito aparentados entre si.
Rainbow polka dot frog
Rã de floresta úmida
Origem e características gerais dos Amphibia
Triblásticos
Deuterostomados
Celomados, Enterocelomados
Cordados: apresentam notocorda
Craniata: apresentam crânio e esqueleto ósseo
Vertebrados: durante a fase de neurulação, a mesoderme pode ser subdividida em quatro áreas:
Mesoderme paraxial
Mesoderme axial
Mesoderme intermédiária
Mesoderme lateral
Mesoderme paraxial:
Desenvolve-se ao longo do eixo do embrião, formando os somitos à volta da notocorda e ao tubo neural (durante a fase denominada nêurula). Esses somitos darão origem ao esqueleto axial, músculos e tecidos conetivos do esqueleto central.
Mesoderme axial
Dá origem a notocorda.
Mesoderme intermédiária
Dará origem ao sistema urogenital.
Mesoderme lateral
Divide-se em duas placas: a placa somática (parietal) e a placa esplâncnica (visceral) e, entre as duas, o celoma.
Placa somática: dá origem a ossos, ligamentos, tecido conectivo e vasos sanguíneos dos membros.
Placa esplâncnica: dá origem ao coração, vasos sanguíneos e musculatura lisa dos pulmões e sistema digestório.
Celoma: dá origem às cavidades do corpo (pleural, pericárdica e peritoneal)
Primeiro grupo a iniciar a exploração do ambiente terrestre.
Pele delgada (fina)
Pele lisa, sem escamas, vascularizada e permeável que permite as trocas gasosas, respiração cutânea e a absorção de água (a maioria dos anfíbios geralmente não precisa beber água. A absorção de água pela pele os torna suscetíveis a infecções de pele como a do fungo Batrachochytrium dendrobatidis. Pele esta rica em glândulas mucosas e
Glândulas paratóides: produzem veneno
Glândulas mucosas: mantem a pele umida para facilitar a respiração cutânea.
Ecotérmicos (pescilotérmicos): sua temperatura varia com a temperatura do ambiente.
Enquanto os cecilianos (cobras cegas) têm escamas semelhantes às dos peixes, a maioria dos outros anfíbios tem pele úmida e permeável. Isso obriga a maioria das espécies a viver em habitats úmidos ou aquáticos; caso contrário, eles desidratariam rapidamente conforme a água se perde através da pele. Para colonizar habitats áridos, algumas rãs, sobretudo as rãs macaco ceroso (Phyllomedusa sauvagil), desenvolveram um mecanismo de proteção: um lípido é secretado pelas glândulas da pele, que a rã espalha pelo corpo com as patas.
O lipídio ajuda a retardar a perda de água, essencialmente formando um casulo ao redor do animal. Muitas espécies de anfíbios produzem venenos de glândulas da pele que usam para se proteger de predadores; algumas espécies, como alguns sapos venenosos (Dendrobates sp.), do Brasil possuem venenos potentes o suficiente para matar humanos, e tem sido usados, em pontas de flechas, desde 15 mil anos atrás pelos indígenas para caça.
Relações filogenéticas entre as ordens de anfíbios
Cladograma mostrando as relações filogenética entre anfíbios.
The three orders of amphibians differ greatly in numbers, morphology, and reproductive modes. Generalized phylogeny is shown with the number of species for major clades in parentheses. Amphibians shown include:
(a) Xenopus leavis (Pipidae), a fully aquatic species model organism (photo: B. Gratwicke); (b) Epipedobates tricolor (Dendrobatidae), a toxic species that sequesters toxins from its diet (photo: D. Cannatella); (c) Rana aurora (Ranidae) has a ‘typical’ frog life history with eggs laid in a pond where they hatch and grow as tadpoles until metamorphosis into an adult form (photo: B. Freiermuth);
(d) females of the frog Hemiphractus johnsoni (Hemiphractidae) carry developing eggs on their backs, where they hatch into fully formed miniatures of adults (photo: D. Wake); (e) Ensatina eschscholtzii (Plethodontidae) females guard their eggs, which hatch into fully formed miniatures of adults (photo: H. Greene);
(f) Salamandra salamandra (Salamandridae), the Fire Salamander of European folklore (photo: A. Noellert); (g) Ambystoma andersonii (Ambystomidae), a critically endangered permanently larval form closely related to the model organism A. mexicanum, the Axolotl (photo: L. Fehlandt); (h) Siphonops annulatus (Siphonopidae), a caecilian whose females stay with their eggs until they hatch into miniatures of adults and feed on a lipid secretion produced by the skin of the mother (photo: C. Jared) (Fonte: Wake and Koo, 2018).
As relações filogenéticas entre as três ordens de anfíbios modernos (Caudata, Gymnophiona e Anura) foram estimadas com base em evidências morfológicas e moleculares. A maioria dos estudos morfológicos e paleontológicos de anfíbios vivos e fósseis apóia a hipótese de que salamandras e sapos são linhagens irmãs (a hipótese de Batrachia) e que cecílias são parentes mais distantes. Interpretações anteriores de dados moleculares com base em sequências de rRNA nuclear e mitocondrial sugeriram que salamandras e cecílias são grupos irmãos com a exclusão de rãs. Na tentativa de resolver este aparente conflito, os genomas mitocondriais completos de uma salamandra (Mertensiella luschani) e uma cecília (Typhlonectes natans) foram determinados (16.656 e 17.005 bp, respectivamente) e comparados com sequências publicadas anteriormente de um sapo (Xenopus laevis) e vários outros grupos de vertebrados.
As análises filogenéticas dos dados mitocondriais apoiados com alto valor de bootstrap a monofilia de anfíbios vivos em relação a outros grupos vivos de tetrápodes e uma relação de grupo irmão de salamandras e sapos. A falta de locais filogeneticamente informativos nos conjuntos de dados de rRNA anteriores (devido ao seu tamanho menor e maior variação de taxa entre os locais) provavelmente explica a discrepância entre nossos resultados e aqueles baseados em dados moleculares anteriores. O forte apoio da hipótese de Batrachia de estudos baseados em moléculas e morfologia fornece uma estrutura filogenética robusta que será útil para estudos comparativos entre as três ordens vivas de anfíbios e permitirá uma melhor compreensão do padrão de desenvolvimento vertebral, cerebral e digital consideravelmente divergente encontrados em sapos e salamandras. Os dados apoiam fortemente a hipótese de que Caudata e Anura são grupos irmãos. (Fonte: Zardoya and Meyer, 2001)
Anfíbios geralmente têm uma pele úmida e dependem fortemente da respiração cutânea (através da superfície da pele). Possuem um sistema auditivo com canal duplo, bastonetes verdes em suas retinas para discriminar os matizes e dentes pedicelados (duas partes). Algumas dessas características também podem ter existido em grupos ancestrais extintos.
Majority rule (50%) consensus trees depicting living amphibian relationships. Mitochondrial protein-coding, tRNA, and rRNA gene sequences were combined into a single data set that was subjected to MP (bootstrap values based on 500 bootstrap pseudoreplications; upper value of each triplet of numbers), NJ (bootstrap values based on 500 bootstrap pseudoreplications; middle value of each triplet of numbers), and ML (quartet puzzling support values based on 1,000 puzzling steps; lowest value of each triplet of numbers) analyses. Lobe-finned fishes (lungfish and coelacanth) were used as outgroup taxa.(Fonte: PubMed).
O QUE SÃO ANFÍBIOS
O que são anfíbios? Os anfíbios são tetrápodes (animais de quatro patas) que passam por dois estágios de desenvolvimento durante sua vida: uma fase larval aquática e uma fase adulta que pode permanecer aquática ou se tornar terrestre.
Todos os tetrápodes deveriam ser anfíbios em sua origem. Contudo, reconhecemos hoje a existência de duas grandes linhagens: os Amphibia, atualmente representados pelos Lissamphibia (sapos, salamandras e cecílias), e os Amniota (mamíferos, tartarugas, crocodilianos, aves, lagartos e cobras), derivados dos Anthracosauria (vide Panchen & Smithson, 1988 e Gauthier et al. 1988, dentre outros).
Os primeiros tetrápodes de hábito anfíbio conhecidos datam do Devoniano e são eles Ichthyostega, Acanthostega e formas relacionadas. A separação entre Amphibia e Anthracosauria se dá por outras características dentre a quais a presença de 4 dedos nas mãos em Amphibia, representando uma perda irreversível de um dedo, enquanto Anthracosauria permaneceu com 5 dedos nas mãos, característica mantida também por seus descendentes Amniota.
Os Amphibia são representados por alguns grupos basais (Lepospondyli, Nectridea e Microsauria) e pelo grande grupo dos Temnospondyli. Neste último grupo, a presença de pterigóides trirradiados formando vacuidades interpterigóides separadas por um longo processo cultriforme do paraesfenóide compõe a morfologia palatal que os distingue de qualquer outro animal conhecido (Figura 1).
Fig. 1. Morfologia craniana dos Temnospondyli. Em vermelho o osso pterigóide trirradiado, em azul o processo cultriforme do paraesfenóide e, em preto, a vacuidade interpterigóide entre eles. Modificado de Schoch & Milner (2000).
Abreviações: f, frontal; j, jugal; l, lacrimal; m, maxilar; n, nasal; p, parietal; po, pós-orbital; pp, pós-parietal; prf, pré-frontal; pm, pré-maxilar; ps, paraesfenoide; pt, pterigoide; qj, quadratojugal; sq, esquamosal; t, temporal; v, vômer. Retirado de Carroll, (2009).
Esta característica está presente, ainda que ligeiramente modificada, nos anfíbios modernos denominados Lissamphibia. Devido a tal morfologia dos ossos do palato, vários autores argumentam que os temnospôndilos abrigam os ancestrais diretos dos anfíbios atuais (Milner, 1988; 1990; Trueb & Cloutier, 1991; Bolt, 1991).
Contudo, alguns autores apontam os Lepospondyli como os prováveis ancestrais dos Lissamphibia (Carroll & Curie, 1975; Carroll & Holmes, 1980; Laurin & Reisz, 1997; Laurin, 1998a e Laurin, 1998b). A falta de consenso que existe entre os pesquisadores mostra que, de fato, a origem dos anfíbios atuais é ainda uma questão em aberto.
Tanto Temnospondyli quanto Anthracosauria eram, num passado relativamente recente, classificados dentro da subclasse Labyrinthodontia, devido à presença de dentes labirintodontes, cuja dentina apresenta-se plissada como dobras de um tecido, formando um labirinto (Figura 2).
Figura 2: Dentes labirintodontes. Dentes de Parotosuchus, um mastodonsauróide da África do Sul: (A) cortes transversais; (B) detalhe da base de um dente; (C) dentes palatais do temnospôndilo Australerpeton cosgriffi; (D) desenho mostrando a estrutura da plicidentina em Panderichthys rhombolepis (Choanata) segundo Vorobyeva & Schultze (1991). (A, B) Fotos de Sérgio Dias-da-Silva; (C) Foto de Rafael Costa da Silva. Escala = 1cm.
Labirinto (Λαβύρινθος, Labýrinthos) Símbolo muito antigo e associado
a rituais de inciação e a busca do caminho da felicidade e do verdadeiro eu. Também esa associado ao duro caminho dos fiéis até a beatitude ou até Deus.
Entretanto, este tipo de dente está presente em peixes sarcopterígios, em tetrápodes basais como Ichthyostega, nos Anthracosauria e nos Temnospondyli. Assim, o dente labirintodonte não é um critério distintivo (está presente em formas não relacionadas filogeneticamente).
Todavia, esta não é uma característica distintiva, uma vez que não traduz relações de ancestralidade e parentesco. Dessa forma, o nome Labyrinthodontia acabou sendo abandonado pelos sistematas. Os mais antigos representantes das linhagens que podem ter dado origem aos Amphibia e Amniota são conhecidos do Viseano (Carbonífero Inferior) da Escócia, sendo que os afloramentos fossilíferos dessa localidade (Kirkton Leste) já propiciaram importantes descobertas que forneceram valiosas informações acerca da evolução inicial dos tetrápodes.
Foram coletados nesse local fósseis do mais antigo temnospôndilo conhecido (Milner & Sequeira, 1993), de dois antracossáurios basais (Smithson, 1993 e Clack, 1993), do amniota basal Westlothiana (Smithson et al., 1993) de um lepospôndilo aistópode (Milner, 1993) e de um bafetídeo de posição filogenética incerta (Clack, 1998). Foram ainda catalogados vários invertebrados terrestres. Este conjunto faunístico é considerado, sem dúvida, uma das mais antigas assembléias fósseis terrestres (Clarkson et al., 1993), embora a maioria dessas formas fosse ainda provavelmente um pouco dependentes do ambiente aquático, pelo menos nos estágios iniciais de desenvolvimento.
Somente os Amniota atingiram completa independência do ambiente aquático, através do surgimento do ovo amniótico, também conhecido como ovo cleidóico, ou ovo reptiliano (amniota-alantoidiano). Esse tipo de ovo apresenta três membranas envoltórias embrionárias (o âmnio, córion e alantóide) e uma casca dura que proporciona proteção contra ressecamento, traumas causados por pancadas e predação.
Os mamíferos passaram a carregar os ovos dentro de seu corpo (vivíparos), porém as três membranas embrionárias se mantiveram. Por outro lado, os ovos dos anfíbios atuais (Lissamphibia) não apresentam proteção física especialmente contra ressecamento, e, devido a isso, depositam seus ovos dentro ou próximo a corpos d´água. Após a eclosão dos ovos, passam obrigatoriamente por um estágio larval dependente da água, (para obtenção do alimento de para as trocas gasosas, uma vez que respiram através de brânquias) eventualmente transformando-se em indivíduos adultos através de metamorfose.
Ao contrário dos anfíbios, os Amniota eclodem diretamente como miniaturas de adultos não passando por um estágio larval, sendo que as formas terrestres são independentes do meio aquático nos estágios iniciais de desenvolvimento.
Os anfíbios atuais (Lissamphibia) são representados por três grupos distintos:
(1) os Anura (Salientia), representados pelos sapos, rãs e pererecas;
(2) os Urodela (Caudata), representados pelas salamandras e
(3) os Gymnophiona (Apoda), representados pelas cecílias ou cobras cegas.
O registro fóssil possui uma lacuna surpreendente entre as formas paleozóicas basais de anfíbios postuladas como relacionadas à Lissamphibia (e.g. Temnopondyli e Lepospondyli, sendo este último grupo representado por Nectridea, Aistopoda e Microsauria) e os primeiros Lissamphibia, cujos registros mais antigos datam do Triássico e do Jurássico.
Na verdade existe um registro isolado mais antigo de um protoanuro (Triadobatrachus massinoti, Figura 3 A, B, C) datando do Triássico Inferior de Madagascar, considerado um elo perdido entre os anfíbios basais e os Anura (Estes & Reig, 1973).
Fig 3A
Exemplar fóssil do Triadobatrachus massinoti (Piveteau, 1936).
Fig 3B
Reconstituição artística do Triadobatrachus massinoti (Piveteau, 1936)
Fig 3C
Reconstituição artística do Triadobatrachus massinoti (Piveteau, 1936)
(Fonte: Nobu Tamura (spinops))
Caminhe antes de saltar
Andrés I. Lires, Ignacio M. Soto and Raúl O. Gómez. 2016. Walk Before You Jump: New Insights on Early Frog Locomotion from the Oldest Known Salientian. Paleobiology. 42(4); 612-623. (A, B)
Dentre as salamandras, os mais antigos representantes conhecidos são Karaurus sharovi (Figura 4), do Jurássico Superior do Kazaquistão (Ivachnenko, 1978) e uma larva de salamandra Triassurus sixtelae do Triássico Superior do sul do Kirgistão (Ivachnenko, 1978).
Karaurus sharovi (1)
Fig.4 Late Jurassic Karaurus in situ. About the size of a living salamander.
Karaurus drawing from Carroll 1988, originally from Ivanchenko 1978, photo of same, DGS of same. Colors standard. Some re-identify bones. Hypothetical eyeball added. It does not have to fill the orbit, but it could. The former squamosal is a tabular + supratemporal. The lacrimal and prefrontal are not fused. Postparietals are present. (pterosaurheresies)
Karaurus sharovi Ivachnenko, 1978
(Fonte: Nobu Tamura)
Ambas localidades faziam parte de uma região da antiga União Soviética conhecida como Turquestão. Os primeiros Anura e Urodela já se apresentavam essencialmente semelhantes aos modernos em sua anatomia osteológica (Carroll, 1988).
Os Gymnophiona, não possuem traços nem de membros nem de cinturas, e a maioria dos gêneros possuem crânios de teto espesso devido ao desenvolvimento de hábito de vida fossorial. São bem menos conhecidos e têm seus primeiros registros também datando do Jurássico. Os Lissamphibia atuais são, geralmente, restritos aos trópicos, preferencialmente habitando áreas pantanosas, podendo ser aquáticos, terrestres, arborícolas ou fossoriais. Porém, há exceções a essa regra, tais como, anuros e salamandras habitando tanto regiões semi-áridas e como regiões frias (Dias & Dias-da-Silva, 2000, 2002).
No início do Triássico, os temnospôndilos eram amplamente distribuídos pelo Pangea, o supercontinente que reunia praticamente todas as massas de terra daquela época.
Eles são relativamente freqüentes em sedimentos depositados em ambientes continentais, predominantemente em fácies fluviais e lacustres. Compartilham as seguintes sinapomorfias: presença de vacuidades interpterigóides margeadas por pterigóides trirradiados, separadas por um longo processo cultriforme do paraesfenóide, vômeres achatados e em contato com o processo cultriforme do paraesfenóide (Gardiner, 1983; Milner, 1989, 1990).
A análise das relações de parentesco (filogenia) dos temnospôndilos realizada por Yates & Warren (2000), define Temnospondyli como o grupo que inclui todos os descendentes do ancestral comum de Eryops e Parotosuchus (para uma melhor visualização das relações filogenéticas dos Temnospondyli ver Figura 5). Os Temnospondyli tornaram-se altamente diversificados já no Carbonífero, assumindo várias morfologias distintas e ocupando diferentes nichos ecológicos nos períodos subseqüentes e tendo sobrevivido em abundância até o Triássico, tornando-se mais raros no Jurássico e Cretáceo.
Figura 5: Cladograma indicando as relações de parentesco dos Temnospondyli (retirado de Yates & Warren, 2000).
Ocorrem abundantemente em
sedimentos do Triássico Inferior do
estado do Rio Grande do Sul.
Alguns
temnospôndilos eram tipicamente
terrestres como os norte-americanos
Eryops e Cacops, mas diversos grupos
retornaram ao ambiente aquático,
apresentando adaptações especiais.
Tornaram-se achatados no sentido
dorsoventral e perderam a ossificação
dos punhos, nas mãos e dos tornozelos,
nos pés. Estes elementos tornaram-se
cartilaginosos, um claro indício de que
estes animais não podiam sustentar-se
fora d’água. Outra evidência do
desenvolvimento de hábitos aquáticos é
o aparecimento de formas de focinho
alongado, o que está relacionado ao
hábito piscívoro.
Distribuição geográfica dos registros de
Temnospondyli para o Permiano superior. Há registros para Rússia (1 família),
Níger (1 família e 1 espécie - Saharastega moradiensis ), África do Sul (1 família),
Austrália (1 família), Alemanha (1 família), França (1 família), Tanzânia (1 espécie –
Peltobatrachus pustulatus), Brasil (3 famílias, dois Stereospondylomorpha nãoStereospondyli e Arachana nigra), Índia (1 família) e Malaui (1 família). (Azevedo,2018)
CAMINHE ANTES DE SALTAR
(By Eric Paul Katz, 2016)
If you think about it, frogs are a great example of a very successful complex system, and they function very differently than their non-froggy ancestors. It all has to do with locomotion.
The ancestor of all land vertebrates – including frogs, but also including salamanders and lizards, and birds and us mammals – walked with a gait that we call “lateral undulation”. That’s where the animal walks by bending the body to the left to reach forward, and then bends the body to the right to take a step, and reach forward again, and then repeats the whole cycle. Here’s what it looks like as a series of stick figures:

This is the same gait we see in modern salamanders, newts and lizards. We also see something similar in fish, because the ancestor of the land vertebrates used it for swimming. In fact, modern newts use it for swimming as well; they just fold up their legs, and the lateral undulation makes their tail swish from side-to-side very effectively.
Frogs do not undulate. Their entire pelvis has been re-engineered for jumping and hopping: motions in which both hind legs kick out at the same time and deliver a great deal of force all at once. Some frogs use the same motion for swimming, or have modified this structure further for the demands of burrowing. Some have even loosened it up for a sort of walking, but the general plan of the pelvis is pretty constant. Here are images of a frog skeleton (left) and a salamander skeleton (right),
for comparison:
Frogs have other modifications for this mode of locomotion as well. Their hind legs are especially long, and they have fused many bony elements in their feet and loosened up the joints between other elements, in an effort to make strong but flexible limbs – like the coils of a spring. They have also modified their vertebral column and back substantially. They’ve greatly reduced the number of vertebrae between their arms and their legs and made the whole structure stiffer than it is in salamanders and newts. They’ve lost their ribs. And they’ve fused their tail vertebrae into a single rod, called the urostyle, that sits between the elongated bones of the pelvis and helps to translate forces from the pelvis to the body.
So, how did they put all these pieces together? How did they evolve from lateral undulation to jumping? It turns out that we have a snapshot from the middle of that process, and scientists have been arguing about it for decades. A recent study by Andrés I. Lires, Ignacio M. Soto and Raúl O. Gómez (Paleobiology, April 2016) sought to make sense of this nifty fossil. It’s called Triadobatrachus massinoti (or T. massinoti for short) and it has a fascinating suite of features, half-way between salamander and frog. The following figure shows a fossil of T.
Massinoti from the top and bottom.
T. massinoti has a reduced number of vertebrae, but not as few as a frog has. It has an enlarged pelvis, but not as large as a frog’s either. It also has the beginnings of a urostyle, positioned correctly, but not yet fused into a single bone. Its tail was reduced but not absent. There is little or no doubt about where it belongs on the evolutionary tree: it’s on the branch leading to frogs and toads, but it’s not quite there yet. So did it use lateral undulation, or did it jump? In other words, it has parts of the modern system, but not the whole thing. How did its system function? How did the pieces fit together? How did one function take over from the other?
Lires et al. used a comparative method to address this question. Basically, they looked at known undulators and known jumpers and asked, “Is T. massinoti more like the former or more like the latter?” They focused on measurements of the relative lengths of the parts of the legs and feet, because several previous studies had shown that these measures were useful in predicting the mode of locomotion of several species of frog and toad – e.g. jumping, swimming, hopping, and walking. They collected specimens and X-rays of many extant (still living) species of frogs, toads, salamanders and lizards and made four measurements on each.

The raw data from Lires et al’s study. Fe=femur length, TF=Tibiofibular length, Tar=length of tarsus (in the foot), Hu= humeral length, RU=radioulnar length. All values were standardized against an average length, to remove the effects of the over-all size of the animal.
I can hear some of you asking, “Why lizards?” Good question! Basically, they were trying to avoid a problem: all of their species were amphibians, and they didn’t want that to bias their results. They needed a non-amphibian undulator as a control.
Anyway, they ran a statistical analysis on these leg and foot measurements and found that the combinations of numbers naturally grouped themselves into four modes of locomotion: Jumping, Swimming, Lateral Undulation and a combination of Hopping and Walking. Jumping and hopping are similar: a jump is just a big hop. Toads tend to either walk – one leg at a time – or make short hops, and it’s hard to tell the skeletal structure of hoppers from the skeletal structure of walkers. The upshot is that they had to merge the hopping and walking groups into one Hopper/Walker group, but the other modes were quite distinct.
Then, they performed the same measurements on our friend T. massinoti. Lo and behold, our proto-frog turned out to be closer to the lateral undulators than the other groups! However, it was near the edge of the lateral undulators, just starting, as it were, to reach out toward a new way of moving.
This is a graph of the discriminant analysis that they did. In this kind of statistical analysis, four different variables were sort of “squashed down” to two more significant values, called Root 1 and Root 2. Think of them as summaries of larger groups of data.
So, in terms of the order of assembly of frog locomotion, we now have a piece of the puzzle in place: the intermediate steps of expanded pelvis and reduced vertebrae are not enough to make this animal a jumper. Presumably, its lateral undulation was not inhibited – at least that’s what these data suggest.
Of course, there’s still the entire rest of the puzzle to work out. For example, if it wasn’t jumping, why did it have the expanded ilium? Why did it have a reduced tail and shortened vertebral column?
There are two ways to go about answering these questions. The first is to do a biomechanical analysis of these parts of the body. How much flexion exactly could we expect from the spine? How much force could the legs deliver? But what we really need is the second approach: we need more pieces of the puzzle. More intermediate steps. More fossils. Then we can ask more focused questions: Which happened first: the pelvis expanding or the back getting shorter? What came next? If we could do multiple biomechanical studies on each of the snapshots in the series – always being careful to put them in the right order – we could solve the puzzle. (continua... aqui).
Adaptação para fugir de potenciais prepdaores
Os sapos possuem um par de longos membros posterioes, os quais estão dobrados na forma de Z enquanto o sapo se prepara para saltar. Os três movimentos de salto tem três movientos simultaneos
1) Flexão dos membros anteriores
2) Travamente dos membros posteriores. Os membros posteriores giram para para o plano horizontal e travam.
3) Movimento da cocha. A cocha gira no plano horizontal. (A)
(Fonte: online.anyflip)
O motivo dos sapos pularem muito alto consideramdo tamamho do organismo, é que eles possuem músculos com uma tremenda felxibilidade diferntemente dos mamíferos os quais são rigidos
A história contada pelos fósseis
Os anfíbios surgiram há cerca de 350 milhões de anos, no Devoniano, e foram os primeiros animais vertebrados terrestres. Durante o Carbonífero, foram o grupo dominante. Estudos de fósseis sugerem que o grupo teria evoluído a partir dos peixes pulmonados de nadadeira lobada, tal como o Tiktaalik e servindo de ancestral para os répteis, além de serem os primeiros vertebrados em habitat terrestre.
Em relação aos peixes (seus antecessores) os anfíbios possuem menor dependência da água, contudo ainda não representam seres verdadeiramente terrestres, tendo a necessidade de viver em locais úmidos mesmo quando adultos, já que uma parte do oxigênio que eles usam em seu metabolismo vem da respiração cutânea, e para que a pele possa efetuar as trocas gasosas obrigatoriamente necessita estar úmida, além do que os anfíbios não bebem água, eles a obtém toda água através da pele.
Começando 385 milhões de anos atrás, certos peixes evoluíram lentamente para animais com pernas que vivem na terra.
Os olhos triplicaram em tamanho e foram deslocados dos lados para o topo da cabeça por muito antes que os peixes modificassem (transformassem) suas nadadeiras em membros para a terra. Antes da vida permanente na terra, esses animais provavelmente caçavam como crocodilos, olhando para a presa logo acima da linha d'água, onde a transparência muito maior do ar permitia uma visão de longa distância; assim, aniamis que possuíam olhos maiores que seus ancestrais foram selecionados. A “hipótese Buena Vista” avançada pelo trabalho de MacIver, Schmitz, Muganc, Murphey e Mobleyf (2017), afirma que: ver as oportunidades à distância forneceu uma "zip line" (Tirolesa) "linha reta" informativa para o espólio ou butim de presas invertebradas que estavam vivendo em terra, auxiliando na seleção dos membros, primeiro para breves incursões em terra e, eventualmente, para a vida nesse novo ambiente. (zip-line is a pulley suspended on a cable, usually made of stainless steel, mounted on a slope. It is designed to enable cargo or a person propelled by gravity to travel from the top to the bottom of the inclined cable by holding on to or being attached to the freely moving pulley. It has been described as essentially a Tyrolean traverse that engages gravity to assist its speed of movement.)
Um possivel cenário evolutivo para o surgimento dos anfíbios
lida com "a visão" de presas em potencial na terra, levando a invasão desse ambiente pelos peixes pulmonados com nadadeiras lobadas
como o Tiktaalik sp e o Acanthostega sp.
Várias teorias já foram propostas sobre como e por que os primeiros vertebrados emergiram da água para viver em terra, quase todas enfocando o desenvolvimento dos membros como o principal ponto de inflexão.
Uma das primeiras teorias sugeria que o clima estava mudando e se tornando mais seco, e que os primeiros tetrápodes desenvolveram membros para se moverem de um corpo de água para o outro (MacIver et al.,2017), Proceedings of the National Academy of Sciences.
Outros pesquisadores, incluindo o autor do estudo, o neurocientista Malcolm MacIver, da Northwestern University, há muito suspeitavam que uma visão aprimorada também pode ter desempenhado um papel importante na transição para a vida em terra. Na água, os peixes só conseguem ver uma distância equivalente ao comprimento do seu próprio corpo, o que lhes dá muito pouco tempo para reagir aos predadores e às presas. Entretanto, acima da água, mesmo olhos de peixe típicos podem ver muito mais longe. Simplesmente colocar os olhos acima da água, mantendo-os do mesmo tamanho, aumenta o alcance da visão em 70 vezes. É uma vantagem notável.
Antes do surgimento dos vertebrados terrestres, seus ancestrais habitavam ambientes subaquáticos, onde a visão é altamente comprometida em comparação com a visão acima da água. A diferença visual entre a vida na água e a vida acima dela é comparável a dirigir rápido em uma estrada enevoada, onde nossas respostas devem ser rápidas e simples, versus dirigir em condições de luz de um dia claro, onde a deliberação sobre escolhas mais complexas é possibilitada pelo grande aumento na faixa sensorial. No entanto, embora uma quantidade imensa de trabalhos tenham sido feito sobre o surgimento de membros durante a evolução dos vertebrados terrestres, como a capacidade visual mudou durante a transição da água para a terra não foi explorada. Em parte, essa falta de exploração ocorre porque a ecologia visual computacional, necessária para interpretar os dados do registro fóssil, não foi combinada com a paleontologia dos primeiros tetrápodes. Através da combinação dessas disciplinas, pode-se investigar a história evolutiva da mudança em nossa ecologia visual sensorial da água para o ar.
Surpreendentemente, os resultados mostram que os olhos triplicaram de tamanho pouco antes da evolução da vida em tempo integral na terra. Linhas convergentes de evidência, incluindo o trabalho de MacIver et all (2017), apoiam fortemente a hipótese de que um ecótipo crocodiliano, usando as capacidades visuais grandemente aprimoradas conferidas pela visão através do ar para capturar a abundância de presas de invertebrados inexplorados que longamente precederam os vertebrados na terra, era o portal de acesso da vida subaquática para a vida e em terra firme.
Tendo invadido águas rasas, onde o componente de luz da luz solar é significativo, melhor alcance visual é obtido com as órbitas oculares movidas para o topo do crânio, proporcionando visão para cima como mostrado para Panderichthys. Possivelmente impulsionados por pouco oxigênio, os animais emergiram perto da costa para respirar através dos espiráculos que também haviam dorsalizado logo atrás dos olhos nos elpistostegalianos (Elpistostege sp), como mostrado no esquema para Tiktaalik. (I, II).
https://youtu.be/uyUYKTBA91k
Ancestrais dos tetrápodes
Sem correção para o índice de refração diferente do ar, eles inicialmente enxergavam contornos borrados da fauna de invertebrados que já viviam em terra há (mais de) 50 milhões de anos. Com a contínua exploração do ar para enxergar, e seleção de pequenas mudanças na lente e na córnea para capacitar uma imagem focada de sua presa, em uma pequena fração de tempo, 12 milhões anos, da transição para o tamanho de olho de animais com barbatanas (nadadeiras) para um tetrápode com dedos, o poder total da visão de longo alcance teria surgido.
A descrição recente do Gerobatrachus do "stem batrachian" ancestral batráquio mudou os termos do debate em curso sobre a origem dos anfíbios existentes (Lissamphibia: sapos, salamandras e cecílias).
Este importante fóssil, liga sapos e salamandras a um grupo arcaico de anfíbios fósseis conhecidos como Temnospondylis anfibamidicos, através de um mosaico compartilhado de caracteres únicos derivados de Salientia e urodelos.
(This important fossil, through a shared mosaic of unique derived salientian and urodele characters, links frogs and salamanders with an archaic group of fossil amphibians known as amphibamid temnospondyls).
O presente artigo revisa o impacto deste fóssil nas filogenias morfológicas e moleculares e nas estimativas de tempo de divergência com base em modelos moleculares e no registro fóssil. Em morfologia, os esforços mais recentes têm se concentrado em melhor caracterizar a anatomia e as relações dos temnospondylos anfibamídicos. Progresso também foi feito com a descrição completa da cecília mais antiga Eocaecilia sp; no entanto, a questão das origens das cecílias permanece sem solução no momento. Todas as análises filogenéticas em grande escala concordam com a estrutura filogenética geral da árvore de tetrápodes, e as análises maiores concordam que a origem de pelo menos sapos e salamandras entre os fósseis da família Amphibamidae. Por outro lado, todas as análises de base molecular encontram uma Lissanfíbia monofilética e uma dicotomia terminal Batrachia, o que levanta questões sobre a validade das análises morfológicas que suportam a polifilia lissanfíbia ou sobre a possibilidade de atração de ramos longos dadas as divergências internas curtas e ramos subsequentes longos. Paradoxalmente, a data estimada da divergência lissanfíbia melhor corresponde ao registro fóssil se cronometrada para a divisão entre lepospondyls e temnospondyls. Pesquisas futuras devem se concentrar no desenvolvimento e nos detalhes da anatomia craniana de fósseis e anfíbios existentes para produzir novas evidências e clareza na questão das origens lissanfíbias e especialmente cecilianas (Sigurdsen and Green, 2010; Scoch and Anderson , 2016) (Biotaxa) (A).
A forte derivada do volume visual em relação ao tamanho do olho teria facilitado a seleção observada para olhos maiores. Simultaneamente, as vantagens seletivas de membros com dedos sobre membros com nadadeiras tornaram animais como o Acanthostega mais adequados para incursões mais longas em terra, culminando em formas mais terrestres, como Pederpes, 30 milhões de anos após o Tiktaalik. A parte colorida da árvore simplificada marca uma fase evolutiva com modificações substanciais no plano corporal. Mostrados em verde à esquerda estão os espiráculos (o que se torna a trompa de Eustáquio) provavelmente usados para respirar na superfície da água durante o uso de visão aérea.
O comprimento total dos animais está entre 50 cm e 1,5 m não está desenhado em escala. A idade vai de 385 milhões de anos para Eusthenopteron a 355 milhões de anos para Pederpes.
Resumo
A evolução dos vertebrados terrestres, iniciada há cerca de 385 milhões de anos, é um momento icônico da evolução que traz à mente imagens de peixes se transformando em animais de quatro patas. Essa mudança radical na forma do corpo foi precedida por uma mudança igualmente dramática nas habilidades sensoriais, semelhante à transição da visão de distâncias curtas em uma névoa densa para a visão de longas distâncias em um dia claro. Medições de órbitas oculares e simulações de sua evolução mostram que os olhos quase triplicaram de tamanho pouco antes dos vertebrados começarem a viver na terra. Simulações computacionais da ecologia visual desses animais mostram que, para a visualização de objetos através da água, o aumento no tamanho dos olhos proporcionou um aumento desprezível no desempenho. No entanto, ao visualizar objetos através do ar, o aumento no tamanho dos olhos proporcionou um grande aumento no desempenho. O salto no tamanho dos olhos era, portanto, improvável de ter surgido para ver através da água e, em vez disso, aponta para um híbrido inesperado de ver através do ar, embora ainda habitando principalmente a água. Pesquisas atuais, e várias inovações anatômicas que surgem ao mesmo tempo sugerem semelhanças de estilo de vida com crocodilos. A conseqüente combinação do aumento do tamanho dos olhos e da visão através do ar teria conferido um aumento de 1 milhão de vezes na quantidade de espaço dentro do qual os objetos poderiam ser vistos. A hipótese "buena vista" que nossos dados sugerem é que ver oportunidades de longe desempenhou um papel na evolução subsequente de membros totalmente terrestres, bem como no surgimento de sequências de ação elaboradas por meio de circuitos de planejamento no sistema nervoso.
HIPÓTESES PARA AS RELAÇÕES ENTRE OS ANFIBIOS
Atualmente existem apenas três ordens vivas de Lissanfíbios:
a ordem Salientia ou Anura (que inclui rãs e sapos),
a ordem Caudata ou Urodela (salamandras e salamandras)
e a ordem Gymnophiona ou Apoda (cobras-cegas ou cecilias).
Existem duas hipóteses sobre as relações filogenéticas entre as três ordens. O mais aceito pelas análises dos dados anatômicas e moleculares é que Salientia e Caudata são grupos irmãos dentro do clado Batrachia, e a outra hipótese é que as ordens Caudata e Gymnophiona juntas formam o clado Procera. Esta hipótese não tem muitos apoiadores devido a carência de evidências.

Duas árvores evolutivas hipotéticas de Marcello Ruta e Michael I. Coates (2007), mostrando as hipóteses de Batrachia e Procera sobre as relações entre Salientia (S), Caudata (C) e Gymnophiona (G).
Filogenia dos Temnospondyli considerando prováveis hábitos de vida. A cor dos esqueletos representa os hábitos de vida (azul = aquático; verde = anfíbio; alaranjado = terrestre). Modificado de Schoch (2008). Note que nesta filogenia, Batrachia (Urodela e Anura) está incluído em Temnospondyli, mas não Gymnophiona, resultando em “Lissamphibia” como difilético.
Atualmente existem três grupos de hipóteses sobre a origem dos lissanfíbios
Os temnospondylis,
Os lepospondylis e
As hipóteses do polifileticismo.
Os temnospondylis são os principais candidatos a ancestrais dos lissanfíbios, pois apresentam muitos caracteres em comum, como presença de dentes pedicelados bicúspides e costelas curtas e retas. Os autores que defendem essa teoria argumentam que os lissanfíbios sofreram ao longo de sua evolução um processo de pedomorfose (retenção durante o desenvolvimento dos caracteres juvenis), explicando por que os temnospondylos atingiram tamanhos tão grandes, enquanto os lissanfíbios tendem a ter tamanhos estruturas cranianas menores, mais leves e menos ossificadas.
As hipóteses da origem lepospondyla dos lissanfíbios não recebem o mesmo apoio que as da origem temnospondyli. Mesmo assim, recentemente alguns estudos estatísticos que combinaram dados anatômicos e moleculares deram algum suporte a essas hipóteses.
Todavia, há um terceiro grupo de hipóteses que deve ser considerado, a possibilidade de os lissanfíbios serem um grupo polifilético (com origens diferentes para as três ordens). Segundo uma dessas teorias, as rãs e salamandras (clado Batrachia) teriam sua origem nos temnospondylos, enquanto os cecilianos (ordem Gymnophiona ou Apoda) teriam se originado dos lepospondylos, muitos dos quais já haviam passado por processo de redução de extremidades.
Morfologia craniana dos Temnospondyli. Em vermelho o osso pterigóide trirradiado, em azul o processo cultriforme do paraesfenóide e, em preto, a vacuidade interpterigóide entre eles. Modificado de Schoch & Milner (2000).
Esquema modificado das três diferentes hipóteses sobre a origem dos lissamfíbios; 1. Origem Lepospondylis, 2. Origem temnospondylis,
3. Origem polifilética
SALIENTIA OU ANURA
Com mais de 4.750 espécies, rãs e sapos formam a mais diversa ordem de lissanfíbios. A primeira Salientia conhecida é o Triadobatrachus, que mesmo tendo cauda, já apresenta algumas das características típicas das rãs, como a coluna vertebral com poucas vértebras e as patas traseiras mais longas que as anteriores.
A anatomia dos anuros modernos é única no reino animal. Seu esqueleto parece estar totalmente adaptado para o deslocamento através de saltos (embora existam muitas espécies que se movem cursorialmente).
Anura
Algumas de suas características são
Características dos adultos anuros incluem: nove ou menos vértebras pré-sacrais, a presença de um urostilo formado por vértebras fundidas, ausência de cauda, um ílio longo e inclinado para frente, membros anteriores mais curtos do que membros posteriores, rádio e ulna fundidos, tíbia e fíbula fundidos, ossos do tornozelo alongados, ausência de um osso pré-frontal, presença de uma placa hioide, língua sem suporte esquelético intrínseco, espaços linfáticos subcutâneos, e dois músculos extensores fixados àlente do olho.
Ourtas caracterisitcas:
Tronco curto (menos de 12 vértebras) e rígido, principalmente cintura pélvica longa e vértebras da parte posterior (que em outros anfíbios formam a cauda) se reduzem e se fundem para formar o urostilo.
Membros posteriores longos, com a tíbia e a fíbula fundidas (para ajudar na propulsão) e membros anteriores curtos e fortes, para resistir ao impacto da aterrissagem.
Além disso, de todos os anfíbios atuais, as rãs são as que apresentam os órgãos auditivos e vocais mais desenvolvidos. Os machos costumam ter estruturas especializadas para amplificar o som durante a temporada de acasalamento.
O tamanho dos anuros varia de 3 kg de peso e 35 centímetros de comprimento da rã Golias (Conraua goliath Boulenger, 1906) a 7,7 milímetros de comprimento do recém-descoberto Paedophryne amauensis, da Nova Guiné, o menor vertebrado conhecido hoje.
Adulto da rã Conraua goliath
Girino da rã Golias
Conraua goliath tadpole (Photograph by Steve Atkin)
Por Rittmeyer EN, Allison A, Gründler MC, Thompson DK, Austin CC - Rittmeyer EN et al. (2012). Ecological Guild Evolution and the Discovery of the World's Smallest Vertebrate. PLoS ONE 7. (Fonte: PlosOne; Wikipdia)
Osteology of Mini ature gen. et sp. nov. holotype (ZSM 86/2004).
Ecological Guild Evolution and the Discovery of the World's Smallest Vertebrate
(Para uma discussão em aula sobre tamanho e nicho ecológico)
Maximum likelihood phylogeny of Paedophryne and asterophryine frogs. Colors of branches correspond to maximum male SVL (Paedophryne) or average SVL within each clade on a logarithmic scale (Table 6). Circles above branches correspond to posterior probabilities: black: >0.95; grey: 0.85–0.95; white: 0.5–0.85. Circles below branches correspond to maximum likelihood bootstrap support: black: >95%; grey: 75–95%; white: 50–75%. (Eric N. Rittmeyer,Allen Allison,Michael C. Gründler,Derrick K. Thompson,Christopher C. Austin, 2012, 2019).
Os menores entre os pequenos
URODELA OU CAUDATA
Os urodelos ou caudados são a ordem dos lissamfíbios que mais se assemelham morfologicamente aos anfíbios ancestrais. Este grupo inclui salamandras e tritões (newts), a maioria dos quais tem um corpo alongado, uma cauda bem desenvolvida e quatro pernas relativamente curtas. A maioria dos urodelos são terrestres e estão distribuídos principalmente no hemisfério norte.
Praticamente todas as espécies são fertilizadas internamente e ovíparas. A maioria tem desenvolvimento direto (larvas, metamorfose, adulto) e as larvas frequentemente se assemelham a adultos em miniatura com brânquias externas ramificadas. O fenômeno de neotenia ocorreu em vários grupos de salamandras, nos quais os indivíduos, todos e se desenvolvem sexualmente como adultos, entretanto externamente continuam a ter características larvais.
Atualmente, os urodelos são classificados em três subordens: Sirenoidea, Cryptobranchoidea e Salamandroidea. Serinoides são urodelos com caracteres especializados e primitivos, como a perda dos membros posteriores e a presença de brânquias externas. Os Criptobrancoides são grandes salamandras primitivas (até 160 cm) que apresentam fecundação externa, enquanto as Salamandróides são o grupo mais numeroso de urodelos (com mais de 500 espécies) e o mais diverso, sendo muitas espécies terrestres e apresentando fecundação interna por feixes de espermatozóides chamados espermatóforos.
GYMNOPHIONA OU APODA
O membro mais antigo conhecido da ordem Gymnophiona é o chamado Eocaecilia micropodia, um anfíbio de cerca de 15 cm de comprimento com corpo onsideravelmente longo, cauda curta e pernas muito pequenas.
Os cecilianos de hoje (ordem Gymnophiona ou Apoda) perderam completamente qualquer vestígio de suas pernas, cintura ou cauda devido à sua adaptação a um estilo de vida subterrâneo. Por esta razão, eles também passaram por um processo de endurecimento do crânio e seus olhos estão bastante reduzidos. Eles também têm anéis segmentares por todo o corpo que os fazem assemelharem-se com anelídeos. Atualmente, existem cerca de 200 espécies de cecilianos divididos em 10 famílias. Seu tamanho varia de cerca de 7 cm nas espécies Idiocranium russeli dos Camarões, a 1,5 metros no Caecilia thompsoni da Colômbia. Apresentam distribuição pantropical, fecundação interna e grande variação no desenvolvimento (há espécies vivíparas e ovíparas, com metamorfose e com desenvolvimento direto).
Características dos anfíbios
Os anfíbios, especialmente os anuros, são economicamente úteis na redução do número de insetos que destroem plantações ou transmitem doenças. As rãs são exploradas como alimento, tanto para consumo local como comercialmente para exportação, com milhares de toneladas de cochas produzidas anualmente.
Sabe-se que as secreções cutâneas de vários anuros tropicais têm efeitos alucinógenos e efeitos nos sistemas nervoso central e respiratório em humanos. Descobriu-se que algumas secreções contêm magainina, uma substância que proporciona um efeito antibiótico natural. Outras secreções da pele, especialmente toxinas, têm uso potencial como anestésicos e analgésicos.
Os bioquímicos estão atualmente investigando essas substâncias para uso medicinal.
1) Forma do corpo e membros locomotores.
Os membros das três ordens existentes diferem acentuadamente em sua aparência estrutural.
Rãs e sapos não têm cauda e são um pouco atarracados, com membros posteriores longos e poderosos modificados para saltar.
Em contraste, as cobras-cegas (cecilianos) são sem membros, semelhantes a vermes e altamente adaptados para uma existência escavadora.
Salamandras e tritões têm cauda e dois pares de membros mais ou menos do mesmo tamanho; no entanto, eles são um pouco menos especializados na forma corporal do que as outras duas ordens.
Pele fina glandular
As rãs são viscosas porque sua pele é coberta por uma camada de muco. Esse muco ajuda a pele a reter a umidade, necessária para que o sapo respire e se mantenha hidratado.
No entanto, nem todas as rãs são viscosas. Dependendo de seu habitat, as rãs têm métodos diferentes para manter sua pele macia, úmida e flexível, adequada para as trocas gasosas (respiração cutânea) e para o equilíbrio hídrico.
Por que os sapos precisam de muco
Muco?
O muco é o que faz o sapo parecer úmido, escorregadio ou viscoso. As rãs não bebem água; em vez disso, absorvem toda água de que necessitam através da pele. As rãs, sapos e pererecas, também usam a pele para executar as trocas gasosas, i.e., respirar.
Uma camada de muco na pele ajuda a manter a umidade presa ao lado dela, e essa umidade transfere oxigênio para o corpo dos Anura via uma pele muito vascularizada. Desta forma, o muco da pele de uma rã é extremamente importante para o seu bem-estar e para poder sobreviver no ambiente terrestre.
Quase todas Anura desenvolvem pulmões quando se tornam adultos, mas ainda dependem das trocas gasosas que ocorrem na pele (respiração cutânea) para obter oxigênio, especialmente quando esses animais estão em uma toca subterrânea ou nadando na água.
De onde vem o muco que notamos no corpo dos anura? O muco é excretado na pele através das glândulas da derme. Como sua pele é um meio importante de respiração e hidratação, os anfíbios tendem a ter mais glândulas na pele do que outros vertebrados. As glândulas mais importantes são as glândulas granulares e as glândulas mucosas. As glândulas granulares secretam compostos à base de proteínas.
Em sapos venenosos, o veneno é produzido nas glândulas granulares. As glândulas de muco são muito mais numerosas na pele dos anfíbios do que as glândulas granulares e estão dispersas por toda a derme. Alguns Anura têm glândulas lipídicas especiais que produzem uma substância cerosa que a rã espalha sobre a pele com as patas. Esta camada cerosa evita ainda mais a perda de umidade do corpo para o ambiente.
Quatro sapos do gênero Phyllomedusa têm essas glândulas especiais: P. sauvagii, P. iherengii, P. hypochondrialis e P. boliviana. Eles são sapos hilídeos das regiões semiáridas do sul da América do Sul.
O muco da pele dos anfíbios também contribuí para regulação da temperatura
O muco ajuda os Anura a regularem sua temperatura corporal, bem como a umidade e as trocas gasosas. Nas rãs aquecidas, a secreção de muco está ligada à temperatura corporal, quanto mais quente a rã fica, mais muco ela secreta. Algumas rãs acumulam camadas de muco seco na pele para reter mais umidade, especialmente em ambientes quentes. As rãs do gênero Hyperolius sp são conhecidas por formarem essas camadas de muco.
Casulos de sapo
As rãs trocam sua ultima camada da pele com frequência, às vezes com a frequência diária. Durante a queda, a rã solta a pele se contorcendo e, em seguida, puxa a camada de queda sobre sua cabeça. No entanto, um sapo nem sempre remove a camada extra de pele. Em certos habitats, as espécies constroem várias camadas de muco e eliminam a pele para formar um casulo protetor que retém o calor e a umidade do corpo. O casulo é feito apenas quando o sapo deve hibernar (em locais muito frios onde os Anura hibernam) ou estivar (verão em locais muito quente). É possível que os sapos tenham dezenas de camadas de casulo no topo de sua pele. As rãs no subgênero Cyclorana e gênero Neobatrachus foram encontradas com 50 a 100 camadas de casulo. As rãs em casulo podem prevenir a perda de umidade até 10 vezes melhor do que as rãs com pele exposta.
Rãs de pele seca
Nem todos os sapos, rãs e pererecas são viscosos, i.e., secretam muco. Algumas rãs têm pele áspera, com protuberâncias e seca. A textura irregular e áspera dá à pele mais área da superfície disponível, através da qual a água pode ser absorvida. Geralmente as rãs de pele áspera ou seca vivem em climas áridos ou semiáridos onde a água é escassa e o calor é alto. Essas rãs terrestres não precisam de uma pele superlisa para nadar como as rãs aquáticas, portanto, a pele texturizada funciona bem para elas. Muitas rãs arbóreas e terrestres, como a rã da chuva do deserto (Breviceps macrops), têm essa textura especializada na pele (Hunt, 2020).(Fonte: Namibia).
Também ha evidências convincente de que as glândulas mucosas da pele da rã contribuam
para o transporte de íons transepitelial (Thompson e Mills,
1983; Bjerregaard, 1989) e que a secreção de muco pode desempenhar um papel importante na osmorregulação (Friedmanet al., 1967). Apesar do óbvio interesse no muco das glândulas de pele de rã, muito pouco se sabe sobre o papel da secreção de muco em mecanismos reguladores de íons ou em
qualquer outra função fisiológica. Para alcançar este objetivo, é
importante determinar as características citoquímicas de
diferentes células secretoras dentro das céluas secretoras de muco. Infelizmente, muito pouco se sabe sobre a
análise histoquímica das glândulas mucosas, uma visão também
compartilhado por outros (Mills, 1985).
OS DOIS TIPOS DE GLÂNDULAS
A pele de sapo (Anura; Amphibia) geralmente contém dois tipos de glândulas exócrinas: uma glândula granular ou venenosa (paratóide) encontrada principalmente na pele da região dorsal e glândulas mucosas que são amplamente distribuídas, entretanto são mais abundantes na região ventral (Bovbjerg, 1963).
Embora exista uma certa ambigüidade em relação à estrutura das glândulas mucosas na pele da rã, tornou-se claro que existem vários tipos de células diferentes dentro de um ácino (acinus) contribuindo para a secreção de muco (Mills e Prum, 1984). Variação significativa na morfologia dos grânulos secretores também podem existir em células mucosas em geral (Harrison et al., 1987). Estas diferenças morfológicos entre grânulos secretores podem muito bem relacionarem-se às diferenças bioquímicas e fisiológicas das células secretoras que compreendem as glândulas mucosas.
Nessa consideração, tornou-se cada vez mais evidente que o muco é geralmente uma substância heterogênea derivada de diferentes populações de células e também de diferentes glicoconjugados dentro de uma única célula (Jones e Reid, 1978; Basbaum, 1984). Foi, portanto, de especial interesse para os pesquisadores determinar os detalhes histológicos das glândulas mucosas e fazer uma análise histoquímica dos grânulos secretores nas diferentes células acinares.
Devido aos compostos glicoconjugados serem lavados durante a preparação com parafina (para a análise microscópica), foi feito a investigação em seções semi-finas de tecidos (da pele de rã) embebidos em plástico, um procedimento que preserva o detalhe citológico particularmente bem e também permite análises histoquímicas válidas de macromoléculas. Ao longo do ano, a pele continha uma profusão de glândulas mucosas abaixo da derme. Aparentemente em diferentes estágios de diferenciação. Quanto mais ativa a glândula secretora mais era facilmente reconhecível por sua estrutura.
Foi observado apenas glândulas mucosas, aparentemente em diferentes estágios de desenvolvimento, nas seções ventrais da pele. As glândulas maiores e ativamente secretoras tinham muitas características em comum com as glândulas seromucosas descrito por Mills e Prum (1984) que dividiu as
glândulas mucosas da pele da rã em dois tipos morfológicos: mucosas e seromucosas.
Os grânulos secretores dentro das células individuais consistia em glicoproteínas que foram definidas de acordo com às reações de coloração histoquímica padrão. Coletivamente, os resultados indicaram que a secreção de muco das glândulas é uma substância heterogênea para a qual diferentes os tipos de células contribuem.
As células secretoras das glândulas mucosas continham combinações de glicoproteínas neutras, carboxiladas e às vezes glicoproteínas carboxiladas e sulfatadas.
A maior parte do muco consistia predominantemente em glicoproteínas ácidas secretadas pelas células principais.
Esta descoberta apoia resultados anteriores de Dapson (1970) que identificou mucosubstâncias ácidas nas glândulas mucosas de Rana pipiens.
Distingui-se também grânulos secretores menos fortemente ionizado, ricos em carboxila e grupos sulfatados.
Geralmente, as glicoproteínas ácidas também podem incluir sialomucinas e sulfomucinas.
Há sugestão de que as células principais podem conter glicoproteínas sialiladas (Sialylated glicoproteins) (Els and Henneberg, 1990 Histol Histopath (1990) 5: 343-348 )
VER OS SEGUINTES VÍDEOS
PARA DISCUSSÃO EM AULA
Vídeos da Enciclopédia Britânica (cobras-cegas, salamandras e sapos).
2) Reprodução
Ovo
Os ovos ou ovas de anfíbios e peixes são compostas principalmente de gelatina (que se parece muito com uma geleia rala e incolor). No centro do ovo, existe a membrana vitelina envolve o fluido que que esta ao redor do embrião. A maioria dos anfíbios e peixes põe seus ovos na água para que não correr o risco de secar. Ao contrário dos ovos amnióticos (ovos de répteis, aves e mamíferos), que possuem uma casca que fornecem alguma resistência à ao ressecamento e a desidratação, as camadas de gelatina dos ovos de anfibios secam facilmente.
O oxigênio na água se difunde (move-se ao contrário do gradiente de concentração) através da camada de gel, através da membrana, através do fluido perivitelino e para o embrião (através da pele e / ou brânquias externas).
O dióxido de carbono se move na direção oposta também por difusão. Nenhuma energia é necessária porque a difusão é um processo passivo. Os cílios (estruturas minúsculas) na superfície dos embriões de anfíbios se movem para criar correntes de água dentro do fluido pervitelino e ajudam a acelerar a difusão.
Muitas espécies de anfíbios e peixes colocam seus ovos em massas de gelatina ou espuma. (O quanto isso pode dificultar a passagem de oxigênio suficiente por difusão através da massa de ovos, ainda é desconhecido). Algumas espécies certificam-se de que haja canais de água entre os ovos para o movimento da água (contendo oxigênio). Algas simbióticas (relação mútua benéfica) que produzem oxigênio quando fazem a fotossíntese vivem dentro dos ovos de outras esepcies de anfibios, como a salamandra pintada.
Muitas rãs, como a rã lisa vitoriana (Victorian smooth froglet) (Geocrinia victoriana), deposita seus ovos na terra e os girinos eclodem quando os lagos são formados pelas chuvas de outono (outono). Os gases são trocados exatamente da mesma maneira que na água; no entanto, os ovos correm grande risco de secar (desidratar) e morrer.
Esquema de um ovo de anfíbio
Ovos de anfíbios
Corte e cópula entre dois anuros
Ovos de anfíbios
Girinos
(Fonte: : Photo by Kellee Wolowitz, Seneca Park Zoo)
Fecundação:
Desenvolvimento indireto: Anura (larva: Girino), e Gimnophiona.
Desenvolvimento direto: Urodelos (salamandras e tritões)
O comportamento reprodutivo varia para cada grupo. Entretanto há uma tendência entre os anfíbios quanto ao desenvolvimento. Nota-se que a evolução do desenvolvimento direto, i.e., eliminação do estágio larval, ocorreu em todas as três ordens. O desenvolvimento ocorre totalmente dentro do ovo que é protegido por uma cápsula, e os juvenis eclodem como miniaturas da forma corporal adulta.
A maioria das espécies de salamandras sem pulmões (família Plethodontidae), a maior família de salamandras, algumas (cobras-cegas) cecílias e muitas espécies de anuros têm desenvolvimento direto. Além disso, numerosos cecilianos e algumas espécies de anuros e salamandras dão à luz filhotes vivos (viviparidade).
Entretanto a maioria dos anfíbios necessitam obrigatoriamente de água parada para reprodução, pois as formas jovens apresentam respiração branquial.
Ovos são incolores e muitas vezes são depositados em uma espuma gelatinosa.
As fêmeas deposita os ovos em grupos ou em fileiras dentro d'água e fertilizados pelo macho. As larvas dos anuros em desenvolvimento são essencialmente embriões de vida livre; eles devem encontrar seu próprio alimento, escapar de predadores e realizar outras funções vitais enquanto continuam a se desenvolver. À medida que as larvas completam seu desenvolvimento embrionário, elas adotam um desenho corporal adulto que lhes permite deixar temporariamente o habitat aquático para o terrestre.
Adendum
Uma das principais características dos anfíbios é a capacidade de realizar metamorfose, possibilitando a transição destes organismos de um meio aquático (hábitat das larvas = girinos) para o ambiente terrestre (habitat dos sapos e salamandras).
Representação esquemática do processo de metamorfose em anuros (sapos)
As mudanças morfológicas mais evidentes na transformação do girino para o sapo são o desaparecimento da cauda e das brânquias e surgimento dos membros.
Também ocorre a mudança da posição dos olhos, que são laterais nos girinos, permitindo a visão panorâmica necessária para fugir de predadores, e passam para a frente da cabeça nos sapos adultos, que possibilitam a visão binocular, essencial para comportamentos predatórios.
O início da metamorfose neste grupo se dá pela produção do hormônio tiroxina (T4) pela glândula tireóide do girino. Este hormônio é transformado na forma ativa tri-iodotironina (T3) nos tecidos alvo. As células podem responder ao T3 de 4 formas: crescimento, morte, remodelamento e reespecificação, de acordo com o tipo e a concentração do receptor hormonal presente nas células.
Metamorfose do sapo Bufo bufo
Receptores de hormônio da tireóide e controle da metamorfose
De acordo com pesquisas realizadas em Xenopus laevis (organismo modelo), há dois tipos de receptores de hormônios da tireóide (TR; Thyroid Receptors): TRα e TRβ.
O TRα está amplamente distribuído pelos tecidos mesmo antes da metamorfose. Já o TRβ é produto dos hormônios circulantes que ativam a metamorfose, e aumentam em concentração no decorrer do processo.
Assim como na metamorfose dos insetos, em anfíbios, a ativação dos genes necessários para as transformações ocorre através de fatores de transcrição.
O principal fator de transcrição é o dímero formado por duas proteínas nucleares: o TR (acoplado a T3 ou T4, a depender do tecido) e RXR. Quando os hormônios não estão acoplados aos receptores, o dímero atua como um repressor dos genes essenciais para a metamorfose, mantendo o estágio de girino.
Desnvolvimento dentro dos grandes grupos
METAMORFOSE
Período concentrado de desenvolvimento pós-embrionário que transforma o juvenil em adulto.
Transformação ecológica: juvenil e adulto sempre usam recursos diferentes
Características/Sinapomorfias
A. morte e reabsorção dos tecidos larvais que eram úteis apenas para o juvenil (brânquias, cauda)
B. Crescimento de novo e diferenciação de tecidos que serão cruciais para o adulto (membros)
C. remodelação de diversos tecidos para adquirir novas funções.
“Vantagens”
Aproveitar recursos de diferentes ambientes
Evitar predadores terrestres
“Desvantagens”
Dependência de recursos aquáticos
Contato com predadores aquáticos,
Ausente em MUITOS ANFÍBIOS! (desenvolvimeto direto, neotenia)
1. Amplexo: abraço nupcial (necessário para expulsar os óvulos do óvario da fêmea)
2. Oviparidade: deposição de ovos
3. Viviparidade: ovos retidos no oviduto/útero, nascimento de organismos já formados semelhantes aos pais
4. Pueriparidade: nascimento de juvenis
5. Larviparidade: nascimento de larvas
6. Lecitotrofia: provisão de nutrientes do vitelo
7. Matrotrofia: provisão de nutrientes da mãe
8. Oofagia/adelfofagia: obtenção de nutrientes de óvulos, ovos ou dos irmãos
9. Oviductofagia: obtenção de nutrientes das células do oviduto/útero
10.Desenvolvimento direto: desenvolvimento sem estágio larval
11.Desenvolvimento indireto: desenvolvimento com estágio larval
12. Fitotelmo: Câmara com água na vegetação (bromélias).
Desenvolvimento
Dentro do ovo, o embrião é envolvido por uma série de cápsulas gelatinosas semipermeáveis e suspenso em fluido perivitelino, um fluido que também envolve o vitelo (gema). As larvas em incubação dissolvem essas cápsulas com enzimas secretadas pelas glândulas na ponta do focinho. A massa da gema original do ovo fornece todos os nutrientes necessários para o desenvolvimento; entretanto, vários estágios de desenvolvimento utilizam diferentes nutrientes.
No início do desenvolvimento, as gorduras são a principal fonte de energia. Durante a gastrulação, um estágio inicial de desenvolvimento em que o embrião consiste em duas camadas de células, há uma dependência crescente de carboidratos. Após a gastrulação, ocorre um retorno à utilização da gordura. Durante os estágios posteriores de desenvolvimento, quando as estruturas morfológicas se formam, as proteínas são a principal fonte de energia. No estágio de nêurula, um estágio embrionário em que o tecido nervoso se desenvolve, os cílios aparecem no embrião e o movimento gracioso dessas estruturas semelhantes a cabelos faz girar o embrião dentro do fluido perivitelínico.
As larvas de cecilianos, salamandras e alguns anuros em desenvolvimento direto, vivíparos, têm brânquias externas que pressionam contra a parede interna da cápsula gelatinosa do ovo, o que permite a troca de gases (oxigênio e dióxido de carbono) com o ar externo ou com os tecidos maternos. Durante o desenvolvimento, a amônia é a principal forma de excreta (resíduo) nitrogenado e é diluída por uma difusão constante de água no fluido perivitelino.
O desenvolvimento dos membros nos embriões das salamandras aquáticas começa na região da cabeça e prossegue em uma onda descendo pelo corpo, e os dedos aparecem sequencialmente em ambos os conjuntos de membros. As salamandras que depositam seus ovos em riachos produzem embriões que desenvolvem os dois conjuntos de membros antes de eclodirem, mas as salamandras que depositam seus ovos em água parada têm embriões que se desenvolvem apenas nos membros anteriores antes da eclosão. (Em contraste, os membros dos anuros não aparecem antes da eclosão.)
Logo após o aparecimento dos membros anteriores, a maioria das salamandras que vivem em lagos desenvolve uma projeção ectodérmica conhecida como balanceador em cada lado da cabeça. Essas estruturas em forma de bastão surgem do arco mandibular, contêm nervos e capilares e produzem uma secreção pegajosa. Eles impedem que as larvas recém-eclodidas afundem no sedimento e ajudam a salamandra a manter o equilíbrio antes que seus membros anteriores se desenvolvam. Depois que os membros anteriores aparecem, os balanceadores degeneram.
Ciclos de vida de Urodelos ou Caudata
Durante os estágios embrionários e larvais iniciais em anuros, órgãos adesivos emparelhados surgem do arco hióide, localizado na base da língua. O muco pegajoso que secretam pode formar uma ligação filiforme entre um girino recém-eclodido e a cápsula do ovo ou vegetação. Conseqüentemente, o girino que ainda está em desenvolvimento pode permanecer em uma posição estável até que seja capaz de nadar e se alimentar por conta própria, após o que os órgãos adesivos degeneram.
Ciclo de vida de um Anura (sapo, pererecas e rãs)
Embora essa metamorfose da vida aquática para a terrestre ocorra em membros de todos os três grupos de anfíbios, há muitas variantes; e alguns táxons carregam seus filhotes vivos. Na verdade, as cerca de 8.100 espécies vivas de anfíbios exibem mais experimentos evolutivos no modo reprodutivo do que qualquer outro grupo de vertebrados.
Guia para identificação de larvas de anfíbios
(Fonte: Purdue Extension)
Alguns taxa têm ovos e larvas aquáticas, enquanto outros embutem seus ovos na pele do dorso da fêmea (algumas rãs); esses ovos eclodem como girinos ou sapos em miniatura. Em outros grupos, os filhotes se desenvolvem dentro do oviduto, com os embriões se alimentando na parede do oviduto. Em algumas espécies, os ovos se desenvolvem dentro do estômago da fêmea.
Os primeiros anfíbios desenvolveram pernas verdadeiras e passam algum tempo em terra depois que seu estágio inicial de larva se deu na água. Vivendo na terra, os anfíbios podem obter mais alimentos porque há menos competição.
No entanto, uma desvantagem disso é que sua pele resseca longe da água, perdendo muita água da pele, assim, deve ser mantida sempre úmida, portanto, eles têm que voltar para água com frequência.
Um organismo chamado Seymouria sp é conhecido por ser o elo de ligação entre anfíbios e répteis. Este animal exibe tanto as características do crânio dos anfíbios quanto a dos esqueletos dos répteis. Além disso, ele tinha uma armadura externa rígida e escamas sobrepostas.
Durante o processo evolutivo, os répteis evoluíram dos anfíbios e se tornaram os primeiros verdadeiros vertebrados terrestres. A mudança do ambiente aquático para terra aparentemente seca exigiu que os répteis se adaptassem.
Dos anfíbios que antes botavam ovos gelatinosos, os répteis tinham que colocá-los em conchas para melhores chances de sobrevivência.
3) Sistema circulatório
O coração dos anfíbios é dividido em três cavidades: dois átrios ou aurículas e um ventrículo. Os anfíbios têm circulação fechada (o sangue circula somente dentro dos vasos). Dupla, o sangue passa duas vezes pelo coração; e como ocorre mistura de sangue venoso (rico em gás carbônico) e arterial (rico em oxigênio) a circulação neste grupo de animais é do tipo incompleta.
Esquema da circulação generalizada em anfíbios.
As setas indicam a direção do fluxo sanguíneo. Setas coloridas indicam
que uma porção de sangue pode ser desviado de um lado do coração para
o outro lado dentro do ventrículo indiviso, ocorrendo portanto mistura de sangue.
4) Pele e respiração cutânea
Apresentam pele fina, com pigmentos, (graças aos muitos cromatóforos),sem escamas, úmidas, com muitas glândulas mucosas e altamente vascularizada.
Estas características facilitam a respiração cutânea, mas também facilitam a perda de vapor d’água por transpiração, que que não apresentam queratina que impediria a saída da água do corpo. Algumas espécies tem uma certa proteção contra predadores graças as glândulas de venenos espalhados pela pele. Algumas espécies de sapos apresentam atrás dos olhos 1 par de glândulas paratóides que liberam veneno, quando pressionadas. Esse veneno apresenta toxinas, que pode causar desde leves irritações das mucosas até problemas cardíacos (em cães e gatos). (Ver: Pressões evolutivas em anfíbios, para uma discussão)
5) Respiração pulmonar
Quando o estágio larval acaba, os jovem adultos, saem da água, e passam a viver em ambiente terrestre e realizam a respiração pulmonar. Como os seus pulmões são simples (pulmões saculiformes) e não apresentam alvéolos, o que confere ao o órgão pouca superfície de contato com o ar que entra, assim, as trocas gasosas são limitadas; a respiração pulmonar é pouco eficiente, sendo importante a respiração cutânea, processo de trocas gasosas com o meio ambiente através da epiderme úmida da pele. A pele deve, necessariamente, estar úmida, pois os gases não se difundem em superfícies secas. As paredes finas das células superficiais da pele permitem a passagem do oxigênio para o sangue. A pele dos anfíbios é bem vascularizada possibilitando uma grande taxa de troca do CO2 do sangue para a atmosfera e do O2 da atmosfera para os capilares.
Organização da microcirculação cutânea em anfíbios. Em cima: corte transversal esquemático da pele do sapo, mostrando a localização relativa dos vasos sanguíneos dentro e abaixo da epiderme. Em baixo: esquema da rede de vasos sanguíneos na pele. Glândula mucosa (M), Estrato compacto (C), Estrato esponjoso (S), artérias da pele (A), arteríolas ramificadas (SA), rede capilar subepidérmica ou respiratória (RC), ramos arteriolar (PA), vênulas (DV), veias subcutâneas (V), plexo venular subcutâneo (SV), epiderme (E), endotélio linfático (LE). (Reproduzido com permissão de Olesen SP, De Saint-Aubain ML, Bundgaard M. Permeabilidades de arteríolas e vênulas únicas na pele de rã - um estudo funcional e morfológico. Microvasc Res. 1984; 28: 1-22.).
Organization of skin microcirculation in amphibians. Top: Cross-sectional schematic of frog skin, showing the relative placement of blood vessels within and beneath the epidermis. Bottom: Schematic of the network of blood vessels within the skin. Mucous gland (M), Stratum Compactum (C), Stratum Spongiosum (S), Skin arteries (A), branching arterioles (SA), subepidermal or respiratory capillary network (RC), arteriolar branches (PA), venules (DV), subcutaneous veins (V), subcutaneous venular plexus (SV), epidermis (E), lymph endothelium (LE). (Reproduced with permission from Olesen SP, De Saint- Aubain ML, Bundgaard M. Permeabilities of single arterioles and venules in the frog-skin – a functional and morphological-study. Microvasc Res. 1984;28:1–22.) (From: Skin Breathing in Amphibians)
Organização da microcirculação cutânea em anfíbios. Em cima: corte transversal esquemático da pele do sapo, mostrando a localização relativa dos vasos sanguíneos dentro e abaixo da epiderme. Em baixo: esquema da rede de vasos sanguíneos na pele. Glândula mucosa (M), Estrato compacto (C), Estrato esponjoso (S), artérias da pele (A), arteríolas ramificadas (SA), rede capilar subepidérmica ou respiratória (RC), ramos arteriolar (PA), vênulas (DV), veias subcutâneas (V), plexo venular subcutâneo (SV), epiderme (E), endotélio linfático (LE). (Reproduzido com permissão de Olesen SP, De Saint-Aubain ML, Bundgaard M. Permeabilidades de arteríolas e vênulas únicas na pele de rã - um estudo funcional e morfológico. Microvasc Res. 1984; 28: 1-22.)
6) Sistema esquelético
Esqueleto e membros (esquemático)
Esqueleto e membros anteriores e posterires
7) Ecologia dos Anfíbios
https://youtu.be/bHwAguHqYnU
Metamorphosis: Amphibian Nature Documentary
https://youtu.be/8vAxdmb-Qkc
Biggest salamander in Japan
As "sirens" "sirenas" (tritões) geralmente se enterram na lama no fundo de pântanos ou riachos ou se escondem entre plantas aquáticas ou pedras. No entanto, em raras ocasiões, eles podem se aventurar em terra seca por breves períodos. Fora da água, eles podem fazer um som de ganido ou guincho suave. Sua dieta principal é composta de insetos aquáticos e outros invertebrados, que pegam à noite. Eles acasalam na água e põem ovos individualmente ou em lotes nas folhas das plantas aquáticas. Não se sabe se a fertilização é interna ou externa. Os jovens tornam-se adultos sem metamorfose ou mudança física radical, e alguns vivem pelo menos 25 anos ou mais em cativeiro.
8) Excreção
Para uma discussão em aula ver Pressões evolutivas em anfíbios.
Larvas: Amoniotélicos, excretam amônia
Adultos: Ureotélicos, excretam uréia
9) Órgãos dos sentidos
O órgão de audição dos anfíbios como os outros vertebrados é o ouvido. Sua parte mais externa é chamada de membrana timpânica. No lado interno da membrana timpânica existe uma cavidade conhecida como cavidade timpânica. A cavidade timpânica contém ossos semelhantes a bastonetes chamados ossículos. Uma extremidade do osso ossicular está ligada à membrana timpânica e a outra extremidade à orelha interna.
O ouvido interno é um órgão muito delicado. Consiste em três canais semicirculares. Esses canais são preenchidos com um fluido. As células sensoriais estão presentes em locais especiais nos canais semicirculares.
Quando as ondas sonoras atingem a membrana timpânica, ela é colocada em movimento. Isso, por sua vez, vibra o ouvido interno e, portanto, as ondas sonoras estimulam os receptores auditivos no ouvido interno, que conduzem até o cérebro o impulso elétrico que será de codificado.
O ouvido interno, além de ouvir, também mantém o equilíbrio do corpo.
Ouvido de um anfíbio.
Tímpano
Visão geral do ouvido. O ouvido dos vertebrados é um analisador de frequência altamente sensível que recebe o som por meio de um aparato acessório especializado (os ouvidos externo e médio) antes de sua transmissão para órgãos finais distintos contendo células ciliadas sensoriais (o ouvido interno). Embora existam diferenças significativas nas estruturas usadas para receber e analisar o som, as orelhas dos anfíbios e dos mamíferos funcionam de forma muito semelhante entre si. Com poucas exceções, o ouvido anfíbio consiste em um ouvido médio e um ouvido interno, mas não um ouvido externo. Conforme esquematizado na figura, o ouvido médio anfíbio tem um tímpano exposto (membrana timpânica) cobrindo uma cavidade timpânica em forma de funil que se conecta ao ouvido interno perto da base do crânio, logo atrás dos olhos (ver Mason, Cap. 6, para uma revisão do ouvido médio anfíbio). O ouvido interno anfíbio ou labirinto ótico é único entre os animais vertebrados por possuir dois órgãos sensoriais especializados na recepção de sons transportados pelo ar, a papila anfíbia (AP) e a papila basilar (BP). Essas papilas sensoriais residem na porção posterior do labirinto ótico e estão contidas em recessos localizados ventralmente da grande câmara sacular cheia de líquido, compartilhada com dois órgãos maculares sensíveis à vibração, o sáculo e a lagena (Fig. 7.1). Ambas as câmaras AP e BP têm uma membrana de contato fina que separa a perilinfa periótica do fluido da endolinfa da câmara sacular. A energia sonora capturada pelo tímpano, bem como por outras áreas ao longo do corpo de uma rã, é convertida em deslocamentos de fluido e viaja ao longo dos caminhos do labirinto ótico que leva aos espaços endolinfáticos do ouvido interno (Hetherington et al. 1986; Lewis e Lombard 1988; Purgue e Narins 2000a).
O caminho do som eventualmente leva aos recessos AP e BP antes de sair na porção caudal do canal periótico e na janela redonda (Purgue e Narins 2000a). Semelhante ao ouvido de mamífero, o ouvido de anfíbio demonstra uma sensibilidade de intensidade requintada e uma seletividade de frequência nítida que provavelmente surgem de processos de amplificação ativos não lineares. Ainda não se sabe como as teorias da função auditiva dos mamíferos se aplicam à audição dos anfíbios. (Anatomy, Physiology and function of auditory end organs in the frog inner ear).
Os anfíbios aquáticos desenvolveram uma grande variedade de órgãos sensoriais específicos para a captação de determinado tipo de estímulo.
A mecanorrecepção, provida pelos neuromastos, ou órgãos de linha lateral, é a modalidade sensorial responsável pela captação de estímulos vibratórios na água, o que facilita a orientação e a localização de presas.
A olfação possui grande importância na comunicação intraespecífica, assim como na localização de presas, que juntamente com a gustação está associada à seleção de alimentos.
A quimiorrecepção também ocorre na pele, provavelmente por ação de receptores sensíveis a diferenças de salinidade ou em resposta a feromônios sexuais.
Além destes mecanismos, a pele de anfíbios apresenta receptores cutâneos difusos, que respondem a estímulos térmicos, mecânicos, proprioceptivos e nocivos.
Anuros do gênero Pipa apresentam na extremidade de seus dígitos estruturas hemisféricas, que sugerem ter alguma função sensorial. Apresentam uma organização anatômica dos nervos que compõem o plexo braquial, uma morfologia microscópica e ultra-estrutural das terminações distais dos dígitos. As características morfológicas e ultra-estruturais das papilas digitais e das fibras que as inervam sugerem que esta região desempenha percepção de estímulos térmicos e vibratórios. Isto pode ser bastante importante na percepção do meio, visto que estes animais passam a maior parte do tempo submersos e em contato com o substrato. (Morfologia do pelexo braquial em Pipa sp. Pelicano, 2007).
10) Sistema digestório
Sistema digestório em um anfíbio
https://youtu.be/phfzsA5zOBE
Sapo cururu como predador de escorpiões
11) Sinapomorfias dos Lissamphibia: Amphibia
Aparelho auditivo: o estribo é dirigido dorso-lateralmente a partir da janela oval e do opérculo presente.
A superfície articular do atlas é convexa
Os ossos exoccipitais têm uma articulação de sutura para os ossos da cobertura dérmica.
A mão tem 4 dígitos e o pé tem 5 dígitos.
Características compartilhadas pela maioria ou todos os Lissamphibia.
Alguns das características deles se aplicam às partes moles do corpo, portanto, não aparecem nos fósseis. Todavia, as características esqueléticas também aparecem em vários tipos de anfíbios Paleozóicos.
Côndilos occipitais duplos ou pareados
Dois tipos de glândulas da pele
Glândula Mucosas
Glândulas Granulares ou Serosas
Glândulas que inoculam veneno (Cecilia ou cobra-cega)
Glândulas de veneno: além de venenosos são peçonhentos
Glândulas de veneno em cobra-cega. (iScience, 2020, iScience, 2020 )
Equipe de pesquisadores brasileiros mostra que os Gymnophiona apresentam glândulas que podem servir para inocular o veneno em suas presas.
O veneno ou peçonha inclui substancias gelatinolíticas, caseinolíticas, fibrinogêniolíticas, hialuronidase, fosfolipase A2.
Corpos gorduroso associados às gónadas
Papilas sensoriais de canal duplo no ouvido interno
Bastonetes verdes (um tipo especial de células visuais, desconhecidos nos Gymnophiona)
Costelas não rodeiam o corpo
Anuros possuem costelas muito curtas ou não possuem
Capacidade de elevar o olho (com músculos ''levator bulbi'')
Respiração: branquial, pulmonar, cutânea, buco-faringeana
Mecanismo respiratório de "bomba forçada", est sistema respiratório primitivo também encontrado em anfíbios labirintodontes.
Centros cilíndricos (o corpo principal das vértebras); centros cilíndricos também são encontrados em vários grupos de tetrápodes ancestrais)
Dentes pedicelados (as coroas dos dentes são separadas das raízes por uma zona de tecido conjuntivo fibroso; também encontrado em alguns Dissorophoidea; os dentes de algumas salamandras fósseis não são pedicelados)
Dentes bicuspides, bicuspidados (duas cúspides por dente, também encontrado em Dissorophoidea juvenis)
Presença de papilla amphibiorum e papilla basilaris: áreas na parede do sáculo do ouvido interno sensíveis a frequências inferiores a 1000 Hz e superiores a 1000 Hz, respectivamente.
Operculum (pequeno osso no crânio, ligado à cintura escapular pelo músculo opercular; provavelmente envolvido na audição e equilíbrio; associado a capacidade de perceber sons de baixa frequência do ar ou substrato. Ausente em cecilianos (Gymnophiona) e algumas salamandras (Caudata), fundido à columela (osso do ouvido) na maioria dos Anuro).
Perda dos ossos do crânio posteriores (também em Microsauria e Dissorophoidea)
Ossos pterigóides pequenos e amplamente separados (também em Temnospondyli e Nectridea)
Amplo processo cultriforme do parassenóide (também encontrado em alguns Microsauria (Rhynchonkos) e Lysorophia)
São dióicos, desenvolvimento indireto (metamorfose) e direto.
Nas últimas décadas, diversos componentes bioativos de venenos de sapo, com diversas atividades biológicas, foram descobertos e estudados.
Estes compostos apresentam estruturas químicas diversificadas, como esteroides, alcalóides, peptídeos, proteínas e aminas biogênicas.
Os componentes do veneno do sapo são resultado de refinamentos farmacológicos e bioquímicos ocorridos durante o processo de evolução nos últimos 400 milhões de anos, o que os tornou altamente eficazes.
Eles apresentam um amplo espectro de funções fisiológicas e de defesa.
A secreção seca das glândulas da pele de sapos tem sido usada clinicamente por mais de um milênio como um agente cardiotônico anódino, antimicrobiano, anestésico local e antineoplásico.
A descoberta de componentes do veneno com atividade biológica, como anticâncer, antimicrobiano, antiviral, antiparasitário, moduladores da coagulação sanguínea, neurotransmissão, analgésico e anti-inflamatório, entre outros, com o objetivo de descobrir novos fármacos, é um desafio. No entanto, apesar das dificuldades, esses estudos foram realizados e muitos componentes de venenos com potencial terapêutico foram identificados (Baldo et al, 2017).
RESUMO
RESUMO
1. Presença de glândulas mucosas e de toxina (granular);
2. Papilla amphibiorum – área sensorial especial na parede do sáculo do ouvido interno. Esta região é sensível a freqüências menores que 1000 Hz; uma segunda área, a papilla basilaris detecta freqüências acima de 1000 Hz;
3. Complexo opeculum-columella – a maioria possui dois ossos envolvidos na transferência de sons para orelha interna;
4. Bastonetes verdes – células da retina presentes em Urodela e Anura. Esta estrutura provavelmente foi perdida em Gymnophiona;
5. Dentes pedicelados – quase todos os anfíbios modernos possuem dentes nos quais a coroa e a base (pedicelo) são compostos por dentina e estão separadas por uma zona estreita de dentina não-calcifi cada ou tecido conjuntivo fi broso;
6. Estrutura do músculo levator bulbi – esse músculo apresenta-se como uma lâmina delgada no assoalho da órbita. Ele é responsável pela protração e retração dos olhos fazendo com os mesmos se tornem salientes, aumentando assim a cavidade bucal. Está presente nos Urodela e Anura e de uma forma modifi cada nas Gymnophiona;
7. Corpos adiposos situados anteriormente às gônadas.
PANDEMIA Batrachochytrium E A EXTINÇÃO DOS AMPHIBIOS
Quitridiomicose
Batrachochytrium dendrobatidis é um fungo da divisão Chytridiomycota que ameaça a população mundial de anfíbios, causando-lhes uma enfermidade (micose) denominada quitridiomicose. Trata-se de um fungo dulcícola que ataca a pele dos anfíbios, a qual é imprescindível para a sua homeostase hídrica e gasosa, e também para a sua defesa imunológica.
O agente etiológico causador da quitridiomicose foi identificado pela primeira vez 1993 em sapos mortos e doentes em Queensland, Australia. Essa micose tem levado ao declínio significativo a diversidade e à extinção, de populações de anfíbios no oeste América do Norte, América Central, América do Sul, Leste da Austrália e Nova Zelândia.
A pandemia de quitridiomicose provavelmente foi a responsável por um terço de todas as perdas em espécies de anfíbios até agora no mundo. Essas perdas são enormes, e isso se soma a outras ameaças, como destruição de habitat, mudanças climáticas, poluição e caça.
A micose (doença fúngica) foi responsabilizada pela extinção de um terço das 120 espécies perdidas desde 1980.
Com medo de que a quitridiomicose possa exterminar o sapo de Archey (Leiopelma archeyi), criticamente ameaçado de extinção, os pesquisadores estão procurando por um composto que mataria o gatilho da doença, o fungo Batrachochytrium dendrobatidis.
Pesquisas tem mostrado que a doença estava presente na Nova Zelãndia e Austràlia país desde 1978 e que é amplamente distribuída em todo o país. Também foi encontrada na África, América, Europa e Oceania. Na Austrália, Panamá e Nova Zelândia o fungo aparentemente "surgiu" e exapandiou sua distribuição ao mesmo tempo em que o número de sapos declinou. Apesar disso, pode ser que o fungo ocorra naturalmente e que só tenha sido recentemente descrito por ter se tornado mais virulento ou mais presente no ambiente ou ainda devido a uma queda na resistência das populações de anfíbios.
O cloranfenicol foi descoberto após ser isolado do Streptomyces venezuelae em 1947. Sua estrutura química foi identificada e foi sintetizado pela primeira vez artificialmente em 1949, tornando-se o primeiro antibiótico a ser sintetizado em vez de extraído de um microrganismo.
O cloranfenicol é atualmente usado como pomada ocular para humanos, pode ser um salva-vidas para os anfíbios. Os pesquisadores descobriram que sapos banhados na solução se tornaram resistentes à quitridiomicose.
Normalmente não se espera que os antibióticos exerçam alguma ação sobre os fungos. E é verdade. Ainda não entendemos por que e nem como o cloranfenicol atua sobre as hifas dos fungos. Mas atua positivamente matando-as. (Poulter, 2007).
Cloranfenicol
Cloranfenicol é um antibiótico usado para o tratamento de várias infecções bacterianas em humanos. Isso inclui o uso como pomada para tratar conjuntivites. Por via oral ou por injeção intravenosa é usado no tratamento de meningite, peste, cólera e febre tifóide. O seu uso por via oral ou por injeção só é recomendado quando antibióticos mais seguros não podem ser usados. Em humanos recomenda-se a monitoração dos níveis sanguíneos da medicação e dos níveis sanguíneos a cada dois dias durante o tratamento. O cloranfenicol é ocasionalmente usado em preparações tópicas (pomadas e colírios) para o tratamento da conjuntivite bacteriana. Existem relatos médicos, de casos isolados de anemia aplástica após o uso de colírios de cloranfenicol, mas estima-se que o risco seja da ordem de menos de um em 224.716 pacientes.
Dado que a pandemia de quitridiomicose ocorre desde a década de 1980, tem se discutido o possível papel humano na difusão do fungo. Hoje se assume que a espécie Xenopus laevis, uma rã utilizada para efetuar testes e técnicas várias (obstetrícia e investigação), pode atuar como vector propagador do fungo por todo o mundo. O facto de poder atuar como vector resulta do facto de ser imune a esta infecção fúngica.
Existem autores que opinam que o fungo sempre tem estado em contato com as populações de anfíbios e que só agora que estas estão mais susceptíveis do ponto de vista imunológico por efeito do impacto humano nos ecossistemas, fazendo com que a infecção do fungo se torne mais patente.
No entanto, o quão amplamente o cloranfenicol pode ser adotado está aberto a debate. As autoridades da União Européia e dos USA estão preocupadas com o fato de que a droga pode causar anemia aplástica em humanos, justamente por ser uma substância proibida (banida); é controlada, em particular, onde entra em contato com fontes de alimentos para humanos (Garner do ZSL, 2007).
Sendo um fungo aquático ou de lugares úmidos seus esporos dispersam-se facilmente no ambiente, sendo carregado pela água da chuva ou animais, bem como por fômites.
Embora existam algumas teorias a respeito de como este agente debilita o organismo dos anfíbios, o seu mecanismo de ação ainda não foi completamente elucidado, tornando difícil o combate desta ameaça à sobrevivência dos anfíbios. Todavia, um grupo de cientistas conduziu um estudo com rãs afetadas pelo fungo em questão, obtendo resultados esclarecedores, embora seja necessário estudar outras espécies para confirmar as descobertas.
https://youtu.be/Qd5KcP-bbrI
Anfíbios
https://youtu.be/kiC-SOpVli0
Anfíbios
https://youtu.be/Jnn2vzf7Ckw
Anfíbios
https://youtu.be/ZPPVcfQ_W2g
Circulação nos anfíbios
https://youtu.be/vFiLPoRuO4c
Circulação
Exercícios
Nas rãs, os papéis relativos da pele e dos pulmões na respiração se modificam de acordo com a época do ano. Analise a figura a seguir, que mostra a captação de oxigênio por esses dois órgãos ao longo do ano, no hemisfério norte, e assinale as alternativas corretas:
1) Nos meses frios (dez/jan/fev) a captação de oxigênio é baixa e a pele capta mais oxigênio do que os pulmões;
02. no período de março a outubro, o consumo de oxigênio é mais alto e a captação do oxigênio através dos pulmões aumenta várias vezes e excede a que ocorre através da pele;
04. a captação de oxigênio através da pele é mantida praticamente constante ao longo do ano; 08. a captação de oxigênio pelos pulmões nos meses de janeiro e dezembro é, em termos de massa corpórea, cerca de 40ml de oxigênio/kg.h;
16. entre os meses de abril e maio, a captação total de oxigênio pelas rãs atinge seu valor mínimo.
Soma:
2) Descreva a circulação dos anfíbios. Qual a consequência de uma circulação fechada e incompleta?
3) Faça uma tabela comparando Peixes cartilaginosos, Peixes ósseos e Anfíbios, quanto: habitat, esqueleto, sistema circulatório, sistema respiratório, deslocamento no meio ambiente, reprodução.
Bibliografia
Plethodontidae brasileiro (Caudata:Pletohdontidae)
The origin of moderna amphibians: a commentary
https://www.scielo.br/scielo.php?script=sci_arttext&pid=S0031-10492012001800001
https://noticias.ufsc.br/2013/08/tres-especies-de-salamandras-sao-descobertas-na-amazonia-brasileira/
Herpetologia: anfibios e répteis
Biologia dos sirenideos
Alimentação dos bebês Cecílias
Fisiologia
Teste de hipóteses: Bioestatística
Paleontologia dos Amphibia da Bacia do Paraná
Sobre a qualidade das imagens (para o blog)
Recepção de estimulos externos: som
Nova espécie da India (2029)
Dentes com glandulas de neneno das Cecílias
Anfíbios atuais
https://www.slideshare.net/guellitymarcel/sarcopterygii-conquista-do-meio-terrestre-amphibia?from_action=save
Fin-to-limb transition in vertebrate evolution
Descolocamento em anfibios
Respiração cutânea em anfibios
Pressçoes evolutivas em anfíbios
Evolução dos anfibios
ESCÓLIOS
An Ox came down to a reedy pool to drink. As he
splashed heavily into the water, he crushed a young
Frog into the mud. The old Frog soon noticed that
the little frog was missing and asked his brothers and
sisters what had become of him.
"A great big monster," said one of them, "stepped on
little brother with one of his huge feet!"
"Big, was he!" said the old Frog, puffing herself up.
"Was he as big as this?"
"Oh, much bigger!" they cried.
The Frog puffed up still more.
The Frogs & The Ox
www.staidenshomeschool.com (c) 2008
4
"He could not have been bigger than this," she said.
But the little Frogs all declared that the monster was
much, much bigger and the old Frog kept puffing
herself out more and more until all of a sudden she
burst.
The Moral of this story:
Always aim high but do not attempt the impossible.
Fin-to-limb transition in vertebrate evolution
The transformation of fins into limbs is marked by the appearance of digits, an evolutionary milestone that paralleled the loss of dermal fin rays. Fin rays, which are skeletal rods found beneath the skin and above the endoskeleton, undergird fin webs. Previous efforts to explain the evolution of limbs from fins have largely focused on the underlying endoskeleton. Thomas Stewart et al. (pp. 1612–1620) used computed tomography to examine pectoral fin rays of adult and juvenile specimens of three tetrapodomorph fishes. The fishes—Sauripterus taylori, Eusthenopteron foordi, and Tiktaalik roseae—are thought to be evolutionary antecedents of tetrapods, or four-limbed vertebrates, with T. roseae being closest among them to tetrapods. Comparative analysis revealed a trend in the evolutionary progression toward digits: consolidated fin rays with reduced segmentation and branching, reduced fin webs, and asymmetric coverage of the endoskeleton by dorsal and ventral fin rays. The consolidated rays and foreshortened fins of Tiktaalik, which braved forays onto land, were likely adaptations for maneuvering at the water’s murky bottom or on shallow mudflats. Additionally, the fin rays’ dorsoventral asymmetry suggests that the fin’s ventral surface was more muscular than its dorsal surface at the distal end, akin to a fleshy palm—a feature not previously found in tetrapodomorphs. Thus, the authors suggest, the asymmetry of dermal fin rays, together with previous findings on the endoskeleton and girdle, might help explain Tiktaalik’s upright, fin-supported stance and represent an evolutionary precursor to limb architecture in tetrapods. — P.N.
Anatomy, Physiology, and Function of Auditory End-Organs in the Frog Inner Ear
(Dwayne D. Simmons, Sebastiaan W.F. Meenderink, and Pantelis N. Vassilakis)
The vertebrate ear is a highly sensitive frequency analyzer that receives sound through a specialized accessory apparatus (the external and middle ears) prior to its transmission to discrete end-organs containing sensory hair cells (the inner ear). Although there are significant differences in the structures used to receive and analyze sound, amphibian and mammalian ears function very similarly to each other. With few exceptions, the amphibian ear consists of a middle ear and an inner ear, but no external ear. As schematized in Figure 7.1, the amphibian middle ear has an exposed eardrum (tympanic membrane) overlying a funnelshaped tympanic cavity that connects to the inner ear near the base of the skull (see Mason, Chapter 6, for a review of the amphibian middle ear). The amphibian inner ear or otic labyrinth is unique among vertebrate animals in that it has two sensory organs specialized for the reception of airborne sound, the amphibian papilla (AP) and the basilar papilla (BP). These sensory papillae reside within the posterior portion of the otic labyrinth and are contained in ventrally located recesses of the large, fluid-filled saccular chamber shared with two vibration-sensitive macular organs, the sacculus and lagena (Fig. 7.1). Both the AP and BP chambers have a thin contact membrane that separates periotic perilymph from the endolymph fluid of the saccular chamber. Sound energy captured by the eardrum as well as other areas along the body of a frog is converted into fluid displacements and travels along pathways of the otic labyrinth that lead into the endolymphatic spaces of the inner ear (Hetherington et al. 1986; Lewis and Lombard 1988; Purgue and Narins 2000a). The sound path eventually leads into the AP and BP recesses before exiting into the caudal portion of the periotic canal and the round window (Purgue and Narins 2000a). Similar to the mammalian ear, the amphibian ear demonstrates exquisite intensity sensitivity and sharp frequency selectivity that are likely to arise from nonlinear, active amplification processes. How theories of mammalian auditory function apply to amphibian hearing is
not known. Mechanisms of tuning and sensitivity have been extensively studied
in the mammalian cochlea. It is generally agreed that the initial stage of inner ear frequency selectivity is achieved through the specialized mechanical properties
of the basilar membrane, giving rise to a traveling wave (Von Békésy 1960; West
1985). Such traveling waves may be enhanced by electrically driven somatic
movements of specialized outer hair cells that provide the work required for the
active process (Dallos 1992; Nobili et al. 1998; Ashmore et al. 2000). Although
outer hair cell-like motility has not been demonstrated in reptiles and birds, their
papillae contain structures analogous to those in the mammalian cochlea such as
a basilar membrane. However, one of the most striking anomalies concerning the
frog AP is that it lacks a basilar membrane, and yet it clearly demonstrates sharp
frequency resolution and sensitivity as well as otoacoustic emissions (OAEs) that
are comparable to those found in mammals. In amphibians, reptiles, and birds,
the best candidate for an active process may be the active motility of their
mechanically sensitive hair bundles (Hudspeth et al. 2000; Fettiplace et al. 2001;
Bozovic and Hudspeth 2003).
Although amphibian auditory organs may (Wever 1973) or may not (Will
and Fritzsch 1988) have arisen independently and separately from those of other
vertebrates, studies of these organs provide an opportunity to explore the details
of what may be convergent design and function. Do analogous physiological
responses arise from similar or different anatomical features? Does the sensory
end-organs’ fine structure and innervation follow common principles across
species? Although there have been extensive investigations into the physiology
of these organs, much less is known about the detailed structure of anatomical correlates of this physiology such as the relationship between conduction velocities and response latencies. Much of the physiology of hair cell and eighth-nerve
responses of the AP and BP has been reviewed previously (Lewis and Narins
1999; Smotherman and Narins 2000). Sections 2 and 3 focus on the basic
structural correlates of physiological responses of ranid frogs within the auditory
papillae and nerve, respectively, and Section 4 focuses on what is known about
amphibian OAEs, and discusses the relationship of their properties to the
underlying hearing mechanisms as well as the differences between sensory
organs.
2. AP and BP Sensory Organs
2.1 Structural Organization of the AP and BP
Acoustic sense organs attach to the dorsal wall (ceiling) of the AP and BP chambers. In ranid frogs, the AP chamber is oblong and roughly cylindrical. At its
lateral end, it opens broadly to the saccule and, towards its medial end, it is closed
by a thin contact membrane. As illustrated in Figure 7.2, the hatchet-shaped AP
sensory organ can be divided into a rostral patch of hair cells (representing the
hatchet blade) up to 30 hair cells wide, an omega-shaped, central curved section
(representing the handle neck) with 6 to 10 hair cell rows, and a caudal extension (representing the handle base) that flares out at its caudalmost pole to accommodate 20 rows of hair cells (Wever 1973; Lewis et al. 1985; Simmons et al.
1994b, 2004). Overlying the sensory surface of the AP is a honeycomb meshwork of gelatinous tissue called the tectorium. A thin net of tectorial tissue (tectorial curtain) is suspended across the AP chamber between the AP nerve and the
middle region of the AP tectorium. In contrast, the organization of the BP is quite
simple. The cylindrical and much smaller BP chamber also opens to the saccule
at its lateral end and is likewise closed by a thin contact membrane towards its
medial end. Hair cells in the BP are organized into five or six rows containing
up to 20 hair cells each (Wever 1985). The BP has a thin, semi-lunar tectorium
stretching across a short tubular passage with an underlying sensory epithelium
(Fig. 7.2B). In contrast to the mammalian cochlea, hair cells in both the AP and
the BP are rigidly fixed to the cartilaginous wall of the respective papillar
recesses, rather than over a flexible membrane. In mammals, traveling waves on
the flexible basilar membrane are thought to contribute importantly to the functionality of the cochlea.
There are many features of the frog auditory system that may influence its sensitivity and tuning. The tectorial structures of each papilla, the size of the hair
cell, its position within the papilla, as well as its stereovillar morphology all contribute to the thresholds and tuning characteristics of afferent nerve fibers. In addition, the synaptic area and number of synapses per hair cell, the region and
number of hair cells innervated, and the diameter and length of each afferent fiber
also contribute to the fiber’s threshold, latency, and/or tuning responses. However,
how the tectorium, hair cells, and synaptic architecture impose limits on eighthnerve responses is not at all well understood.
For the gross tuning of frog auditory organs, Purgue and Narins (2000a,b)
suggest that the frequency difference in neural responses between the AP and BP
may be largely explained on the basis of the mechanical tuning of their respective contact membranes. However, only a few studies have attempted to characterize the micromechanics of the tectorium (Lewis and Leverenz 1983; Shofner
and Feng 1983; Lewis et al. 1992). With the exception of Wever’s hypothesis that
the tectorial curtain intercepts the motion of the fluid in the AP chamber and transfers it to the tectorium (Wever 1985), very little is known or has been hypothesized about the dynamics between the point of auditory interception and the
initiation of action potentials in the auditory nerve fiber (Smotherman and Narins
2000). In general, the degree to which the fine structure of the auditory end-organ
and its nerve fibers are related to physiological parameters such as acoustic
tuning, threshold responses, response latencies, and spontaneous activity is not
as well understood in frogs as it is in the mammalian cochlea.
(Fonte: Narins, Feng, Fay and Popper)
A lenda da Salamanca do Jarau (Abreviada)
Lenda do século XIX, recolhida em livro por pesquisadores do folclore platino e que inspirou João Simões Lopes Neto (1865-1916) a compor uma versão reestilizada, publicada no clássico Lendas do Sul (1913).
A Teiniaguá, ícone da cultura gaúcha, era uma princesa moura, transformada em uma salamandra (ou lagartixa ou lagarto depende da fonte). Corpo de salamandra tinha em sua cabeça uma pedra preciosa cintilante, um rubi, que fascinava os homens e os enfeitiçava, vivia em uma lagoa no Cerro do Jarau na fronteira oeste da Provincia de São Pedro (RGS). O nome Salamanca, ao invés de "salamandra", é reconhecido também como referência à cidade espanhola de Salamanca, a qual foi ocupada pelos islâmicos entre os séculos VIII e X.
No Dicionário do Folclore Brasileiro, de Câmara Cascudo, é citada como origem provável da lenda, a existência na cidade de Salamanca, na Espanha, de subterrâneos onde eram ensinadas ciências mágicas. A fama da cidade na Europa transformou o termo “covas de Salamanca” em sinônimo de local que continha segredos maravilhosos. Ainda em comum com a lenda, o professor das covas de Salamanca, nos idos de 1322, era um sacristão chamado Clemente Potosi. Talvez por esse motivo, em toda a América Latina registrem-se histórias que apontam Salamancas como depósitos de grandes riquezas, principalmente nas regiões i
nfluenciadas pela colonização espanhola.
Um dia o sacristão da igreja da aldeia de São Thomé, assolado pelo calor, foi até a lagoa se refrescar. Ao chegar na margem da lagoa percebeu que a água borbulhava e sobre uma rocha avistou a salamandra (ou lagartixa) e rapidamente capturou-a, sabendo que "quem prendesse a teiniaguá ficava sendo o homem mais rico do mundo". Ele passou a cuidar da princesa encantada, alimentando-a com mel de lechiguana. No quarto trancado do sacristão, a lagartixa virou gente. "Bonita, linda, bela, na minha frente estava uma moça! (...) Cada noite era meu ninho o regaço da moura", rememora ele, muito depois, num encontro com Blau Nunes diante do Cerro do Jarau.
Depois de se refrescar na água da lagoa rumou para seus aposentos atrás da igreja. Um dia, o sacristão roubou o vinho da missa e embebedou-se com a princesa. Quando acordou, estava cercado pelos padres jesuítas. "Fui sentenciado a morrer pela morte do garrote, que é infame; condenado fui, por ter dado passo errado com bicho imundo, que era bicho e mulher moura, falsa, sedutora e feiticeira."
Acusado de conluio com o demônio foi condenado a morte por garrote, uma morte infame. No dia da aplicação da sentença, sua amada pressentiu que algo ruim ia acontecer ao jovem sacristão, e apareceu na aldeia para resgatá-lo. Com seu poder encontrou o rapaz e o resgatou da morte, levando-o para uma caverna, no Cerro do Jarau. No cerro, por duzentos anos, o sacristão serviu de guardião junto a uma furna, sem comer ou dormir, vítima de um encantamento. Lá dentro do morro, em um palácio maravilhoso, repleto de tesouros, vivia a teiniaguá.
Instado pelo sacristão a quebrar o feitiço, Blau entra pela furna, "a boca da toca", e avança para dentro do cerro. Vence sete provas, até encontrar "uma velha, muito velha", que pela proeza permite-lhe escolher entre as maiores riquezas e poderes. Ele recusa tudo e diz à velha:
— Teiniaguá encantada! Eu te queria a ti, porque tu és tudo!... És tudo o que eu não sei o que é, porém que atino que existe fora de mim, em volta de mim, superior a mim...
Uma escuridão caiu e Blau Nunes viu-se de novo do lado de fora do Jarau. Quis entrar de novo pela furna, "mas bateu coo peito na parede dura do cerro". Já não havia "fresta, nem brecha, nem buraco". Apareceu-lhe o sacristão, com um presente, uma moeda furada mágica, que gerava moedas infinitas, mas só uma de cada vez. Ele a aceitou aquela onça de ouro e foi embora. Essa moeda fez de Blau um homem rico, mas não feliz. Ele voltou ao cerro para devolvê-la ao sacristão. "Neste mesmo momento ouviu-se um imenso estouro, que retumbou vinte léguas ao redor. O Cerro do Jarau tremeu de alto a baixo, até as suas raízes, nas profundas entranhas da terra, e logo, em cima, no chapéu do espigão, apareceu, cresceu, subiu, aprumou-se, brilhou, apagou-se, uma língua de fogo, alta como um pinheiro, apagou-se e começou a sair fumaça negra, em rolos grandes Era a queima dos tesouros da salamanca que afundava nas profundezas da Terra." Blau Nunes viu a velha transformar-se em teiniaguá e a teiniaguá em linda e jovem princesa. De mãos dadas, ela afastou em "viagem de alegria" com seu amado sacristão. O encantamento estava desfeito. "Assim acabou a salamanca do Cerro do Jarau, que aí durou duzentos anos, que tantos se contam desde o tempo dos Sete Povos das Missões.
Extinção KT
No final do período Cretáceo ocorreu a extinção dos dinossauros e de diversas outras espécies de animais e plantas. Existem muitas teorias sobre essa extinção em massa de organismos vivos, e uma delas é a de que certos movimentos sofridos pelos continentes provocaram mudanças nas correntes marítimas e também no clima do planeta. Isso fez a temperatura baixar, o que causou invernos mais rigorosos, consequentemente levando ao desaparecimento dos seres vivos que habitavam a Terra.
Outra teoria sobre a extinção dos dinossauros, e a que é mais aceita pela comunidade científica, é a de que um asteroide com aproximadamente 10 km de diâmetro tenha atingido a superfície da Terra, gerando uma explosão semelhante a 100 trilhões de toneladas de TNT.
Em 1990 essa teoria foi reforçada depois que um grupo de cientistas encontrou, no México, uma cratera com aproximadamente 180 km de diâmetro. Estudos geológicos realizados no local sugerem que essa colisão teria ocorrido há 65 milhões de anos, coincidindo com a época da extinção dos dinossauros. Outro fator muito importante e que dá grande apoio a essa teoria é a descoberta de uma grande concentração de irídio (mineral raro na Terra, mas muito encontrado em meteoritos) em rochas do período Cretáceo. (Fonte: Brasil escola)














































































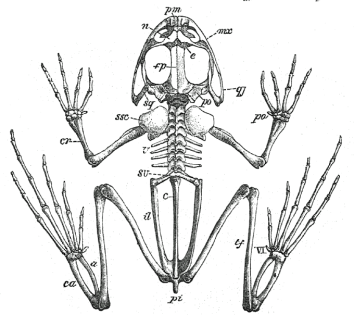
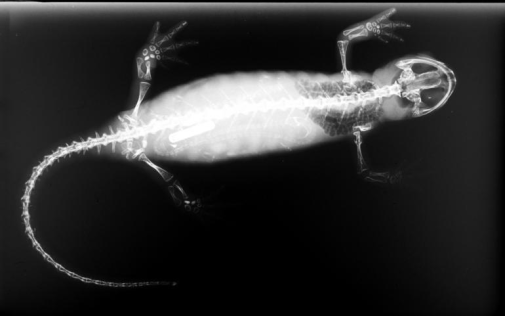



































































1 comentários:
Nice
Postar um comentário