EMBRIOLOGIA
“Como sabemos qual é o tipo primitivo de gastrulação? O estado atual da embriologia certamente não nos permite dar uma resposta positiva a essa pergunta. Se a forma primária é a gástrula epibólica ou embólica, a plácula, a plânula delaminada unipolar ou multipolar, ou ainda um tipo diferente, está para ser visto; e o próprio fato de que a diferenciação das camadas é efetuada em tal diversidade de maneiras prova conclusivamente que esses estágios iniciais de desenvolvimento são tão suscetíveis à modificação secundária quanto os posteriores.” (E.B. Wilson, 1892)
“How do we know what is the primitive type of gastrulation? The present state of embryology certainly does not enable us to give any positive answer to this question. Whether the primary form is the epibolic or the embolic gastrula, the plakula, the unipolar or multipolar delaminate planula, or a still different type, remains to be seen; and the very fact that the differentiation of the layers is effected in such a diversity of ways proves conclusively that these early stages of development are as susceptible to secondary modification as the later.”
(E.B. Wilson, 1892. Zoólogo e geneticista Estadunidense)
Any scientific revolution or synthesis has to accept all sorts of black boxes, for if one had to wait until all black boxes are opened, one would never have any conceptual advances. (Ernst Mayr on Darwin's inability to suggest how species originate, 1991).
Embriologia e evolução
The images show a 600-million-year old phosphatized animal embryo undergoing discoidal cell division. The size of the embryo is about 510 micron in diameter.
The images are three-dimensional reconstructions based on volume data collected by high-resolution phase contrast synchrotron radiation X-ray microtomography (voxel size is 0.56 micron). The images were produced by Dr. Zongjun Yin, Nanjing Institute of Geology and Palaeontology, Chinese Academy of Sciences.
Imagem superior (4,5,7,8) mórulas; inferior uma gástrula fossilizadas, recuperadas da formação Doushantuo proveniente da China, datados com idade entre 590-565 mya.(1,2,3)
Unearthed by phosphate miners in southern China, the microfossils of the Doushantuo formation just predate, or are the earliest known members of the Ediacaran biota, the first bizarre animal life. The Ediacaran itself predates the 550 million-year-old Cambrian Explosion when most modern animal groups emerged. In this bed were what appeared to be animal embryos. 20 years and reams of papers later, we still don’t really know what the heck they were. A 2017 review in the Journal of the Geological Society concluded that although they have many animal-like characteristics, none of these features are exclusive to animals. Debate continues. Other possible Doushantuo finds reviewed by the paper include the first sponge and possible red algae. But nothing except their beauty and marine origin are definitive.
a) Stratigraphic distribution of the Portfjeld biota and the Weng’an biota (representative of Doushantuo Formation), the latter of which predates the classical macroscopic “Ediacaran biota” and probably also predating the Gaskiers glaciation39. The potential stratigraphic range of the biotas is indicated by the vertical line but detailed stratigraphic correlation and relationships to other biotas remain to be resolved. b) Palaeogeographic reconstruction at ca. 580 Ma, black polygons show location of the two taphonomic windows of this type known from the Ediacaran and their spatial separation (adapted from 49,54). Retirado de: Ediacaran Doushantuo-type biota discovered in Laurentia.
EMBRIOLOGIA
Como sabemos os organismos estão divididos em dois grupos principais, dependendo apenas se as células possuem um envoltório nuclear ou não.
Os procariotos (do grego πρό = pro: antes e κάρυον = karyon: noz, amêndoa, ou núcleo, onde estão incluídas as eubactérias e as arqueobactérias, não possuem um núcleo verdadeiro.
Os eucariotos, do grego ευ = eu : verdadeiro, bom, perfeito; e κάρυον = karyon: noz, amêndoa, núcleo que incluem os protoctistas (gurpo artificial), metazoários (animais), embriófitas (plantas) e fungos, possuem um tegumento nuclear bem formado, a carioteca, (membrana fosfolipídica) circundando seu material genético, i.e., os seus cromossomos.
Essa diferença fundamental entre os procariotos e eucariotos influencia a maneira como esses grupos organizam e utilizam seu material genético. Em ambos os grupos, a informação herdada necessária para o seu desenvolvimento e metabolismo se encontra codificada nas sequências de ácido desoxirribonucléico (DNA) dos cromossomos.
Os cromossomos procarióticos normalmente são hélices duplas de DNA, pequenas e circulares consistindo de aproximadamente 1 milhão de pares de bases.
As células eucarióticas geralmente possuem diversos cromossomos, e um simples protoctista (eucariótico) possui 10 vezes, ou mais, a quantidade de DNA encontrada na maioria dos procariotos complexos.
Além disso, a estrutura de um gene eucariótico é mais complexa do que a de um gene procariótico. A seqüência de aminoácidos de uma proteína procariótica é a reflexão direta da seqüência de DNA do cromossomo.
O DNA de um gene eucariótico que codifica uma proteína, geralmente, é dividido de tal forma que a seqüência completa de aminoácidos da proteína é derivada de segmentos descontínuos de DNA. O DNA entre os segmentos freqüentemente contém seqüências que estão envolvidas na regulação do momento e lugar em que o gene é ativado.
Cromossomos eucarióticos também são muito diferentes dos cromossomos procarióticos. O DNA eucariótico reveste complexos protéicos específicos, chamados nucleossomos, compostos por proteínas histonas.
Os nucleossomos organizam o DNA em estruturas compactas e são importantes na designação de qual gene irá se expressar em qual célula.
Nas bactérias não existem histonas. Mais ainda, células eucarióticas sofrem mitose, na qual o tegumento ou envoltório nuclear, carioteca, se parte e os cromossomos replicados são igualmente divididos entre as células filhas.
Nos procariotos, a divisão celular não é mitótica; não se desenvolve o fuso mitótico e, também, não existe tegumento nuclear para se partir. Ao invés disso, os cromossomos filhos permanecem ligados a pontos adjacentes na membrana celular, chamados mesossomos. Esses pontos de ligação são separados entre si pelo crescimento da membrana celular, e finalmente colocam os cromossomos em diferentes células filhas.
Os últimos anos do século XX encontram a biologia do desenvolvimento retornando à posição que ela ocupou no início do século: a disciplina que unifica os estudos da hereditariedade, evolução e fisiologia.
Em 1896, a primeira edição de B. Wilson do The Cell in Development and Inheritance anunciou “a verdade maravilhosa que uma única célula pode conter em seu interior sua extensão microscópica da soma-total da herança das espécies.”
Hoje, a biologia do desenvolvimento está na vanguarda desse estudo de nossa herança natural. Nos seus aspectos moleculares, ela toca a química, e a física na sua investigação dos mecanismos bioquímicos pelos quais proteínas diferentes são produzidas em células diferentes do mesmo genoma. Ela também está na liderança dos estudos evolucionários que procuram entender como mudanças macroevolucionárias (surgimento de categorias taxonômicas superiores) ocorreram.
Ela abriu recentemente uma área nova da biologia do desenvolvimento ecológico, onde mudanças ambientais são vistas criando alterações no desenvolvimento do organismo. Durante os últimos anos, a biologia do desenvolvimento também expandiu para a medicina, fundindo-se com a genética clínica para criar uma ciência revitalizada da embriologia humana, uma ciência que já se tornou importante na explanação das malformações congênitas.
EMBRIOLOGIA E EVOLUÇÃO
Segundo Gilbert (2016) as principais características do desenvolvimento animal estão ilustrados na figura abaixo.
Ciclo de vida de um anfíbio
A vida de um novo indivíduo é iniciada pela fusão do material genético de dois gametas, o espermatozóide e o óvulo.
Essa fusão, chamada fertilização, estimula o ovo a iniciar o desenvolvimento.
A fertilização ocorre quando o espermatozoide penetra no ovócito, e vários eventos iniciam nesse momento. Um evento importante é a fusão de dois pronúcleos, um masculino e outro feminino, levando à restauração do número diploide de cromossomos, da espécie.
No caso dos humanos, restaura-se o número de 46 cromossomos (23 cromossomos vindos do gameta masculino + os 23 cromossomos vindos do gameta feminino) o que gera a variabilidade encontrada nas espécies.
Ao final desses eventos, forma-se a célula ovo ou zigoto, e os 46 cromossomos que o formam se organizam em um fuso de clivagem.
Para comparação com outros animais do nosso reino (Metazoa, Animalia) coloco aqui uma linha do tempo do desenvolvimento embrionário de um animal muito conhecido por nós: o animal humano.
Etapas do desenvolvimento humano
Esquema que mostra o processo morfogênico chamado de gastrulação que origina os tecidos embrionários, coletivamente chamados de folhetos embrionários, ou folhetos germinativos. É durante a gastrulação que os três folhetos são formados. O folheto embrionário ectoderme, a endoderme e a mesoderme e alguns de seus derivados em vertebrados adultos.
Fertilização
Fertilização
Representação da interação entre os gametas e da reação acrossômica.
A-B) O espermatozoide liga-se à zona pelúcida e sofre a reação acrossômica;
C-D) as enzimas do acrossoma digerem a zona pelúcida, o espermatozoide faz um contato tangencial com o oócito, ocorre a fusão das membranas dos gametas, e E) o espermatozoide entra no oócito.
Fertilização (Fonte: Dorsey)
Os núcleos dos gametas são denominados de pronúcleos.
Para alcançar o ovócito, inicialmente, o espermatozoide passa pela corona radiata utilizando enzimas presentes no acrossoma, como a hialuronidase, que promove a quebra de ligação das células foliculares, dispersando-as.
A seguir, o gameta masculino se liga à zona pelúcida a qual passa a ser digerida naquele ponto pela enzima proteolítica acrosina.
A porção anterior da membrana plasmática do espermatozóide é desprendida, assim como as mitocôndrias são perdidas. Com a fusão das membranas plasmáticas dos gametas (ovócito e espermatozoide), o conteúdo dos grânulos corticais do ovócito é liberado por exocitose, alterando proteínas específicas da zona pelúcida (reação de zona) um mecanismo para evitar a poliespermia, ou seja, que outros espermatozoides fertilizem o mesmo ovócito (Nunes et alii, 2020).
A fertilização estimula o ovócito II a finalizar a segunda divisão meiótica, quando libera o segundo corpúsculo polar e dá origem ao.
Essa célula passa a ser chamada de óvulo. Concomitantemente, o núcleo do espermatozoide aumenta de tamanho, se descondensa, tornando-se o pronúcleo masculino, e sua membrana se desintegra. A seguir, o centríolo do espermatozóide se coloca entre os pronúcleos haplóides, promovendo a fusão destes ocorrendo a formação de uma nova célula diplóide, a célula ovo ou zigoto.
Na formação dessa nova célula os envoltórios nucleares desintegram-se, e os cromossomos pareiam-se. Logo após inicia-se a clivagem ou segmentação.
O espermatozóide pode contribuir com os centríolo(s) para organizar o fuso mitótico do zigoto. Isso ocorre, por ex., em ouriço-do-mar, onde há a entrada dos dois centríolos do espermatozoide no ovo.
Em humanos, o centríolo proximal do espermatozoide sofre duplicação no gameta feminino para formar os ásteres. Em insetos e em alguns mamíferos, como os roedores, onde há a perda da integridade dos centríolos do espermatozoide, o fuso surge a partir do centrossoma materno. (Montanari, 2013).
O gameta feminino geralmente apresenta camadas acelulares envoltórias que servem para a proteção e barreira pela qual os espermatozoides devem atravessar. Conforme a sua origem, esses envelopes pode ser classificados em primário, secundário e terciário.
Envelope primário
É secretado pelo próprio oócito. Ex.: membrana vitelínica dos cntenóforos, envelope vitelínico e camada gelatinosa em ovos de equinodermos, córion em ovos de peixe, envelope vitelínico em ovos de anfíbios, membrana vitelínica dos ovos de aves e zona pelúcida em mamíferos.
Envelope secundário
Sintetizado pelas células foliculares. Ex.: envelope vitelínico e córion em ovos de insetos.
Envelope terciário
O envelope terciário é produzido pelas células do trato reprodutor feminino, sendo adicionado ao gameta após a sua ovulação. Ex.: camada gelatinosa nos ovos de ctenóforos e de anfíbios, albúmen (clara) membranas interna e externa da casca nos répteis e aves.
Fertilização, clivagens, mórula, compactação e blástula ou blastocisto
Os estágios subsequentes do desenvolvimento são coletivamente chamados de embriogênese.
A embriogênese é o processo através do qual o embrião é formado e se desenvolve. Começa no momento da fertilização, a fusão do núcleo do gameta masculino com o núcleo do gameta feminino constituirá uma nova entidade que a partir desse momento passará a chamar-se de ovo ou zigoto.
Clivagem
Segundo Gilbert (2003) a clivagem é um processo muito bem coordenado e é regulado geneticamente.
Na clivagem ou segmentação embrionária, não ocorrem as fases G1 e G2, do ciclo celular normal, o que ocorre é o aumento do número de células sem ocorrer, aumento do volume celular, i.e., não há crescimento celular. O que leva a serem produzidos células, blastômoeros, cada vez menores.
Nos animais de desenvolvimento externo:
1) O período imediatamente após a fertilização do óvulo pelo espermatozoide é seguido de divisões celulares com ciclo celular abreviado, i.e., sem as fases G1 e G2.
2) Não há tempo para transcrição
3) Dependem de estoques maternos, i.e. presentes no citoplasma do ovo.
O período até a gástrula é o de maior divisão celular
CONTINUARÁ...
O padrão da clivagem embrionária de uma dada espécie é determinado por dois parâmetros principais: (1) a quantidade e a distribuição de proteína do vitelo dentro do citoplasma e (2) aqueles fatores no citoplasma do ovo que influenciam no ângulo do fuso mitótico e na determinação do tempo de sua formação.
A quantidade e distribuição de vitelo determina onde a clivagem pode ocorrer e o tamanho relativo dos blastômeros.
Quando um pólo do ovo é relativamente livre de vitelo, a divisão celular ocorre nesse pólo de uma forma mais rápida do que a do pólo oposto.
O pólo rico em vitelo é chamado de pólo vegetal; a concentração de vitelo no pólo animal é relativamente baixa. O núcleo do zigoto é freqüentemente deslocado em direção ao pólo animal.
No geral, o vitelo inibe a clivagem. A Tabela "classificação dos tipos de clivagem" fornece a classificação dos tipos de clivagem e mostra a influência do vitelo no padrão e na simetria da clivagem.
Em zigotos com relativamente pouco vitelo (ovos isolécitos e mesolécitos) a clivagem é holoblástica, significando que o sulco da clivagem se estende por todo o ovo.
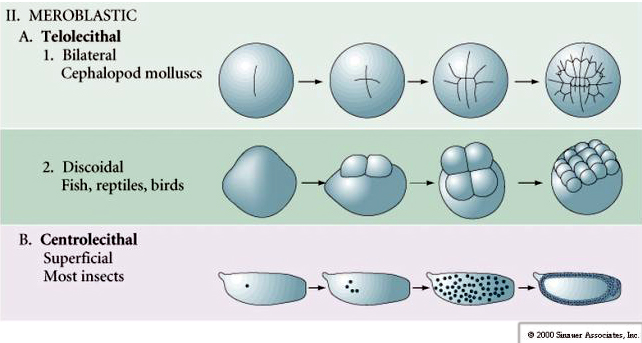
Zigotos contendo grande acúmulo de proteína vitelínica sofrem clivagem meroblástica, onde somente uma porção do citoplasma é clivado. O sulco da clivagem não chega a penetrar na porção de vitelo do citoplasma.
A clivagem meroblástica pode ser discoidal, como nos ovos das aves, ou superficial, como em zigotos de insetos, dependendo onde o depósito de vitelo estiver localizado, de um lado (telolécito) ou no centro do citoplasma (centrolécito), respectivamente.
O vitelo é uma extraordinária adaptação que permite ao embrião se desenvolver na ausência de uma fonte externa de alimentação. Animais desenvolvidos sem grandes concentrações de vitelo, como os ouriços-do-mar, normalmente formam o estágio larval muito rapidamente. Esse estágio larval pode se alimentar por si só, o desenvolvimento continua com a larva nadando livre em busca de alimento.
Embriões de mamíferos, que também não possuem uma grande quantidade de vitelo, adotam uma outra estratégia: a placenta, como veremos adiante, se torna a primeira diferenciação do embrião mamífero separando as células que irão formar a placenta. Esse órgão fornece alimento e oxigênio para o embrião durante sua longa gestação.
No outro extremo estão os ovos dos insetos, peixes, répteis e aves. A maior parte do seu volume celular é vitelo. O vitelo deve ser o suficiente para nutrir esses animais, sendo que eles se desenvolvem sem um estágio larval ou placentário (embora alguns insetos apresentam estágios larvais). A correlação entre grandes concentrações de vitelo e a falta do estado larval é conhecida em algumas espécies de rãs. Algumas rãs tropicais, tais como as Eleutherodactylus e a Arthroleptella não passam pelo estágio de girino. Ao contrário, eles provém seus ovos com quantidades enormes de concentração de vitelo (Lutz, 1947). Os ovos não necessitam ser colocados na água porque o estágio de girino foi eliminado.
No entanto, o vitelo é somente um fator influenciando o padrão de clivagem em uma espécie. Existem também padrões herdados de divisões celulares que são adicionados às restrições do vitelo. Isso pode ser prontamente observado em ovos isolécitos, nos quais muito pouco vitelo está presente.
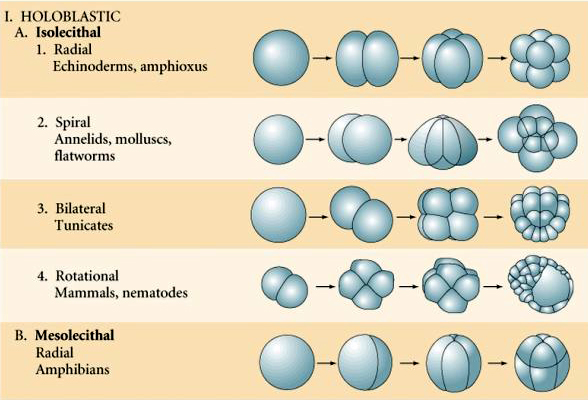
Na ausência de grandes quantidades de vitelo, quatro tipos principais de clivagem podem ser observados: holoblástica radial, holoblástica espiral, holoblástica bilateral e clivagem holoblástica rotacional (Gilbert, 2003).
Clivagem Holoblástica Radial
A clivagem holoblástica radial é a forma mais simples de clivagem de se entender. Nesse tipo de clivagem os sulcos têm orientação paralela e perpendicular ao eixo animal-vegetal do ovo. Esse tipo de clivagem é característico de equinodermos e do protocordado (Cephalochordata) Amphioxus, assim como de rãs e salamandras (Anphibia).
A clivagem padrão da holotúria, Synapta digita, é ilustrada na figura acima.
Após a união dos pronúcleos, o eixo da primeira haste mitótica é formado perpendicularmente ao eixo animal-vegetal do ovo. Para esse fim, o primeiro sulco da clivagem passa diretamente através dos polos animal e vegetal, criando duas células filhas do mesmo tamanho. Essa clivagem é conhecida como meridional porque passa pelos dois polos como um meridiano no globo.
Os sulcos da segunda clivagem estão no ângulo reto dos sulcos da primeira clivagem, mas continuam perpendiculares ao eixo animal-vegetal do ovo. Os dois sulcos da clivagem aparecem simultaneamente em ambos blastômeros e também passam pelos dois polos. Dessa maneira, as primeiras duas divisões são, ao mesmo tempo, meridional e perpendicular uma com a outra. A terceira divisão é equatorial: as hastes mitóticas de cada blastômero estão agora em posição paralela ao eixo animal-vegetal, e o sulco resultante da clivagem separa os dois polos um do outro, dividindo o embrião em oito blastômeros iguais. Cada blastômero na metade animal do embrião está agora diretamente acima do blastômero da metade vegetal. A quarta divisão é meridional novamente, produzindo duas fileiras de 8 células cada, enquanto a quinta divisão é equatorial, produzindo quatro fileiras de 8 células cada.
Sucessivas divisões produzem embriões de 64, 128 e 256 células, com divisões meridionais alternando com divisões equatoriais. Os embriões resultantes consistem de blastômeros dispostos em fileiras horizontais ao longo de uma cavidade central. Em ambos os pólos do embrião, os blastômeros se movem, uns em direção aos outros, para criar uma esfera oca composta de uma única camada de células.
Essa esfera oca é chamada de blástula, e a cavidade central é referida como blastocele. A qualquer momento durante a clivagem da Synapta, um embrião seccionado através de qualquer meridiano produz a imagem refletida de duas metades. Esse tipo de simetria é característico de uma esfera ou cilindro e é chamada de simetria radial. Dessa maneira, Synapta tem clivagem holoblástica radial.
Synapta maculta (Echinodermata; Holoturioide)
Pepino do mar comestível
Outro exemplo de clivagem holoblástica radial é o ouriço-do-mar mas com algumas importantes modificações.
A primeira e a segunda clivagem são similares as da Synapta; ambas são meridionais e perpendiculares em relação a outra. Similarmente, a terceira clivagem é equatorial, separando os dois pólos um do outro.
Na quarta clivagem, no entanto, os eventos são bem diferentes. As quatro células da camada animal se dividem meridionalmente em oito blastômeros, cada qual com o mesmo volume. Essas células são chamadas mesômeros. A camada vegetal, no entanto, sofre uma clivagem equatorial desigual para produzir no pólo vegetal quatro células grandes, os macrômeros, e quatro pequenas, os micrômeros (Summers et al., 1993).
Assim que a célula com 16 blastômeros clivar, os oito mesômeros se dividem para formar duas camadas “animais”, an1 e an2 , uma se equilibrando em cima da outra. Os macrômeros se dividem meridionalmente, formando uma camada de oito células abaixo de an2. Os micrômeros também se dividem, produzindo um pequeno grupo abaixo da camada maior. Todos os sulcos de clivagem da sexta divisão são equatoriais; a sétima clivagem é meridional, produzindo uma blástula com 128 células.
Em 1939, Sven Hörstadius realizou um experimento simples demonstrando que o controle do tempo e colocação de cada clivagem de ouriço-do-mar é independente de clivagens preexistentes. Ele demonstrou que se inibisse a primeira, a segunda e terceira clivagens, sacudindo os ovos, ou colocando-os em água do mar hipotônica, a clivagem desigual (quarta) que forma os micrômeros, ainda ocorreria no tempo apropriado. Sendo assim, Hörstadius concluiu que existem três fatores que determinam a clivagem em um embrião de 8 células:
(1) existem mudanças progressivas no citoplasma, algum tempo após a fertilização, que direcionam os fusos formados para uma certa direção;
(2) deve haver material formador de micrômero no citoplasma vegetativo; e
(3) deve haver algum mecanismo pelo qual o material formador de micrômeros seja ativado no tempo correto (Hörstadius,1973).
No desenvolvimento do ouriço-do-mar, o estágio de blástula começa na fase de 128 células. Nesse estágio, as células formam uma esfera oca circundando a blastocele central (figura "Blástula de ouriço-do-mar" A,B).
Nessa altura, todas as células são do mesmo tamanho, os micrômeros tendo diminuída sua divisão celular e clivando menos freqüentemente.
Toda a célula está em contato com o fluido proteináceo da blastocele e com a camada hialina dentro do envoltório de fertilização (zona pelúcida). Durante esse tempo, os contatos entre as células são estreitados.
Dan-Sohkawa a Fujisawa (1980) analisaram esse método em embriões de estrela-do-mar e mostraram que o fechamento da cavidade esférica é contemporânea com a formação de junções apertadas (tight junctions) entre os blastômeros. Essas junções unem as células frouxamente conectadas num tecido epitelial onde a blastocele é isolada do ambiente externo (Figura "Blástula de ouriço-do-mar " C). Dando prosseguimento a sua divisão, a camada celular é expandida e se afina. Durante esse período, a blástula permanece como uma camada unicelular grossa.
Duas teorias surgiram para explicar a concomitante proliferação de células e formação da blastocele. Dan (1960) conjeturou que o motivo maior dessa expansão é o influxo de água na cavidade da blastocele. Já que o blastômero secreta proteína na blastocele, seu fluido torna-se espesso. Esse fluido absorve grandes quantidades de água por osmose, exercendo pressão nos blastômeros para se expandirem. Essa pressão também alinha o longo eixo de cada célula para que a divisão nunca seja para dentro da blastocele. Isso criaria uma expansão adicional fazendo com que a população fosse orientada somente para um plano.
Wolpert e Gustafson (1961) e Wolpert e Mercer (1963) propuseram que a pressão da blastocele não é necessária para se conseguir esse efeito. Eles enfatizaram o papel da adesividade das células entre si e a camada hialina. Eles mostraram que enquanto permanecessem fortemente atracadas na camada hialina, as células não têm alternativa a não ser a de se expandir. Essa expansão cria a blástula ao invés do contrário. Certamente, a camada hialina é vital para expansão da blastocele, e se a adesão de células da camada hialina é inibida por anticorpos para a hialina, então a expansão da blastocele cessa (Adelson e Humphreys, 1988). Em um trabalho recente (Ettensohn e Ingersoll, 1992) concluíram que é provável que ambos mecanismos expandem a blastocele. Durante a clivagem precoce, a adesão à camada hialina parece ser o fator mais importante, enquanto que em estágios mais tardios, a pressão osmótica também parece exercer o seu papel.
As células da blástula desenvolvem cílios em sua superfície externa (Figura ), desse modo, causando a rotação da blástula dentro do envoltório de fertilização. Logo após, as células da parte animal do embrião sintetizam e secretam uma enzima de eclosão que lhes permite digerir a membrana fertilizante (Lepage et al., 1992), o embrião se torna uma blástula eclodida livre para nadar.
Scanning electron micrographs of the early events of development in Ophionereis schayeri. (a) Two-cell embryo. (b) Offset cleavage planes and asynchronous cleavage results in blastomeres of different sizes. (c) Wrinkled blastula with shallow wrinkled depressions (arrow). (d) Cracked open blastula with hollow blastocoel and ciliated epithelial cells. (e) Uniformly ciliated gastrula with vegetal blastopore (arrow). (f) Gastrula epithelium showing columnar cells with visible lipid droplets (arrowhead) and round cells (arrow). (g) Elongate gastrula with closed blastopore (arrow) and anterior stomodeal depression. (h) Early larva with a continuous ciliated band (arrowheads). (i) Side view of an early larva showing the prominent ventral ridge and the ciliated band (arrowheads) that bisects the larva into dorsal and ventral halves. Blastocoel, BL; cilia, C; dorsal, D; fertilization membrane, FM; stomodeal depression, S; ventral, V; ventral ridge, VR. Scale bars for a– e, g–i ϭ 50 m. Scale bar for f ϭ 10 m. (Selvakumaraswamy and Byrne, 2006).
Clivagem em anfíbios
A clivagem na maioria dos embriões de rãs e salamandras é radialmente simétrica e holoblástica, como na clivagem do equinodermo.
O ovo do anfíbio, no entanto, contém muito mais vitelo. Esse vitelo, que é concentrado no hemisfério vegetal, é um impedimento à clivagem.
Sendo assim, a primeira divisão começa no pólo animal e vagarosamente se estende até a região vegetativa (Figura abaixo).
Na salamandra axolotle, o sulco da clivagem se estende através do hemisfério animal a uma velocidade próxima de 1mm/min. O sulco da clivagem seciona o crescente cinzento e depois diminui para menos de 0.02-0.03mm/min ao se aproximar do pólo vegetal (Hara, 1977).
A figura "Micrografias ao microscópio eletrônico" A, é uma varredura no microscópio eletrônico, mostrando a primeira clivagem em um ovo de rã.
Micrografias ao microscópio eletrônico da clivagem de um ovo de rã. (A) Primeira clivagem. (B) Segunda clivagem (4 células). (C) Quarta clivagem (16 células), mostrando a discrepância de tamanho entre as células animais e vegetais aparecendo após a terceira divisão. (A de Beams e Kessel, 1976, cortesia dos autores; B e C cortesia de L. Biedler.)
Podemos notar as dobras nos sulcos da clivagem e a diferença entre os sulcos nos hemisférios animal e vegetal. A B mostra que enquanto o sulco da primeira clivagem ainda está tentando clivar o vitelo citoplasmático do hemisfério vegetal, a segunda clivagem já começou próxima ao pólo animal. Essa clivagem está em ângulos retos em relação à primeira, e é também meridional. A terceira clivagem, como era de se esperar, é equatorial. No entanto, por causa do vitelo vegetalmente colocado, esse sulco da clivagem em ovos anfíbios é muito mais próximo do pólo animal. Ele divide o embrião de rã em quatro blastômeros animais pequenos (micrômeros) e quatro grandes blastômeros (macrômeros) na região vegetal.
Essa clivagem holoblástica desigual estabelece duas regiões embrionárias principais: uma de divisão rápida de micrômeros, próxima ao pólo animal, e outra de macrômeros, mais lenta (C).
Assim que a clivagem progride, a região animal se torna abarrotada com numerosas células pequenas, enquanto a região vegetal contém uma pequena quantidade de grandes macrômeros carregados de vitelo (ver "Clivagem de ovo de rã). Embriões de anfíbios contendo de 16 a 64 células são freqüentemente chamados mórulas (do Latim “amora”, a qual sua forma lembra vagamente). No estágio de 128 células a blastocele se torna aparente e o embrião é considerado uma blástula.
Na realidade, a formação da blastocele foi traçada desde o primeiro sulco de clivagem.
Kalt (1971) demonstrou que na rã Xenopus laevis o primeiro sulco da clivagem se alarga no hemisfério animal para criar uma pequena cavidade intercelular que é isolada do ambiente externo por junções intercelulares muito apertadas (Figura abaixo).
Formação da blastocele num ovo de rã. (A) Primeiro plano de clivagem mostrando uma pequena fenda, que posteriormente se desenvolve na blastocele. (B) embrião de oito células mostrando uma pequena blastocele (flecha) na junção de três planos de clivagem. (de Kalt, 1971, cortesia de M. R. Kalt.)
Essa cavidade se expande durante clivagens subseqüentes para se tornar uma blastocele.
A blastocele provavelmente presta duas principais funções no embrião das rãs:
(1) é uma cavidade que permite migração celular durante a gastrulação, e
(2) previne células que estão abaixo interagir prematuramente com as células de cima.
Quando Nieuwkoop (1973) tirou células do topo da blastocele de um embrião de salamandra aquática e colocou-as junto a células do vitelo vegetal na base da blastocele, essas células animais se tornaram mesoderma ao invés de ectoderma.
Como o tecido mesodérmico é normalmente formado dessas células animais, que são adjacentes aos precursores do endoderma, parece plausível que células vegetais influenciam células adjacentes para se diferenciar em tecidos mesodérmicos.
Sendo assim, a blastocele aparece para prevenir o contato do endoderma com células destinadas para dar origem à pele e aos nervos.
Enquanto essas células estão dividindo-se, numerosas células com moléculas de adesão mantêm as células juntas. Uma das mais importantes dessas moléculas é a EP-caderina. O mRNA para essa proteína é fornecido no citoplasma do oócito, e se essa mensagem é destruída (injetando no oócito oligonucleotídeos antisense complementares para esse mRNA), a EP-caderina não é produzida e a adesão entre os blastômeros é dramaticamente reduzida (Heasman et al., 1994). Isso resulta na obliteração da blastocele (Figura Depleção da EP-caderina).
Clivagem Holoblástica Espiral
A clivagem holoblástica espiral é característica de organimos do filo dos Annelida ("vermes anelídeos"), platelmintos turbelários, vermes nemertinos e todos os moluscos, exceto cefalópodos.
Difere da clivagem radial em muitas maneiras.
Primeiro, os ovos não se dividem em paralelo ou em orientações perpendiculares ao eixo animal-vegetal do ovo.
A clivagem se dá de preferência, em ângulos oblíquos, formando a disposição “espiral” dos blastômeros filhos.
Segundo, as células se tocam entre si em mais lugares do que em embriões clivados radialmente. Na realidade, elas assumem o empacotamento com a orientação termodinamicamente mais estável, parecido com o de bolhas de sabão adjacentes (figura abaixo). (Explicadas magistralmentem no livro "On growth and form" por Sir Dárcy Thompson (Heisenberg, 2017) (vale muito a leitura dessa obra),
Diagrama mostrando o arranjo de quatro e oito bolhas de sabão num prato ligeiramente côncavo. O arranjo termodinâmico maximiza o contato e é muito reminiscente daquele de embriões que se clivam em espiral.
(Segundo Morgan, 1927.)
Terceiro, embriões de clivagem espiral normalmente realizam menos divisões antes de começar a gastrulação, tornando possível saber o destino de cada célula da blástula.
Quando os destinos das células individuais em embriões de anelídeos, platelmintos turbelários e moluscos foram comparados, as mesmas células foram vistas no mesmo lugar e o seus destinos, de uma maneira geral, foram idênticos (Wilson, 1898).
As blástulas então produzidas não têm blastocele e são chamadas de estereoblástulas.
Clivagem em espiral do molusco Trochus vista do pólo animal (A) e de um lado (B). Em B, as células derivadas do blastômero A estão coloridas. Os fusos mitóticos, esquematizados nos estágios precoces, dividem as células desigualmente e em ângulo aos eixos vertical e horizontal.
As figuras acima (clivagem espiral de...) e a figura abaixo retratam a clivagem de embriões de moluscos.
Clivagem espiral do caracol Ilyanassa. O blastômero D é maior que os outros, permitindo a identificação de cada célula. A clivagem é dextra. (A) estágio de 8 células. PB é o corpo polar. (B) Metade da quarta clivagem; os macrômeros já se dividiram em células grandes e pequenas orientadas espiralmente.
(de Craig e Morrill, 1986, cortesia dos autores.)
As duas
primeiras clivagens são quase meridionais, produzindo quatro grandes macrômeros
(marcados A, B, C e D). Em muitas espécies, os blastômeros são de tamanhos diferentes (D sendo o maior), uma característica que permite serem individualmente identificados.
Em cada sucessiva clivagem, cada macrômero origina um pequeno micrômero
no seu pólo animal. Cada quarteto sucessivo de micrômeros é deslocado para a direita
ou para a esquerda de seu macrômero irmão, criando um relacionamento espiral característico da clivagem.
Observando o embrião pelo pólo animal, as partes superiores
do eixo mitótico parecem alternar entre o sentido horário e o anti-horário. Isso faz
com que micrômeros alternados se formem obliquamente para a esquerda e para a
direita do seu macrômero.
Na terceira clivagem, o macrômero A dará origem a duas
células filhas, macrômero 1A e micrômero 1a. As células B, C e D se comportam
similarmente, produzindo o primeiro quarteto de micrômeros. Na maioria das espécies, os micrômeros estão à direita do seu macrômero (olhando para o pólo animal),
uma disposição indicando uma espiral dextra (oposta à sinistra). Na quarta clivagem, o macrômero 1A se divide para formar o macrômero 2A e o micrômero 2a; e o micrômero 1a se divide para formar mais dois micrômeros, 1a1 e 1a2 .
Mais clivagens irão produzir blastômeros 3A e 3a a partir do macrômero 2A; e micrômeros, como por exemplo o 1a2 , se dividem para produzir células tais como as 1a21 e 1a22 .
A orientação da clivagem plana para a esquerda ou para a direita é controlada por fatores citoplasmáticos dentro do oócito. Isso foi descoberto analisando mutações da espiral do caracol.
Alguns caracóis têm sua espiral aberta à direita da concha, enquanto outros têm sua abertura para à esquerda. Normalmente, a rotação da espiral é a mesma para todos os membros de uma determinada espécie.
Todavia, ocasionalmente, ainda são encontrados mutantes. Exemplificando, em espécies em que a espiral abre para a direita, serão encontrados alguns indivíduos com a abertura espiral para a esquerda. Crampton (1984) analisou os embriões desses caracóis aberrantes e observou que sua clivagem precoce difere da normal.
Olhando do pólo animal de caracóis enrolados para a direita e para a esquerda. A origem do enrolamento para direita e para a esquerda do caracol pode ser reconhecida pela orientação do fuso mitótico na segunda clivagem. Os caracóis sinistrogiros e dextrogiros se desenvolvem como imagens espelhares uma da outra. (Segundo Morgan, 1927.)
A orientação das células após a segunda clivagem estava diferente (Figura "Clivagem espiral do caracol Ilyanassa"),
graças a uma orientação diferente do aparelho mitótico nos caracóis com enrolamento
sinistrogiro. Todas as subseqüentes divisões em embriões de espiral para a esquerda
são imagens espelhares daqueles embriões com espirais dextras.
Na Figura (Olhando do pólo animal de caracóis, acima), podemos notar que a posição do blastômero 4d (o qual é muito importante, já que sua
progênie irá formar os órgãos mesodérmicos) é diferente nos dois tipos de espirais
dos embriões.
Geralmente, os dois caracóis são formados com seus corpos em lados
diferentes da abertura da espiral.
A direção da abertura na espiral da concha do caracol é controlada por um único
par de genes (Sturtevant, 1923; Boycott et al., 1930). No caracol Limnaea peregra a
maioria dos indivíduos são espiralados para a direita. Raros mutantes, exibindo abertura esquerda, foram encontrados e acasalados com caracóis tipo-selvagem.
Esses
cruzamentos mostraram que existe um alelo D “dextrogiro” que é dominante em
relação ao alelo d “sinistrogiro”.
No entanto, a direção da clivagem não é determinada
pelo genótipo do caracol em desenvolvimento, mas pelo genótipo da mãe do caramujo.
O caramujo fêmea do tipo dd pode produzir somente herdeiros de espiral sinistra, (i.e., voltadas para esquerda) mesmo quando o genótipo dos herdeiros é Dd. Um indivíduo Dd irá se espiralar tanto
para a direita quanto para a esquerda dependendo do genoma de sua mãe. Esses cruzamentos produzem o seguinte quadro:
Os fatores genéticos envolvidos no enrolamento do caracol são trazidos ao embrião no citoplasma do oócito. É o genótipo do ovário, no qual o fenótipo se desenvolve, que determina em que direção a clivagem vai ocorrer.
Quando Freeman e Lundelius (1982) injetaram no ovo de mães dd, uma pequena quantidade de citoplasma proveniente de caracóis com espirais dextras, os embriões resultantes apresentaram espirais para a direita.
Citoplasmas de caracóis com espiral esquerda não afetaram os embriões com a espiral direita. Isso confirma a observação que mães do tipo selvagem estavam colocando um fator em seus ovos que estava ausente ou defeituoso nas mães dd.
Outra descoberta emocionante com relação a clivagem dos moluscos está na comunicação entre os blastômeros. Nos moluscos de blastômeros de igual tamanho no estágio de quatro células, a determinação de que a célula que originará a célula precursora mesodérmica será alcançada entre a quinta e a sexta clivagem. Nessa altura, o macrômero 3D se estende para dentro entrando em contato com os micrômeros do pólo animal. Sem esse contato, a célula 4d produzida pelos macrômeros 3D não produz mesoderma (van den Biggelaar e Guerrier, 1979). Injetando corantes de baixo peso molecular, De Laat e colegas (1980) demonstraram que na hora do contato (e não antes), pequenas moléculas são capazes de difundirem-se entre os macrômeros 3D e os micrômeros centrais. Imagens ao microscópio eletrônico mostram que nesse momento, aparecem junções de fenda na superfície dessas células.
Evolução
Evolução causada pela alteração hereditária do desenvolvimento embrionário.
Às vezes, somos capazes de identificar uma modificação da embriogênese que impediu o organismo de sobreviver diferentcialmente em ambientes hostis.
Uma dessas modificações, descoberta por Frank Lillie em 1898, é causada pela alteração do padrão típico da clivagem espiral na família unionídeo das ostras (Bivalvia). Ao contrário da maioria das ostras, Unio e seus aparentados vivem em locais de água corrente. As correntes criam um problema para a dispersão das larvas, porque os adultos são sedentários e as larvas que nadam livremente seriam sempre carregadas correnteza abaixo. Essas ostras, no entanto, resolveram esse problema efetuando duas modificações no seu desenvolvimento.
A primeira altera a clivagem embrionária. Na típica clivagem dos moluscos, ou todos os macrômeros são iguais em tamanho, ou o blastômero 2D é a maior célula no estágio embrionário. No entanto, a divisão desse Unio é tal que o blastômero 2d fica com a maior parte do citoplasma (figura abaixo).
Formação de larvas gloquídia pela modificação da clivagem em espiral. Após formação do embrião de 8 células (A), a disposição do fuso mitótico motiva a maioria do citoplasma D penetrar no blastômero 2d (B). Esse blastômero grande 2d se divide (C), para finalmente originar a grande concha “armadilha de urso” da larva (D). (Segundo Raff e Kaufman, 1983.)
Essa
célula se divide para produzir a maior parte
das estruturas larvais, incluindo uma glândula capaz de produzir uma concha maciça.
Essas larvas (chamadas gloquídias) assemelham-se a pequenas armadilhas para
urso; possuem pêlos sensíveis que permitem as válvulas da concha fecharem-se
abruptamente quando tocadas pelas guelras ou barbatanas dos peixes que por ali
estiverem passando.
Elas “pegam uma carona” com o peixe (e de quebra se alimenta sugando o sangue oxigenado do peixe) até estarem prontas e cair (ou se largarem das brânquias) e, através de metamorfose, transformar-se em moluscos bivalves adultos. Dessa maneira,
podem se espalhar correnteza acima.
Em algumas espécies, as gloquídias são
liberadas da bolsa de criação da fêmea e
meramente aguardam um peixe passar. Outras espécies, tal como a Lampsilis ventricosa, aumentaram as chances de suas larvas encontrarem um peixe realizando outra
modificação no seu desenvolvimento
(Welsh, 1969).
Tdos os moluscos apresentam mando. Essa especie de Lampsilis sp desenvolvem um manto fino e saliente em volta da
concha circundando a bolsa de criação. Em
alguns unionídeos, a forma da bolsa de criação (marsúpio) e as ondulações do manto imitam o comportamento e a forma de pequenos peixes nadando.
(essa parte do manto imita a presa do peixe carnivoro que o molusco quer que leve seus filhos e os alimente rio acima) (Horowitz, 2015).
Para tornar a ilusão mais completa, desenvolveram uma
mancha preta em forma de olho (ocelo) de
um lado e uma nadadeira do outro. O “peixe” visto na figura 5.16 não é um peixe real,
mas sim a bolsa de criação e o manto abaixo
dela. Quando o peixe que estiver ao alcance
for atraído, o molusco despeja as gloquídias
da bolsa de criação. Dessa maneira, a modificação de padrões de comportamentos já
existentes permitiram moluscos unionídeos
sobreviver em ambientes hostis.
Armadilha para o peixe hospedeiro dos gloquidios,
desenvolvida pelo mexilião Lampsilis sp (Bivalvia: Unionidae)
Peixe falso sobre o molusco
unionídeo lampsilis ventricosa. O “peixe” é,
na verdade, a bolsa da cria e o manto do
molusco. (Fotografia, cortesia de J. H. Welsh.)
Ciclo de vida do mexilhão de agua doce parasita
EM CONSTRUÇÃO...
1. Quantidade de vitelo.
A quantidade de vitelo presente no citoplasma o óvulo apresenta um impedimento mecânico dificultando a clivagem total da célula. Este impedimento influenciará também na velocidade da clivagem tornando-a mais lenta quanto maior for a quantidade de vitelo presente.
Sendo a rapidez da clivagem, inversamente proporcional a quantidade de vitelo, mais vitelo mais lenta a clivagem; menos vitelo mais rápida é a clivagem.
2. Posição do fuso mitótico
A presença de fatores no citoplasma do
ovo, que influenciam o ângulo do fuso mitótico e
o tempo de sua formação.
A posição do plano de clivagem é perpendicular ao fuso mitótico.
E sua posição pode ser determinada por
proteínas de membrana e elementos ou fatores citoplasmáticos
(ponto preto)
O polo do ovo com maior quantidade de vitelo é denominado polo vegetal ou polo vegetativo.
O polo oposto, é chamado de polo animal, com baixa concentração de vitelo, e é onde se encontra o núcleo da célula.
Classificação do ovo
quanto à quantidade de vitelo
Desta forma podemos classificar o ovo observando a quantidade de vitelo e a forma com a qual este vitelo está distribuído, por isso, os ovos podem ser classificados em quatro grupos grandes grupos.
Ovo oligolécito ou isolécito
O ovo oligolécito ou isolécito possui pouco vitelo e este se encontra distribuído de forma relativamente homogênea no citoplasma da célula ovo. Ex.: ovo de equinodermos e mamíferos.
Ovo mesolécito ou heterolécito
Ovos mesolécitos ou heterolécitos apresentam uma quantidade considerável de vitelo, que se encontra distribuído de maneira heterogênea no citoplasma. Geralmente há um lado com maior quantidade vitelo, e este lado que possui maior quantidade de vitelo é chamado de polo vegetativo, enquanto o lado com menor quantidade de vitelo é chamado de polo animal. Ex.: ovos de anfíbios e peixes.
Ovo megalécito ou telolécito
O ovo megalécito ou telolécito apresenta uma grande quantidade de vitelo, que empurra o núcleo do gameta feminino para a região mais periférica e próxima à membrana plasmática região que é chamada de disco germinativo. Ex.: ovos de galinha e répteis.
Ovo centrolécito
O ovo centrolécito apresenta quantidade considerável de vitelo, que se localiza sobretudo na região central. Ex.: ovos de insetos.
Os tipos de óvulos de acordo com a quantidade de vitelo no citoplasma
Tipos de segmentação
Analisando-se os diferentes tipos de ovos, é possível observar dois tipos de segmentação: a segmentação holoblástica e a segmentação meroblástica.
A segmentação holoblástica pode ser ainda classificada em igual e desigual, e a segmentação meroblástica pode ser dividida em discoidal e superficial.
A segmentação holoblástica, também chamada de total, apresenta divisões em todo o ovo. Na segmentação holoblástica igual, que ocorre em ovos oligolécitos, observa-se uma divisão que forma blastômeros que apresentam relativamente o mesmo tamanho.
Na segmentação holoblástica desigual, que ocorre nos ovos mesolécitos, observa-se a formação de células pequenas (micrômeros) no polo animal e células maiores (macrômeros) no polo vegetativo (polo com maior quantidade de vitelo).
A segmentação meroblástica, também chamada de parcial, apresenta divisões apenas na região sem vitelo. Na segmentação meroblástica discoidal, que ocorre em ovos megalécitos, a divisão ocorre na região do disco germinativo.
Na segmentação meroblástica superficial, que ocorre nos ovos centrolécitos, percebe-se que a divisão (clivagem ou segmentação) acontece na região periférica do ovo.
Padrões de clivagem
O padrão de clivagem embrionária é determinado tanto pela posição dos fusos mitóticos quanto pela quantidade e distribuição de vitelo no ovo.
Uma quantidade grande de vitelo tende a inibir o clivagem, diminuindo a velocidade da mesma.
O vitelo é uma adaptação para animais que apresentam fecundação externa desenvolvimento indireto. Onde o embrião passa pela embriogênese sem receber nutrientes de fontes externas. Alguns animais, como o ouriço-do-mar, têm relativamente pouco vitelo porque se desenvolvem rapidamente em uma forma larval de natação livre que consegue nutrientes de seu ambiente.
Outros animais que apesar de apresentar fecundação interna, como marsupiais, nascem prematuramente, todavia recebem nutrição no marsúpio da mãe.
Os mamíferos placentários desenvolvem um órgão especializado (placenta) através do qual o embrião é nutrido, pela mãe, durante todo o desenvolvimento e, portanto, também possuem óvulos com pouco vitelo. Nunes et alii (2020).
O núcleo zigótico é geralmente deslocado em direção ao polo animal.
Zigotos com relativamente pouco vitelo (isolécitos e mesolécitos) apresentam clivagem do tipo holoblástica. O sulco de clivagem se estende por todo o ovo.
Enquanto os zigotos do tipo telolécito e centrolécitos sofrem clivagem meroblástica, onde o plano de clivagem se estende apenas à gema acumulada. Em ovos centrolécitos (muitos ovos de insetos) a clivagem é meroblástica e superficial, enquanto em ovos telolécitos (pássaros e peixes) a clivagem é discoidal.
Existem vários tipos de simetria de clivagem vistos na natureza: radial (equinodermos, anfíbios), espiral (moluscos, anelídeos), Bilateral (ascídias, tunicados), Rotacional (mamíferos). As duas figuras abaixo mostram exemplos de simetrias de clivagem holoblástica e meroblástica.
A clivagem em anfíbios é holoblástica com simetria radial, entretanto o grande volume de vitelo (óvulo mesolécito ou heterolécito) interfere na clivagem. No pólo animal, a primeira clivagem ocorre em cerca de 1 mm / min, enquanto no pólo vegetal ocorre 50-100 vezes mais devagar (0,02 mm / min). Enquanto a primeira clivagem ainda está incompleta na região vegetativa do óvulo, a segunda clivagem meridional começa a ocorrer
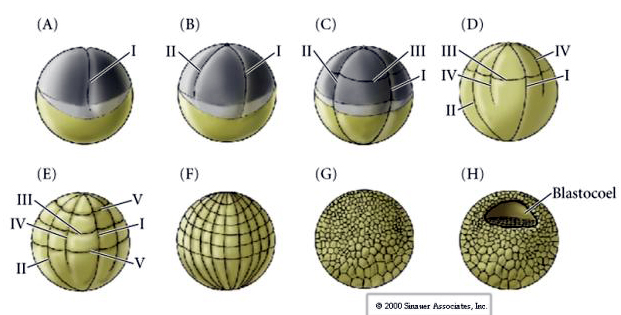

Clivagem num ovo de anfíbio
A terceira clivagem é equatorial, mas como os núcleos e asters estão deslocados “para os animais”, o plano de clivagem, embora perpendicular ao eixo animal vegetal, também é deslocado em direção ao pólo animal e não divide igualmente os blastômeros. O resultado são quatro blastômeros animais menores (denominados micrômeros) e quatro grandes blastômeros polares vegetais (denominados macrômeros).
Essa clivagem holoblástica desigual dá origem a um polo animal de divisão mais rápida, composto de micrômeros menores, e a um polo vegetal de divisão mais lenta, composto de macrômeros. O polo animal logo é composto de muitos micrômeros pequenos e o polo vegetal alguns macrômeros grandes cheios de vitelo. Embora a formação da blastocele comece com a primeira clivagem, ela não se torna óbvia até o estágio de 128 células.
O zigoto sofre rápidas divisões mitóticas também chamado de segmentação ou clivagem, sem que haja um aumento do volume celular, i.e., sem que haja a fase de crescimento ciclo celular.
Sucessivas divisões mitóticas do zigoto, inicia-se logo após a fecundação. e caracteriza-se por um rápido aumento do número de células por divisão mitótica. As células embrionárias resultantes são chamadas de blastômeros.
Na espécie humana este processo ocorre quando o zigoto ainda está dentro da zona pelúcida e sua divisão em blastômeros acontece cerca de 30h após sua formação.
Após o estágio de 8 células, os blastômeros mudam sua forma e se agrupam.
Esse processo é chamado de Compactação. Esse processo é provavelmente mediado por glicoproteínas de adesão.
Após o estágio de oito células, os blastômeros iniciam a compactação, por meio de moléculas de adesão e formam uma “bola” de células.
Quando possuir entre 12 a 32 blastômeros, o zigoto é chamado de mórula, que chegará ao útero próximo ao quarto dia de desenvolvimento.
Compactação
Permite maior interação célula-célula
Contribui para coesão, comunicação e a cooperação entre as células.
Pré-requisito para a segregação de células internas.
É formada por junções gap, junção de adesão e junções de oclusão que ocorrem nos blastômeros externos.
Para isto entram em cena as junções que do ponto de vita funcional podem ser classificadas em três tipos: junção de adesão, junções impermeáveis, junções de comunicação.
Junções de adesão
São também chamadas de junções aderentes, zônulas de adesão. Os hemidesmossomos e os desmossomos também são estruturas de adesão.
Junções impermeáveis
As junções impermeáveis são chamadas também de zônulas de oclusão.
Junções de comunicação
As junções de comunicação, chamadas também de junções apertadas (tight junction), junções ocludentes, junções comunicantes ou junções gap. Todas estas junções entram em atividade na construção da mórula.
Tipos de junções entre membrans plasmáticas de células adjacentes
(Fonte: Mariana R. L., Public Domain)
Mórula e Blástula
O desenvolvimento inicia-se com a divisão do zigoto e a formação, através de mitoses sucessivas, de células chamadas de blastômeros.
Essa divisão inicial através da mitose produz células totipotentes. Essa divisão inicial é chamada e conhecida por segmentação ou clivagem.
Em humanos o estágio de de 12-32 células. Forma-se cerca de 3 dias após fecundação. Alcançando o útero cerca de 4 dias após a fertilização.
No caso dos ouriços do mar a formação da mórula é mais rápido.
Durante as rodadas de clivagem consecutivas, respectivamente de 2, 4, 8, 16, 32, 64, 128 e finalmente termina na fase de mórula. Depois de um tempo, fica difícil distinguir cada célula. O estágio pluricelular (aqui mostrado são provavelmente 128 blastômeros, figura abaixo) constituindo uma mórula. Neste estágio, o citoplasma do ovo fertilizado é completamente divido entre os vários blastômeros. Observe que esse grupo de células embrionárias tem aproximadamente o mesmo tamanho que o óvulo fertilizado original! O que ocorreu foram divisóes celulares sem o estágio de crescimento do ciclo celular.
Mórula, mostrando blastômeros a zona pelúcida.
Exemplar fossilizado da formação Doushantuo proveniente da China, datados com idade entre 590-565 mya.
A formação Doushantuo, na provincia de Guizhou é datada entre 590-565 mya. Este é um período famoso após a glaciação mundial chamada de "Terra bola de neve" "Snowball Earth" e antes do início do Cambriano. É conhecido biocronologicamente como Ediacara e é caracterizado por fósseis enigmáticos que mostram apenas ligações provisórias com os filos cambrianos posteriores. Outros fósseis ediacaranos são idiossincráticos e talvez não tenham sobrevivido em biotas posteriores.
Estágio de mórula em ouriço do mar, (A) com 32 células e (B) com 128 céulas.
(Fonte: vcbio. Science)
Clivagem precoce em Lytechinus variegatus.ouriço-do-mar. (A) Estágio de duas células. (B1) Vista Polar do estágio inicial de quatro células. (B2) Visão lateral do estágio final de quatro células. (C) Vista Lateral do estágio inicial de oito células. (D) Visão lateral do estágio final de 16 células. Abreviaturas: as = aster; bpm = membrana plasmática do blastômero; fe = envelope de fertilização (zona pelúcida); mac = macrômeros; mes = mesômeros; mic = micrômeros; n = núcleo; sp = fuso.
Essas divisões mitóticas sucessivas e rápidas, se iniciam, no caso dos humanos, algumas horas (até 30 horas após a fecundação) e provocam um aumento do número de blastômeros (células) rapidamente.
A rapidez da clivagem é inversamente proporcional à quantidade de vitelo presente no ovo. Quanto maior maior a quantidade de vitelo mais lento ocorrerá a clivagem e quanto menor a quantidade de vitelo maior será a velocidade da clivagem e todo o processo.
As células resultantes da clivagem são chamadas de blastômeros. A cada divisão formam-se blastômeros menores.
Quando existirem oito blastômeros, os mesmos mudam sua forma e se unem, no processo de compactação, formando uma estrutura compacta de células. Essa proximidade das células permite a formação da massa celular interna (MCI).
Formação do blastocisto de camundongo. No estágio de oito células, o embrião se compacta para produzir uma mórula (A). Após a próxima divisão celular, o embrião começa a produzir uma cavidade ou blastocele e forma um blastocisto no estágio de 32 células (B). Duas populações de células emergem durante a formação do blastocisto. As células internas da mórula (brancas) tornam-se a massa celular interna (ICM), um grupo de células-tronco pluripotentes excentricamente posicionadas dentro do blastocisto. As células da camada externa da mórula (cinza) formam o primeiro epitélio, o trofectoderma, que se diferencia nas linhagens trofoblásticas da placenta. O blastocisto se expande por acúmulo de líquido adicional dentro da blastocele e eclode livre da zona pelúcida (C). No camundongo, as células trofectoderme polares em contato com o MCI proliferam, enquanto as células trofectoderma murais restantes se diferenciam em células trofoblásticas gigantes. (Armant, D.R.2006).
Formation of the mouse blastocyst. At the eight-cell stage, the embryo compacts to produce a morula (A). After the next cell division, the embryo begins to produce a cavity or blastocoel and forms a blastocyst by the 32-cell stage (B). Two populations of cells emerge during blastocyst formation. The inside cells of the morula (white) become the inner cell mass (ICM), a group of pluripotent stem cells eccentrically positioned within the blastocyst. Cells in the outer layer of the morula (gray) form the first epithelium, the trophectoderm, which differentiates into the trophoblast lineages of the placenta. The blastocyst expands by accumulating additional fluid within the blastocoel and hatches free of the zona pellucida (C) . In the mouse, polar trophectoderm cells contacting the ICM proliferate, while the remaining mural trophectoderm cells differentiate into trophoblast giant cells.
Desenvolvimento embrionário normal de embriões de bovinos.
1) Não fertilizado, 2) duas (2) células a 12 células, 3) Mórula precoce, 4) Mórula,
5) Blastocisto precoce, 6) Blastocisto, 7) Blastocisto expandido, 8) Blastocisto eclodido, 9) Blastocisto eclodido expandido.
(a) Comparison of developmental stages of in vivo-derived bovine embryos collected on days 6–8 after estrus. At day 7, a stage code 1 embryo is considered an unfertilized ovum and a stage code 2 embryo is considered dead or degenerate. (b) Expanded hatched blastocyst typically recovered on or after day 8 after estrus; note the empty zona pellucida on the right and the expanded embryo on the left. (Jahnke, West & Young, 2010)
Por volta de três dias após a fecundação forma-se a mórula, que é o primeiro estágio do desenvolvimento.
A mórula é constituída de 12 a 32 blastômeros, sendo formada por uma camada interna que é chamada de massa celular interna, e uma camada externa é circundada por uma outra camada, que é a camada celular externa.
Por todo reino animal (reino metazoa) existe uma incrível variedade de tipos embrionários, mas a maioria dos padrões de embriogênese compreende variações em quatro temas:
1 Tema
Ocorrência de clivagem imediatamente após a fertilização e formação da mórula.
Clivagem é uma série de divisões mitóticas extremamente rápidas, onde o enorme volume citoplasmático do zigoto é dividido em numerosas células menores. As céluls se dividem sem que haja a fase de crescimento do ciclo dcelular. Desta fomr aos blastômeros resultantes são cada vez menores.
Clivagem em ouriço do mar
Clivagem e formação da mórula
Essas células são chamadas blastômeros e, ao fim da clivagem, eles geralmente formam uma esfera maciça conhecida como mórula.
A compactação celular que se observa facilita a comunicação entre as células da mórula. Então, podemos dizer que a clivagem cria a multicelularidade.
Blástula e formação da gástrula ((Soares, 2020, Wikipedia)
Trofloblasto no blasticisto estágio de blástula.
(Soares, 2020, ver tb vcbio.science.ru.nl)
Formação e arquitetura de blastocisto
A informação espacial desempenha um papel crítico na formação do blastocisto. Durante o desenvolvimento pré-implantação, o trofectoderma se diferencia das células que revestem a parte externa da mórula compactada (Fig. 1). Pistas de desenvolvimento obtidas pela presença ou ausência de contatos celulares assimétricos determinam o destino da célula após a compactação (1). As células externas se diferenciam em trofectoderma, o primeiro epitélio e precursor de todas as linhagens trofoblásticas, enquanto as células internas tornam-se a massa celular interna pluripotente (ICM). Durante a diferenciação do trofectoderma, junções estreitas se formam entre os blastômeros externos e eles começam a transportar ativamente o fluido para o embrião, gerando uma blastocele.
À medida que o blastocisto se forma, o trofectoderma é alongado e o agrupamento de células que forma o MCI fica confinado a um setor da parede do trofectoderma (2). O trofoblasto se origina da camada trofectoderme do blastocisto durante o desenvolvimento da peri-implantação. Portanto, muito pode ser aprendido sobre o desenvolvimento de trofoblasto por meio da cultura de blastocistos in vitro. O blastocele separa fisicamente algumas das células do trofectoderma do ICM e, assim, fornece pistas espaciais para a diferenciação do trofectoderma mural. A trofectoderme polar compreende as células externas que contatam diretamente a ICM (3). Sob a direção da ICM, as células da trofectoderme polar proliferam rapidamente até se deslocarem para dentro da trofectoderme mural, onde a divisão celular diminui consideravelmente (4,5).
No camundongo, as células trofectoderme mural endoreduplicam seu DNA e se diferenciam em células trofoblásticas gigantes invasivas.
Estrutura do blastocisto
1. A camada que o reveste, chamada de trofectoderma. Suas células vão originar o trofoblasto, responsável pela implantação do embrião no útero, por sua nutrição e pelo desenvolvimento da placenta e os outros anexos embrionários e fetais.
2. A massa celular interna (MCI), o embrioblasto, com suas células agregadas em um polo do embrião. Esse conjunto de células vão dar origem ao embrião em si.
3. A blastocele, uma cavidade contendo líquidos nutritivos para o embrião e que faz parte da formação dos celomas embrionários (Soares, 2020).
(Fonte: Bioug)
(Fonte: Bioug)
Morphogenetic behavior of the micromere-PMC lineage during early sea urchin embryo development (Schoenwolf, 2001). (A) Micromeres (red) are formed in the fourth, unequal cleavage. (B) Subsequent divisions result in 32 PMCs at the vegetal pole of the hollow blastula. (C) PMCs then ingress into the mesenchyme blastula (MB) in an epithelialmesenchymal transition. (D and E) PMCs show directional migration, forming two ventrolateral clusters (VLCs) and a stereotypical pattern of strands in the late gastrula (LG). Cell-cell fusion leads to the formation of two syncytial masses. Synthesis of the endoskeleton inside each syncytium commences with the formation of a calcareous granule that grows into the triradiate spicule rudiments. (Moreno et alii, 2019).
Schematic overview of sea urchin development showing the origin and fate of selected cell populations. (A) Fertilized egg or zygote, hemisection. (B) 16- cell stage, surface view. (C) 64-cell stage, surface view. (D) Mesenchyme blastula or early gastrula, hemisection. (E) Late Gastrula, hemisection. (F) Prism, hemisection. (G) Early pluteus larva, hemisection. Light dots = ectoderm. Heavy dots = endoderm, coelomic mesoderm, and secondary mesenchyme. Stippling = primary mesenchyme. Abbreviations: a = animal pole; an = anus; an1 = first tier of animalized blastomeres; an2 = second tier of animalized blastomeres; ar = archenteron; at = apical tuft of cilia; bc = blastocoel; bp = blastopore; br = body rod; ci= cilia; es = esophagus; in = intestine; m1 = primary mesenchyme; m2 = secondary mesenchyme; mac = macromeres; mes = mesomeres; mic = micromeres; mo = mouth; poa = postoral arm; por = postoral rod; pra = preoral aram; prr = preoral rod; sp = spicule; sr = skeletal rod; st = stomodaeum; sh = stomach; tr = transverse rod; v = vegetal pole; vegl = first tier of vegetalized blastomeres; veg2 = second tier of vegetalized blastomeres. prr = preoral rod; sp = spicule; sr = skeletal rod; st = stomodaeum; sh = stomach; tr = transverse rod; v = vegetal pole; vegl = first tier of vegetalized blastomeres; veg2 = second tier of vegetalized blastomeres. (Conway. C; Conway. A, Igelsrud, s/d).
QUAL A FUNÇÃO DO BLASTOCELE?
A blastocele separa espacialmente as células para que não se toquem. As células no teto do blastocele normalmente se tornam ectoderma. Se você transplantar células do teto da blastocele próximo às células vitelinosas na base da blastocele, elas se diferenciarão como mesoderme. Os derivados mesodérmicos são normalmente produzidos a partir de células adjacentes aos precursores endodérmicos.
Uma possibilidade que exploramos a fundo é que as células do polo vegetativo “induzam”, por meio de interações célula-célula, as células adjacentes a se tornarem mesodérmicas. Assim, a formação do blastocele pode ser necessária para evitar interações "indutivas" inapropriadas entre as células iniciais do blastocisto.
A segunda necessidade óbvia para a blastocele pode ser durante o estágio subsequente de desenvolvimento, gastrulação, onde as células migram para o interior da blastocele e se diferenciam. (Bastiani)
Os mamíferos, por possuírem placenta que lhes fornece alimento e oxigênio durante a gestação, possuem ovo do tipo oligolécito, em que há vitelo escasso, sendo este distribuído de forma homogênea. Desta forma, a clivagem é do tipo holoblástica, i.e., o sulco de clivagem ocorre por todo o ovo.
O ovo dos mamíferos sofre clivagens lentas durando, cada divisão, cerca de 12 a 24 horas; a primeira ocorre enquanto o zigoto caminha pela tuba uterina em direção ao útero.
Quanto ao plano de divisão, essa primeira divisão é meridional e origina dois blastômeros.
A segunda divisão, uma célula (blastômero) se divide meridionalmente enquanto a outra, equatorialmente, para dar origem a quatro blastômeros, ou seja, tem padrão rotacional. Portanto, mamíferos possuem ovos oligolécitos com clivagem do tipo holoblástica rotacional. (Nunes et alii, 2020)
Seguem-se as contínuas divisões mitóticas e reorganização celular, ficando uma pequena população dos blastômeros mais internamente localizada, chamada de MCI ou massa celular interna, circundada por uma camada externa de várias células que constituirão a trofecderme ou blastoderme (torfectoderme).
Por um processo denominado cavitação, há o surgimento de uma cavidade interna cheia de líquido, denominada de blastocele. Esse estágio é chamado de blástula, ou blastocisto (termo mais usado para humanos).
Após a redução na taxa de divisão mitótica, os blastômeros passam por mudanças dramáticas quanto às suas posições, um em relação ao outro. Essa série de redistribuição de células é chamada de gastrulação.
Como resultado da gastrulação, o embrião típico apresentará três regiões celulares chamadas de camadas germinativas ou folhetos germinativos*. O ectoderma, a camada exterior, o endoderma, camada interior, e o mesoderma, a camada intermediária.
*Do Latim germen, significa “broto” ou “rebento” (a mesma raiz da palavra germinação). Os nomes dos três folhetos germinativos são do Grego: ectoderma de ektos (fora) mais derma (pele); mesoderma de mesos (meio) e endoderma de endon (dentro).
O ectoderma, a camada exterior, produz as células da epiderme e do sistema nervoso.
O endoderma, camada interior, produz o revestimento do sistema digestório (tubo digestivo) e órgãos associados (pâncreas, fígado, pulmões, etc.).
E o mesoderma, camada intermediária (do meio), dará origem a diversos órgãos
(coração, rins, gônadas), tecidos conjuntivos (ossos, músculos, tendões, vasos sangüíneos) e células sangüíneas.
3) Uma vez que as três camadas embrionárias estão estabelecidas, as células
interagem umas com as outras e se reorganizam para produzir tecidos e órgãos.
Esse processo é chamado organogênese. Nos cordados em geral e nos vertebrados, a organogênese é iniciada quando uma série de interações celulares induzem as células ectodérmicas da porção mediana do dorso a formar o tubo neural oco dorsal. Esse tubo originará o cérebro (sistema nervoso) e a medula espinhal. Muitos órgãos contêm células de mais de um folheto ou camada embrionária, e não é incomum o exterior de um órgão ser derivado de um determinado folheto e o interior de outro. Também durante a organogênese, algumas células sofrem longas migrações de seu lugar de origem até sua localização final.
Essas células migrantes incluem os precursores das células sangüíneas, células linfáticas, células pigmentadas e gametas.
A maior parte dos ossos de nossa face são provenientes de células que migraram ventralmente da região dorsal da nossa cabeça.
4. Como observado na Figura 1.1, em muitas espécies, uma parte especializada
do citoplasma do ovo dá origem às células que são precursoras dos gametas.
Essas células são chamadas de células germinativas, sendo destinadas à função reprodutiva. Todas as outras células do corpo são chamadas células somáticas. Essa separação entre células somáticas (que dão origem a um corpo individual) e células germinativas (que contribuem para a formação de uma nova geração) é freqüentemente uma das primeiras diferenciações que ocorrem durante o desenvolvimento animal. As células germinativas finalmente migram para as gônadas, onde se diferenciam em gametas. O desenvolvimento de gametas, chamado de gametogênese, normalmente não é completado até que o organismo tenha se tornado fisicamente maduro. Na maturidade, os gametas podem ser liberados e participar de uma fertilização dando início a um novo embrião. O organismo adulto finalmente sofre envelhecimento e morre.
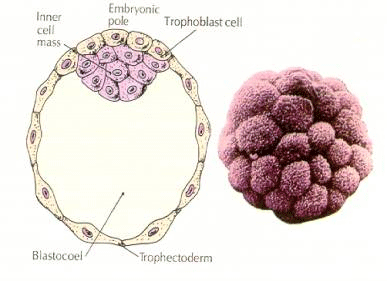
Blástula ou blastocisto (esquerda esquema mostrando as partes, a direita foto colorida artificialmente). (Fonte: bastiani.biology)
Desenvolvimento de anfíbio
Trofoblasto
O trofoblasto é camada celular externa do blastocisto, contribui somente para formação da placenta.
Embrioblasto
Embrioblasto
Conjunto de células internas (MCI, massa celular interna) que contribuem para formação do embrião e das membranas extraembrionárias O embrioblasto forma o disco bilaminar composto de:
Epiblasto
Epiblasto
O epiblasto é conjunto celular mais interno do embrioblasto.
Hipoblasto
Hipoblasto
O hipoblasto constitui a camada celular inferior do embrioblasto, somente participará na formação de membranas extraembrionárias (saco vitelínico).
Na nidação ocorre a penetração gradual do blastocisto no endométrio, a proliferação do citotrofoblasto e transformação em sincíciotrofoblasto, o embrioblasto forma disco bilaminar: epiblasto e hipoblasto, e ocorre o aparecimento da cavidade amniótica por cavitação no epiblasto.
O endométrio (decídua), onde o blastocisto irá nidar, é a camada interna do útero, rica em glândulas e vasos sanguíneos, prolifera durante ciclo ovariano representa contribuição materna da placenta.
Citotrofoblasto: camada celular proliferativa do trofoblasto.
Sincíciotrofoblasto: camada externa do trofoblasto, altamente ativa em síntese protéica (enzimas proteolíticas); cresce por meio do citotrofoblasto, células perdem separação por membranas e tornam-se sinciciais, i.e. citoplasma comum multinucleado. O citotrofoblasto e sincíciotrofoblasto são os elementos embrionários da placenta.
Blastocisto implantado no endométrio (9dias)
Implantação completa do blastocisto no endométrio, formação de lacunas no sincíciotrofoblasto, a expansão do hipoblasto sobre face interna do trofoblasto resulta no saco vitelínico primário, absorção da secreção de glândulas uterinas.
Âmnio
O âmnio é uma membrana extraembrionária que delimita a cavidade ou câmara amniótica cuja função é a proteção contra desidratação e proteção contra choques mecânicos. Constitui-se em uma adaptação ao desenvolvimento embrionário em condições terrestres em vertebrados. O âmnio surgiu nos répteis cujos embriões se desenvolviam fora do corpo materno, dentro do ovo âmniótico-alantoidiano ou reptiliano. Animais que possuem âmnio são chamados de amniotas e aqueles que não possuem âmnio são chamados de anamniotas.
Cavidade amniótica
É a câmara protetora do embrião, preenchida com líquido amniótico.
Saco vitelínico
O saco vitelínico é primeiro anexo embrionário a aparecer. É gerado a partir do hipoblasto (em aves e répteis e mamíferos monotremadas (aplacentários) o saco vitelínico contem grande quantidade de vitelo. Em mamíferos placentários (Eutheria), apresenta muito pouco vitelo ou sem vitelo. Representa um vestígio evolutivo, com funções importantes na formação do embrião.
Embrião de 12 dias
Enzimas do sincíciotrofoblasto abrem vasos sanguíneos maternos, sangue flui para lacunas do trofoblasto. Ocorre a expansão de mesoderma extraembrionário, espaço entre citotrofoblasto e saco vitelínico é preenchido por mesoderma extraembrionário. Ocorre a formação de cavidades (celomas) no mesoderma extraembrionário.
Córion (placa coriônica)
Revestimento externo dos celomas extraembrionários, colado internamente ao trofoblasto; passa por vascularização.
Pedúnculo placentar
É o pedúnculo de mesoderma extraembrionário condensado no polo posterior ao epiblasto, cuja função é fixar o embrião á placenta e formar o futuro cordão umbilical.
Alantóide
O alantoide é uma bolsa que surge do endoderma extraembrionário. Logo, seu exterior é revestido de mesoderma e, tal como a vesícula vitelina, está ligado ao intestino do embrião. A função do alantoide é armazenar as excretas.
Os excretas são resíduos metabólicos das substâncias produzidas durante o desenvolvimento do embrião. O alantóide invade o pedúnculo e conecta-se com placa coriônica (córion-alantóide).
Em aves desenvolve-se como broto do intestino posterior que se expande no celoma extraembrionário. É importante no processo da vascularização do trofoblasto, vasos da circulação embrionária na placenta.
Função excretora do alantóide
Em embriões de répteis e aves é no alantóide que são armazenados os produtos da excreção nitrogenada, representados sobretudo pelo ácido úrico, substância esbranquiçada e pouco solúvel em água, menos tóxica que a amônia dos peixes e a uréia dos mamíferos.
Ver também
PAGINAS 22 A 34
Gastrulação
Não é o nascimento, casamento ou a morte mas a gastrulação o tempo mais importante de sua vida. (Lewis Wolpert) (Shaw s/d).
Gastrulação em organismos protostômios e deuterostômios
Gastrulação é o processo de movimentos de células e tecidos altamente coordenados pelo qual as células da blástula são rearranjados e ganham novas posições, estruturando um plano corpóreo de duas ou três camadas do organismo.
É o processo pelo qual o disco embrionário bilaminar se transforma em trilaminar. A gastrulação é o início da morfogênese.
Ocorre durante a 3ª semana do desenvolvimento humano.
Durante a gastrulação são formados a linha primitiva, as camadas germinativas ou folhetos embrionários a notocorda.
A notocorda define o eixo primitivo do embrião, forma o tubo neural dorsl oco, serve de base para a formação dos ossos da coluna vertebral, da cabeça, o esqueleto axial, e indica o local dos futuros corpos vertebrais.
A linha primitiva estabelece o plano básico do corpo nos vertebrados: eixo central (linha média), simetria bilateral, superfícies ventrais e dorsais e extremidades cefálica e caudal. O nó primitivo ou nó de Hensen define a direção cefálica.
Este processo determina os eixos anteroposterior (AP), dorsoventral (DV), e esquerdo-direito (ED) e também especifica as camadas ou folhetos germinativos, ectoderme, mesoderme e endoderme (nos organismos triblásticos), as quais darão origem a diferentes órgãos e tecidos.
Durante a gastrulação células do ectoderma migram pelo nó e fosseta primitiva formando o endoderma, notocorda e o mesoderma intra-embrionário.
A ectoderme é a camada mais externa e dá origem a epiderme e seus anexos (pelos e glândulas) e ao sistema nervoso (cérebro, medula, nervos e gânglios), mucosa bucal, mucosa anal, mucosa vaginal e esmalte dos dentes.
A mesoderme dá origem ao sistema esquelético, muscular, circulatório e urinário, cartilagens, sangue, vasos sanguíneos, dentina e polta dos dentes.
A endoderme, é a camada mais interna, dá origem ao sistema digestório e anexos, aos revestimentos epiteliais das passagens respiratórias e do trato gastrointestinal, incluindo as glândulas desse trato e as células glandulares dos órgãos associados, como fígado e pâncreas.
Movimentos celulares durante a gastrulação
Os movimentos celulares que ocorrem durante a gastrulação são gerados por alterações do citoesqueleto e da afinidade de cada célula com a lâmina basal e com células adjacentes.
Eles envolvem o embrião inteiro e, as migrações celulares em uma parte do organismo gastrulante, devem estar intimamente coordenadas com outros movimentos ocorrendo simultaneamente.
Mesmo que o padrão de gastrulação seja extremamente variado em todo o reino animal, relativamente poucos mecanismos estão envolvidos. A gastrulação, geralmente, envolve os seguintes tipos de movimentos:
Embolia ou Invaginação
O dobrar para dentro de uma região de células, de maneira semelhante à cavidade formada quando se empurra com o dedo a superfície de uma bola de borracha macia.
Involução
A internação ou movimento de interiorizarão de uma camada externa em expansão, de modo a se espalhar na superfície interna das células externas remanescentes.
Ingressão
A migração de células individuais da camada superficial para o interior do embrião.
Delaminação
A separação de uma camada celular em duas ou mais camadas mais ou menos paralelas.
Epibolia
O movimento de camadas epiteliais (usualmente de células ectodérmicas) que se espalham como uma unidade e não individualmente, para envolver as camadas mais profundas do embrião.
Gastrulation, Mesoderm Formation, and Neurulation in the Lancelet Amphioxus, a Non-vertebrate Chordate. In these classic descriptions (by Edwin Grant Conklin and Berthold Hatschek), the formation of tissue layers in a non-yolky chordate egg is clearly seen. Bottom row depicts sections of embryos cut at right angles to those in the top row. (Gastrulation)
NEURULAÇÃO
ORGANOGÊNESE
Nêurula
Gastrulação
Movimentos celulares que estabelecem os folhetos embrionários no início da embriogênese:
Ectoderma
Folheto embrionário mais externo gera epiderme, tubo neural dorsal, sistema nervoso central e derivados da crista neural
Mesoderma
Folheto embrionário intermediário, gera esqueleto cartilaginoso e ósseo, musculatura, tecidos conjuntivos, sistemas cardiovascular e urogenital.
Endoderma
Folheto embrionário mais interno gera revestimento interno do trato intestinal e participa de órgãos anexos, pulmão, fígado, pâncreas.
NEURULAÇÃO
A neurulação é o processo que envolve a formação da placa neural e das pregas neurais e o fechamento dessas pregas para formar o tubo neural dorsal oco que dará origem ao sistema nervoso.
Formação da placa neural e tubo neural dorsal
A notocorda em desenvolvimento induz a formação da placa neural.
No 18º dia inicia a invaginação da placa neural formando um sulco neural mediano, com as pregas neurais de ambos lados (proeminentes na região cefálica, primeiros sinais de desenvolvimento do encéfalo.
No fim da terceira semana ocorre aproximação das pregas neurais, que começam a fundir-se, formando o tubo neural dorsal oco.
Nos humanos A formação do tubo neural começa no início da 4ª semana (dias 22 a 23) e termina no final da 4ª semana, quando ocorre o fechamento do neuróporo caudal (posterior).
O tubo neural se fecha primeiramente na região medial do embrião.
As extremidades abertas são os neuróporos rostral e caudal.
O neuróporo rostral se fecha no dia 25 e o caudal no dia 27.
O fechamento dos neuróporos coincide com o estabelecimento da circulação vascular no tubo neural.
Formação da placa neural
Embrião humano de 17 dias
Embryonic disk viewed dorsally.
The red arrows show schematically the migration directions of the epiblast cells to their points of final destination.
1. Paraxial mesoderm
2. Intermediate mesoderm
3. Lateral mesoderm
4. Notochord
5. Amnion
6. Intraembryonic coelom
7. Endoderm
8. Ectoderm
9. Somatopleural (mesoderm and ectoderm)
10. Splanchnopleural (mesoderm and endoderm)
11. Neural groove
12. Neural ridge
In the bilaminar stage:
The dorsal germinal layer = epiblast.
The ventral germinal layer = hypoblast.
In the trilaminar stage, the nature of the germinal layers changes as soon as the mesoblast has taken up its position.
The dorsal germinal layer becomes the ectoblast/-derm.
The middle germinal layer (3rd germinal layer) becomes the mesoblast/-derm.
The ventral germinal layer receives the name endoblast/-derm.
Summary of cell fates:
The epiblast cells form the ectoblast, the mesoblast (or chorda-mesoblast) and the intraembryonic endoblast.
The hypoblast cells give rise to the extraembryonic endoblast (the umbilical vesicle and the allantois).
VEJA AS FASES DO DESENVOLVIMENTO NO LINK:
Neuroepitélio do tubo neural: Zona ventricular: origina todas as células nervosas (ficam células neuroepiteliais indiferenciadas)
Zona intermediária: entre a zona ventricular e marginal (células neuroepiteliais diferenciadas em neuroblastos)
Zona marginal: composta da parte externa das células neuroepiteliais (axônios).
Origem das células neurais
Os neurônios unipolares dos gânglios espinhais derivam das células da crista neural. Inicialmente são bipolares, depois seus prolongamentos se unem, formando um T.
O processo periférico dos gânglios espinhais vão para as terminações sensitivas das estruturas somáticas ou viscerais.
O processo central penetram na medula espinhal e constituem as raízes dorsais dos nervos espinhais.
Na neurulação ocorre a formação e fechamento das pregas neurais e formação de segmentos, chamados de somitos que ocorre em paralelo no ectoderma (tubo neural dorsal) e no mesoderma paraxial (somitos).
Fechamento das pregas neurais e formação dos somitos
Veja o vídeo sobre formação da nêurla
Desenvolvimento da medula espinhal
As paredes do tubo neural se espessam reduzindo o espaço interno do tubo gradualmente até restar o canal central da medula espinhal.
O espessamento diferencial da medula espinhal, produz o sulco limitante. Este sulco separa a parte dorsal, a placa (lâmina) alar, da parte ventral, a placa (lâmina) basal.
Os corpos celulares das placas alares formam os cornos dorsais (cinzentos), núcleos aferentes, sensitivos.
Os corpos celulares das placas basais formam as colunas cinzentas, ventrais, e laterais, cornos ventrais e laterais. Os axônios do corno ventral formam as raízes ventrais do corno espinhal, eferentes, motoras.

Os corpos celulares das placas alares formam os cornos dorsais (cinzentos), núcleos aferentes (sensitivas). Os corpos celulares das placas basais formam as os cornos ventrais e laterais fibras eferentes (motoras).
Neural crest-derived territories (blue) have been verified experimentally in each species, although the specific contributions from individual migratory streams are reported only for chicken, axolotl and Xenopus. Derivation of remaining components from mesoderm (magenta) has been verified experimentally in mouse and chicken and is presumed for the remaining species. Arrowheads point to the neural crest–mesoderm interface in the skull roof, which is displaced caudally in Xenopus. Data for zebrafish are from refs 8, 9; diagram is based on ref. 8 (figure reproduced with permission from PLoS). Data for axolotl and Xenopus are from the present study; skulls are redrawn from refs 16, 42, respectively (figures reproduced with permission from John Wiley and Sons). Data for chicken are from ref. 43; diagram is based on ref. 44 (figure reproduced with permission from John Wiley and Sons). Data for mouse are from refs 7, 45; diagram is based on refs 4, 46 (figure reproduced with permission from John Wiley and Sons). F, frontal; Fp, frontoparietal; N, nasal; P, parietal; Px, premaxilla; Sq, squamosal. (Piekarski, Gross & Hanken, 2014)
Coloured regions depict contributions to the osteocranium from the three CNC migratory streams in four tetrapod model systems. Stream-level contributions are not known in the mouse, but they are presumed to resemble those in the chicken46. It is most parsimonious to posit that urodeles and amniotes share a common pattern of CNC derivation, which evolved no later than their common tetrapod ancestor (blue bar on the simplified phylogeny), and that the unique pattern in Xenopus evolved after the anuran clade diverged from urodeles (green bar).(Piekarski, Gross & Hanken, 2014).
Coloured regions denote contributions from individual migratory streams of CNC. Red labels denote homologous bones that have a different embryonic origin between species. Data for axolotl and Xenopus, two amphibians, are from the present study; skulls are redrawn from refs 16, 42, respectively. Data for the domestic chicken, an amniote, are from ref. 43; diagram is based on ref. 44 (figure reproduced with permission from John Wiley and Sons).
As the neural tube is closing, certain cells dissociate from it and come to lie between the neural tube and the overlying epidermis. These are known as neural crest cells (FIGURE 38.16). They are star-shaped cells that are termed “pluripotent” because they can differentiate in many different ways. Neural crest cells migrate extensively and have amazing developmental capacities. Not only do they form sensory neurons and major parts of the autonomic nervous system, but they are also responsible for most of the skull bones, the pigment cells, and many other structures. Without neural crest cells, vertebrates would not have heads, as we recognize them.
Neurulação e diferenciação do mesoderma em vertebrados.
What two major mechanisms are responsible for determining the differentiated state of a cell?
What is the role of the notochord in neurulation?
A chordate synapomorphy (a shared derived trait) is a hollow dorsal nerve chord (see Concept 23.5). How does the process of neurulation explain why the spinal cord has a central cavity?
What major tissues does ectoderm form? What three major mesodermal regions form in chordates, and what does each form?
Ver em:
Importância do estudo das células
da crista neural
Developmental schematic of the “domestication syndrome” in relation to the neural crest. The blue tube indicates the approximate position of the neural crest in the early embryo, and the blue arrows indicate pathways of neural crest cell migration. (Wilkins, Wrangham and Fitch, 2014)
Bibliografia
Gilbert, Scott, F. Biologia do desenvolvimento. 2ª Edição. Ribeirão Preto, São Paulo, SOCIEDADE BRASILEIRA DE GENÉTICA, 1995.
Morfogênese
https://blog.jaleko.com.br/o-que-e-uma-morula-blastula-gastrula-e-neurula/#:~:text=A%20m%C3%B3rula%20%C3%A9%20composta%20por,m%C3%B3rula%20ocorre%20na%20tuba%20uterina.
Como citar referências
Piekarski, N. Gross, J.B. Henken, J. Evolutionary innovation and conservation in the embryonic derivation of the vertebrate skull. Nat. Commun. 5:5661 doi: 10.1038/ncomms6661 (2014).
Evolução e desenvolvimento
https://www.biorxiv.org/content/10.1101/161695v1.full (Evol.multicelularidade)
https://hal.archives-ouvertes.fr/hal-01456624/document (Evol em esponjas)
Exercícios
Histologia
VER PAGINAS 38 A 47 PARA TECIDOS
Vídeos sobre embriologia




















































































































