TECIDOS ANIMAIS





















A origem e evolução inicial dos metazoários é uma dos problemas mais importantes da biologia moderna.
A multicelularidade não poderia ocorrer sem a aparecimento de mecanismos de coordenação da divisão celular, diferenciação e morte programada, bem como com adesão e reconhecimento célula-célula.
A evolução desses mecanismos garantem cada vez mais integração estável de células individuais em estruturas unidas coordenadas, o que acabou levando à transição de protistas para metazoários por meio de formas coloniais.
Atualmente, uma gama de dados sobre o comportamento das células e do mecanismos de sua integração e comunicação em tecidos intactos, durante o desenvolvimento embrionário, e durante processos morfogenéticos regenerativos em um grande número de invertebrados e vertebrados têm foi obtido.
To date, ample data on the behavior of cells and the mecha nisms of their integration and communication in intact tissues, during embryonic development, and during regenerative morphogenetic processes in a large number of invertebrates and vertebrates have been obtained.
A análise desses dados tornou possível identificar o padrão comun de funcionamento dos tecidos em metazoários e os supostos processos (putativos) que ocorreram nos primeiros estágios de sua evolução (Tyler, 2003; Srivastava et al., 2010; Adamska et al., 2011).
No entanto, muitos problemas neste campo permanecem não resolvidos. Uma abordagem promissora para garantir mais o progresso na resolução desses problemas é estudar em detalhes os mecanismos de integração e comunicação de
células em tecidos de metazoários basais (ancestrais), em particular, representantes do filo Porifera (esponjas)(Lavrov & Kosevich, 2014)
Por que?
Sponges are aquatic sedentary metazoans with a filtration type of nutrition and respiration. Adult sponges have a very primitive organization: they do not have any organs or digestive, nervous, and muscular systems. The most characteristic feature of organization of sponges is their watercurrent system, a net work of canals running throughout the body and con necting choanocyte cameras lined with choanocytes, flagellated collar cells. Water enters the watercurrent system through ostia (numerous small holes on the sponge surface) and is ejected through oscula (one or several large holes).The watercurrent system ensures pumping huge amounts of water through the sponge body, from which it receives food and oxygen required for life. Due to the constant beating of flagella, choanocytes create a water current running through the animal body. Choanocytes also provide the sponge with food (food particles are captured from the water primarily by these cells). The canals of the watercurrent system and the outer surface of the sponge body are covered with a layer of flattened or Tshape cells, pinacocytes. The entire volume of the body between the canals, chambers of the watercurrent system, and the exter nal surface of the sponge is occupied by the socalled mesohyl. Although the thickness of the mesohyl varies in different groups of sponges, in all representatives of the phylum Porifera, it includes a large number of mobile cell types differing in structure and functions (archaeocytes, sclerocytes, collencytes, etc.) and dis persed in a watered extracellular matrix (basic sub stance of mesohyl) (Ereskovsky, 2005). In addition, mesohyl contains the animal’s skeleton, which is com posed of organic (spongin bands) and inorganic (cal careous or siliceous spicules) elements. (Lavrov & Kosevich, 2014)
Scheme of organization of an adult sponge (by:
Lavrov and Kosevich, 2013). Designations: (ChCh) choanocyte chambers, (WCSCh) watercurrent system canals,
(Mh) mesohyl, (Os) osculum, (Ost) ostia, (Ec) pinacoderm. Arrows on the scheme show the direction of water
currents through the watercurrent system.
Adesão célula-célula
To form an anchoring junction, cells must first adhere. A bulky cytoskeletal apparatus must then be assembled around the molecules that directly mediate the adhesion. The result is a well-defined structure, a desmosome, a hemidesmosome, a focal adhesion, or an adherens junction, that is easily identified in the electron microscope.
Indeed, electron microscopy provided the basis for the original classification of cell junctions.
In the early stages of cell junction development, however, before the cytoskeletal apparatus has assembled, cells often adhere to one another without clearly displaying these characteristic structures; in the electron microscope, one may simply see two plasma membranes separated by a small gap of a definite width. Functional tests show, nevertheless, that the two cells are stuck to each other, and biochemical analysis can reveal the molecules responsible for the adhesion.
The study of cell-cell junctions and the study of cell-cell adhesion were once quite distinct endeavors, originating from two different experimental approaches junctions through electron microscopic description, and adhesion through functional tests and biochemistry.
Only in recent years have these two approaches begun to converge in a unified view of the molecular basis of cell junctions and cell adhesion.
In this section, we turn to functional and biochemical studies of the cell-cell adhesion mechanisms that operate when cells migrate over other cells and when they assemble into tissues mechanisms that precede the construction of mature cell-cell anchoring junctions.
We begin with a critical question for embryonic development: what mechanisms ensure that a cell attaches to appropriate neighbors at the right time to forma a tissue?

An example of a more complex mechanism by which
cells assemble to form a tissue
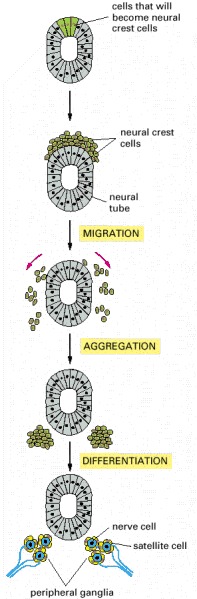
Some cells that are initially part of the epithelial neural tube alter their adhesive properties and disengage from the epithelium to form the neural crest on the upper surface of the neural tube. The cells then migrate away and form a variety of cell types and tissues throughout the embryo. Here they are shown assembling and differentiating to form two collections of nerve cells, called ganglia, in the peripheral nervous system. Other neural crest cells differentiate in the ganglion to become supporting (satellite) cells surrounding the neurons. The crest cells tend to migrate in clusters, and they proliferate rapidly as they migrate.
A evolução dos mecanismos de adesão celular em animais facilitou a montagem de tecidos multicelulares organizados.
Estudos em modelos animais tradicionais revelaram duas estruturas de adesão predominantes, a junção aderente (AJ) e as aderências focais (FAs), que estão envolvidos na fixação de células vizinhas umas às outras e à matriz extracelular secretada (ECM), respectivamente.
O AJ (contendo caderinas e cateninas) e FAs (compreendendo integrinas, talina e paxilina) diferem na composição da proteína, mas ambas as junções contêm a proteína de ligação à actina vinculina.
A quase onipresença dessas estruturas nos animais sugere que AJ e FAs evoluíram cedo, possivelmente coincidindo com multicelularidade.
No entanto, um desafio a esta perspectiva é que estudos anteriores de esponjas, uma linhagem animal basal divergente, indicam que seus tecidos são organizados principalmente por uma mecanismo alternativo de adesão celular específico de esponja, denominado "fator agregação."
Neste estudo, examinamos a estrutura, propriedades bioquímica, e localização no tecido de um ortólogo de vinculina na esponja Oscarella pearsei (Op).
Nossos resultados indicam que Op vinculina se localiza em ambos os contatos célula-célula e célula-ECM e tem propriedades bioquímicas e estruturais semelhantes às da vinculina de vertebrados.
Propomos que a Op vinculin desempenhou um papel na adesão celular e organização de tecidos no último ancestral de esponjas e outros animais.
Essas descobertas fornecem evidências convincentes de que os tecidos esponjosos são de fato organizados como epitélios em outros animais e apoiam a noção que estruturas semelhantes a AJ (adherens junction) e FA (focal adhesions) se estendem até os primeiros períodos da evolução animal.
Specificity of Op vinculin antibody and tissue localization of vinculin in Oscarella pearsei. (A) O. pearsei cell lysates probed with antibodies against His-Op vinculin in the absence and presence of a competing protein. In the absence of competing protein, the antibody recognizes a single band of 92 kDa, and faster migrating bands corresponding to degraded Op vinculin. Preincubation of the antibody with competing protein 0.5 microgram of His-tagged Op vinculin reduced binding to Op vinculin by 90%. (B) simplified illustration of the O. pearsei body plan. Op vinculin localized to the pinacoderm (yellow), the choanoderm (red), and to migratory cells in the mesohyl (blue). C–F), tissue and cellular localization of Op vinculin by immunostaining at cell– boundaries in the pinacoderm (C), filopodia in migratory in the mesohyl (D), an F-actin population at the base of microvilli in choanocytes (cross-section views of staining are visible as rings (hatched yellow circle) in the top half of the panel and longitudinal-section views of staining visible in the bottom half of the panel (yellow arrows)) (E), and at points of contact between individual choanocytes that form a continuous belt around adjacent cells (pink arrowheads) (F). Asterisk shows a foreign particle (staining artifact). (G), cartoon summary of choanocyte staining (green, vinculin; red, F-actin).
O PAPEL DAS CADERINAS
Tissue morphogenesis during development is dependent on activities of the cadherin family of cell–cell adhesion proteins that includes classical cadherins, protocadherins, and atypical cadherins (Fat, Dachsous, and Flamingo). The extracellular domain of cadherins contains characteristic repeats that regulate homophilic and heterophilic interactions during adhesion and cell sorting. Although cadherins may have originated to facilitate mechanical cell–cell adhesion, they have evolved to function in many other aspects of morphogenesis. These additional roles rely on cadherin interactions with a wide range of binding partners that modify their expression and adhesion activity by local regulation of the actin cytoskeleton and diverse signaling pathways.
Developmental roles of cadherins. (A) Cadherins mediate Ca2+-dependent cell–cell adhesion. (B) Differential expression of cadherins (either by modulating subtype or expression level) induces sorting out of mixed cell populations. (C) Cadherin subtype switching occurs during coordinated cell movements such as neurulation, where the invaginating neural plate expresses N-cadherin, while the overlying ectoderm expresses E-cadherin. (D) Cadherins function in PCP. Ds and Fat interact directly and are upstream of Fz, while Fmi functions downstream, leading to additional expression of PCP components and asymmetrical localization of proteins including Fz, Disheveled (Dsh), Van Gogh (Vang), and Prickle (Pk) (Klein and Mlodzik 2005). Classical cadherins have specialized distributions at the AJ (light-blue arrows) of polarized epithelia (E), and at puncta adherentes (blue arrows) that surround the active zone at the neuronal synapse (F). (TJ) Tight junction; (AJ) adherens junction. (Halbleib and Nelson, 2006)
CONTATOS CELULARES
As junções celulares animais podem ser classificadas como ancoradouras, comunicantes ou bloqueadoras (1).
Nos processos de multiplicação e morte programada, essas junções devem ser desfeitas. Na divisão celular, permite à célula os movimentos necessários, e na apoptose evita que a deterioração da célula em morte cause danos às células vizinhas.
(1) ALBERTS, B. et al. Biologia molecular da célula. 4ªed. Porto Alegre, Artes Médicas, 2004.
Junções que mantém as células unidas
INTERDIGITAÇÕES
As interdigitações realizadas pelas membranas plasmáticas de duas células pareadas são especializações de comunicação celular que têm como propósito ampliar a superfície de contato entre as células que as realizam. Não é incomum que esta região de membranas interdigitadas seja local de ocorrência de alguma junção. Podem ser descritas como evaginações e invaginações complementares para o interior do corpo de uma e de outra célula pareada. Seu local de ocorrência predominante é a região lateral das células em proximidade.

Eletromicrografia de células epiteliais do tubo digestório. Na região lateral de contato entre os dois enterócitos no campo, observamos a presença de um complexo juncional (CJ) e, abaixo, interdigitações laterais (IL) entre suas membranas pareadas. (MET, rato)(1).

Eletromicrografia de corte transverso da região apical de duas células epiteliais em contato. O corte, próximo ao ápice, revela extensa região de membrana plasmática formando interdigitações em suas áreas laterais (IL). Nesta extensão das membranas há ocorrência de outra junção (J). (MET, planária terrestre) (1).
DESMOSSOMO (MÁCULA ADERENTE)
A junção desmossômica é uma junção ancoradoura que serve para adesão célula-célula, portanto, requer proximidade entre as membranas de duas células vizinhas. Sua forma em mancha, justifica sua antiga nomenclatura de mácula ou botão de aderência. Seu número está relacionado ao esforço mecânico a que as células estão sujeitas, sendo mais numerosas no epitélio de revestimento externo do corpo, no estrato espinhoso da epiderme. Neste local, sua resistência mecânica na aderência celular pode ser visualizada pela preservação das zonas de contato entre as células, por meio de pontes de membrana e citoplasma que atravessam o meio extracelular, apesar da retração dos corpos celulares após o processamento histológico.
A região da membrana plasmática que estabelece junção desmossômica tem sua resistência mecânica aumentada com um reforço no lado citoplasmático oferecido pelo citoesqueleto ancorado à sua superfície protoplasmática, servindo, assim, a dois propósitos, como ponto de ancoragem da célula ao meio externo e como ponto de apoio interno para a arquitetura intracelular.
Esta junção requer a participação de proteínas integrais da família das caderinas, presentes nas duas membranas associadas. A imensa cadeia peptídica das caderinas projeta-se parcialmente para o meio extracelular prendendo-se às extremidades das proteínas caderinas da membrana plasmática da célula pareada. Sua extremidade oposta projeta-se para o meio intracelular servindo de ligação com o citoesqueleto de filamentos intermediários, denominados filamentos de alta resistência mecânica e polimerizados pela proteína citoqueratina ou ceratina. Esta associação ao citoesqueleto é intermediada por outras proteínas citoplasmáticas que reforçam a superfície protoplasmática das membranas na zona da junção formando densas placas, denominadas placas de ancoragem ou placas densas.

Fotomicrografia da epiderme humana (E). Na pele espessa, as células estão mais sujeitas a tração e ao descolamento e, por esse motivo, estão unidas por um grande número de desmossomos entre as células de um mesmo estrato e entre diferentes estratos. Esta quantificação pode ser feita, grosseiramente, pelo número de pontes de citoplasma que visualizamos entre as células de todos os seus estratos, mas, principalmente, do chamado estrato espinhoso. O tecido conjuntivo está indicado (TC). (HE, humano)(1).

Detalhe ampliado do campo demarcado na imagem anterior. Nas células do estrato espinhoso as pontes de citoplasma (seta), visualizadas no espaço intercelular, revelam a ação dos desmossomos em sua ancoragem. O processamento histológico da epiderme retrai os corpos celulares, que não se desprendem, por efeito de tais uniões de adesão. (HE, humano)(1).
Desmossomos e hemidesmossomos e outras formas de adesão celular

Eletromicrografia de células epiteliais. Suas membranas laterais encontram-se em proximidade e realizam junções. Um desmossomo (entre setas) é reconhecido pela densidade de filamentos intermediários ancorados na superfície protoplasmática das membranas no local da junção e por seu aspecto em mancha. (MET, rato)(1).
Micrografia eletrônica de células epiteliais da mucosa intestinal mostrando
desmossoma e zônulas de oclusão.

A Summary of the junctional and nonjunctional adhesive mechanisms used by animal cells in binding to one another and to the extracellular matrix
The junctional mechanisms are shown in epithelial cells, while the nonjunctional mechanisms are shown in nonepithelial cells. A junctional adhesion is operationally defined as one that can be seen as a specialized region of contact by conventional or freeze-fracture electron microscopy. A nonjunctional adhesion shows no such obvious specialized structure. Note that the integrins and cadherins are involved in both nonjunctional and junctional cell-cell (cadherins) and cell-matrix (integrins) contacts. Cadherins generally mediate homophilic interactions, whereas integrins mediate heterophilic interactions (see Figure 19-26). The cadherins, integrins, and selectins act as transmembrane adhesion molecules and depend on extracellular divalent cations to function; for this reason, most cell-cell and cell-matrix contacts are divalent-cation-dependent. On blood cells, selectins and integrins can also act as heterophilic cell-cell adhesion molecules: the selectins bind to carbohydrate, while the cell-binding integrins bind to members of the Ig superfamily. The integrins and integral membrane proteoglycans that mediate nonjunctional adhesion to the extracellular matrix are discussed later. (Insert courtesy of Daniel S. Friend.)

Eletromicrografia de um desmossomo. Nesta ampliação pode-se visualizar as caderinas entre as células pareadas formando pontes eletrondensas (seta vazada) no meio intercelular (extracelular). Placas de ancoragem (PA) são formadas por proteínas associadas que intermedeiam a associação dos filamentos intermediários (FI) nas superfícies protoplasmáticas das membranas em junção. (MET, rato)(1).
JUNÇÃO ADERENTE
Esta junção é similar a um desmossomo por sua função de ancoragem entre as membranas e ancoragem do citoesqueleto, no entanto, sua distribuição na membrana difere do mesmo por dispor-se em cinturão ao redor do corpo da célula, fazendo a união desta com várias células vizinhas. Nesta junção o citoesqueleto ancorado é composto de microfilamentos de actina.

Eletromicrografia de zônula aderente (ZA) entre duas células epiteliais. Os microfilamentos (MF) que sustentam as projeções apicais encontram nesta região da membrana plasmática um ponto de ancoragem. Microvilosidades (MV).
(MET, rato) (1).

Eletromicrografia ampliada de zônula aderente (ZA) entre duas células epiteliais. Os microfilamentos (MF) que sustentam as projeções apicais encontram nesta região da membrana plasmática um ponto de ancoragem. (MET, rato)(1).
JUNÇÃO COMUNICANTE (GAP)
Nos vertebrados, a junção comunicante ou GAP é uma junção com forma e tamanho variados, pois pode ser construída e desfeita pela simples concentração ou dispersão de proteínas Conexinas em qualquer ponto de aproximação entre as membranas de células vizinhas. Nos invertebrados, a junção é formada por proteínas similares, denominadas Inexinas. Seu objetivo é a sinalização celular por meio de íons ou por meio de pequenos peptídeos sinalizadores que atravessam do citoplasma de uma célula diretamente para o citoplasma da célula vizinha, sem passar pelo meio extracelular. A passagem da molécula ou íon sinalizador se dá pelo interior do poro formado pela união das extremidades de duas conexinas, cada uma na membrana de uma das células em junção. Esse trânsito é muito rápido, fazendo com que essa especialização juncional seja uma das mais eficientes formas de comunicação entre as células animais.
A dimensão de uma junção comunicante na membrana e seu formato é bastante variável, pode mudar de acordo com o momento funcional da célula ou de seu período vital. Em células embrionárias pode se estender por toda uma face lateral ou se restringir a pequenos agregados de conexinas em células diferenciadas.
A GAP é o tipo de junção mais freqüente entre as células. Entre neurônios, é denominada sinapse elétrica (1).

Eletromicrografia da região de união entre uma célula nervosa (célula B) e uma célula muscular lisa (célula A). As membranas plasmáticas das duas células no campo estão separadas por um espaço extracelular (E) que se reduz na região das duas junções comunicantes ou junções GAP (G). A célula A mostra associação de cisternas do retículo endoplasmático (RE) às zonas de junção. (MET, planária terrestre)(1).
JUNÇÃO COMPACTA (ZÔNULA OCLUSIVA)
A junção compacta ou zônula oclusiva é uma junção do tipo bloqueadora. Uma de suas funções é a obstrução do espaço extracelular, impedindo o trânsito de substâncias por entre as células em união. Neste caso, as substâncias que permeiam o meio extracelular só ultrapassam a zona de bloqueio sendo transportadas pelo citoplasma das células unidas. Esta seletividade do trânsito extracelular só é possível porque a junção se dispõem em cinturão, comumente associado ao pólo apical das células pareadas. Sua segunda função é impedir a dispersão ou migração dos elementos que integram as membranas plasmáticas e que não conseguem fluir pela região do cinturão de bloqueio. Isso permite à célula criar dois microambientes de membrana plasmática com composição distinta nos pólos apical e basal.
A junção requer a presença das proteínas integrais claudinas e ocludinas nesta região das membranas plasmáticas pareadas. Estas proteínas presentes nas duas membranas se ancoram pelas extremidades projetadas ao meio extracelular, aproximando intimamente as duas superfícies extracelulares. No lado citoplasmático, à semelhança das proteínas caderinas, também ancoram o citoesqueleto, aqui representado pelos microfilamentos de actina.
A proximidade entre as membranas pareadas no cinturão de oclusão é tão íntima que o aspecto trilaminar típico para a identificação visual de uma biomembrana ao microscópio eletrônico de transmissão é perdido, observando-se uma fusão das lâminas densas externas das duas membranas em união.

Eletromicrografia de células do epitélio intestinal. Dois enterócitos mostram-se unidos por uma junção compacta ou zônula oclusiva (ZO), que se dispõe em forma de cinturão, contornando integralmente o polo apical de cada célula pareada. A linha de fusão das lâminas externas (seta larga) das duas unidades de membrana é observada ao centro da junção. Os microfilamentos (MF) que dão sustentação as microvilosidades (MV) e compõem a trama terminal ancoram-se ao cinturão juncional por proteínas citoplasmáticas associadas à superfície protoplasmática das membranas em união. (MET, rato)(1).
JUNÇÕES ESTREITAS (TIGHT JUNCTION)
As junções apertadas servem como selos seletivamente permeáveis nas superfícies internas e externas do nosso corpo.
As junções firmes são as áreas intimamente associadas de duas células cujas membranas se unem para formar uma barreira virtualmente impermeável ao fluido.
As junções rígidas executam funções vitais, como manter as células unidas, e formam barreiras protetoras e funcionais.
As junções estanques são compostas por uma rede ramificada de fios de vedação, com cada fio atuando independentemente dos outros.
Os principais tipos de proteínas nas junções são as claudinas e as ocludinas.
Cada fita é formada por uma fileira de proteínas transmembrana incorporadas em ambas as membranas plasmáticas, com domínios extracelulares unindo-se diretamente.
Composição
Uma junção compacta, uma tipo de junção celular simétrica, é composta de numerosas proteínas importantes que estão diretamente envolvidas em sua composição ou intimamente envolvidas com a conexão da junção rígida para e entre as células de uma forma ou de outra. Essas proteínas incluem:
Ocludinas, que mantêm a barreira entre as células adjacentes.
Claudinas, que formam a espinha dorsal dos fios de junção rígida.
Moléculas de adesão juncional (JAMs) são proteínas de imunoglobulina (anticorpos) que ajudam a selar o espaço intercelular entre duas células.
Zônula ocludens (ZO) são proteínas que ajudam a ligar a junção apertada ao esqueleto interno de cada célula (citoesqueleto).
As ocludinas e claudinas são os principais componentes dos cordões de junção compacta. Quando totalmente formada, uma junção estanque não é uma vedação longa e contínua. Em vez disso, parece uma série de selos locais unidos em um labirinto.
Imagine um zíper impermeável conectando as laterais de duas jaquetas diferentes. Esse zíper é como uma junção estanque (TJ), também chamada de junção de oclusão. Um TJ cria uma pequena zona que oclui o espaço extracelular (o espaço entre as células). É por isso que as junções estreitas também são chamadas de zônula ocludente. A palavra zonula vem de palavras que significam zona pequena ou cinto envolvente, enquanto occludens vem da palavra latina occludere, que significa fechar. (Neste site há outras imagens de ligações entre as células).
JUNÇÃO SEPTADA
A junção septada é uma junção bloqueadora típica de epitélios dos invertebrados. Esta junção tem disposição em cinturão circundando o corpo de cada célula em união. Como define sua nomenclatura, é facilmente identificada em eletromicrografias pela presença de inúmeros septos eletrondensos que atravessam o espaço extracelular entre as membranas plasmáticas pareadas. Estes septos se dispõem como fitas que bloqueiam o transito extracelular e portanto atribuem ao epitélio a propriedade de seletor das trocas entre a cavidade ou superfície, revestida pelo epitélio, e o tecido conjuntivo. Pode ser comparada, funcionalmente, à junção compacta (zônula oclusiva) dos vertebrados.
Estes septos extracelulares são coincidentes com a ocorrência de proteínas integrais, inseridas nas membranas plasmáticas, na região da junção e, aparentemente, também são responsáveis pela ancoragem de citoesqueleto na superfície protoplasmática da membranas em junção. A visualização destas proteínas integrais só é possível com o uso da técnica de criofratura (1).

Eletromicrografia de células epiteliais. A célula clara (estrela), ao centro do campo, mostra seu extenso cinturão de união nas regiões laterais, fazendo junção septada (JS) com duas células vizinhas. Septos eletrondensos (cabeça de seta) atravessam o meio extracelular unindo as membranas pareadas e obstruindo o trânsito intercelular. (MET, planária terrestre)(1).

Eletromicrografia da célula clara (estrela) indicada na figura anterior , em corte transverso da região do cinturão de sua junção septada (cabeça de seta). A junção circunda o corpo celular, ao centro do campo, fazendo união com todas as células vizinhas. (MET, planária terrestre)(1).
COMPLEXO JUNCIONAL OU UNITIVO
(EPITÉLIO INTESTINAL)
O denominado complexo juncional ou complexo unitivo corresponde a um conjunto de junções celulares de ocorrência obrigatória entre os enterócitos que compõem o epitélio do tubo digestório. Este conjunto deve respeitar a seguinte seqüência no sentido do ápice para a base celular:
(A) junção compacta (zônula ocludente);
(B) junção aderente (zônula aderente) e
(C) desmossomos.
As duas primeiras junções são em cinturão e a terceira em manchas. Consulte os itens anteriores desta unidade para detalhes e funções de cada tipo de junção de ocorrência citada no complexo juncional.
Estas mesmas junções podem ser encontradas entre outros tipos celulares, no entanto, dificilmente respeitam esta seqüência, e mesmo que o façam, a nomenclatura que define esse conjunto na ordem específica citada é de uso exclusivo para o epitélio intestinal.
O complexo juncional pode ser seguido das mais variadas formas de junções, como interdigitações, GAP, outros desmossomos, etc.(1)

Eletromicrografia da região de contato entre dois enterócitos. Complexo juncional com sua sequência obrigatória de junções típica do epitélio intestinal, do ápice para a base celular: zônula oclusiva (A); zônula aderente (B) e desmossomo (C). Abaixo do complexo há presença de interdigitações laterais (IL). Microvilos (MV) no ápice celular. (MET, rato)(1).
DISCO INTERCALAR
O disco intercalar é, na verdade, o local de ocorrência de um complexo de três junções celulares:
(1) desmossomos;
(2) zônulas de aderência;
(3) junções comunicantes (GAP),
que se estabelecem entre as fibras cardíacas (células musculares estriadas cardíacas).
Em nossa unidade de morfologia celular, você conheceu esta fibra como representante da forma cilíndrica.
No arranjo do tecido muscular seus corpos se acomodam de forma paralela na formação dos fascículos do músculo. Várias células se justapõem, também, pelas extremidades em forma de disco, denominadas discos intercalares. Nesta região de contato terminal, as células mostram interdigitações e, com freqüência, estes discos são fragmentados em vários degraus de contato. Ao diagnosticar o tecido é comum observarmos vários discos em proximidade no fascículo formando uma imagem de escada, denominada linha escariforme.
Nos discos intercalares do tecido muscular, cada junção cumpre uma função específica. Os desmossomos estão ancorando as fibras cardíacas entre si evitando que se separem durante a contração muscular. As zônulas de aderência ancoram os microfilamentos das bandas I das miofibrilas à membrana plasmática, dando sustentação ao citoesqueleto e permitindo que a membrana seja tracionada para a contração do corpo celular durante o estímulo de contração muscular. As junções GAP permitem a sinalização iônica entre as fibras (células), sincronizando a contração do músculo durante a sístole cardíaca (batimento cardíaco).

Fotomicrografia de músculo cardíaco. Junções entre as fibras cardíacas mostram suas diferentes formas, em disco simples (entre cabeças de seta) ou linhas escalariformes (seta amarela). Capilares sanguíneos e seu endotélio (seta vermelha) estão indicados. (HE, cão)(1).

Fotomicrografia anterior, do músculo cardíaco, onde, para facilitar a identificação, foram sobremarcadas as zonas de união celular entre as fibras cardíacas no campo, local de seus discos intercalares (linhas azuis). Quatro destas fibras tiveram seus limites laterais definidos (linhas amarelas). Núcleos (N) das fibras delimitadas, em posição central. (HE, cão)(1).

Fotomicrografia da região de união de duas fibras cardíacas com disco intercalar em escada (entre setas). Núcleos centrais (N) das fibras cardíacas em junção estão indicados. (HE, cão).
SINÁPSE QUÍMICA
A junção sináptica, independente de ser do tipo química ou do tipo elétrica, tem como característica comum a obrigatoriedade de uma das células desta junção pareada ser um neurônio, enquanto a outra célula pode, ou não, ser um outro neurônio. A sinapse do tipo química envolve o uso de moléculas denominadas neurotransmissores, como sinalizadores no trânsito de informação entre a membrana efetora (membrana plasmática do neurônio), denominada membrana pré-sináptica, e a membrana aceptora do estímulo (membrana da célula-alvo), denominada membrana pós-sináptica. No corpo do neurônio, a região especializada para a realização deste tipo de junção é a extremidade de sua projeção axonal (axônio). Esta terminação, denominada botão axonal, mostra-se quase sempre dilatada pelo acúmulo de vesículas sinápticas, por vezes ainda ancoradas aos microtúbulos, sobre os quais trafegam desde o corpo neuronal (soma ou pericário).
A informação que transita em uma sinapse química é dita unidirecional, e o estímulo sobre a célula aceptora pode ser excitatório ou inibitório, dependendo da natureza do neurotransmissor. Morfologicamente, essa junção se distingue por não haver contato físico entre as membranas pareadas. Elas são separadas por uma fenda sináptica com características químicas distintas do restante do meio extracelular. A membrana pré-sináptica pode ser facilmente identificada pela concentração de vesículas sinápticas com neurotransmissores junto da região juncional, e a pós-sináptica, pela concentração de citoesqueleto na sua superfície protoplasmática, ancorando os receptores concentrados nesta área da membrana, sendo assim denominada teia sináptica (1).

Eletromicrografia de uma sinapse química. A membrana pré-sináptica (PRÉ) pode ser identificada pela presença das vesículas sinápticas (VS). Uma fenda sináptica (FS) separa a membrana pré da pós-sináptica (PÓS). A membrana pós-sináptica pode ser identificada pela densa associação de citoesqueleto à sua superfície protoplasmática formando a teia sináptica (TS). (MET, planária terrestre)(1).
INVAGINAÇÕES BASAIS
(LABIRINTO BASAL)
Sua ocorrência, número e extensão são variáveis ao longo da vida da célula, pois tem por propósito o aumento de superfície de contato da célula com o tecido conjuntivo. Células que apresentam alta taxa de trocas com o conjuntivo, apresentam na região baso-lateral invaginações numerosas e extensas, por vezes tão profundas para o interior da célula que alcançam o pólo apical, cruzando integralmente o citoplasma. Estas profundas dobras da membrana plasmática do pólo basal da célula propiciam uma maior aproximação entre o meio extracelular e suas organelas de síntese, e até mesmo com a cavidade com a qual se relaciona no pólo apical. Essas deformações da membrana celular não são acompanhadas pela lâmina basal nem membrana basal. É comum um elevado número de mitocôndrias mostrarem-se associadas e pareadas com essas invaginações da membrana plasmática, fornecendo energia química para o transporte celular. A literatura refere sua participação no metabolismo e transporte iônico.

Fotomicrografia de túbulos contorcidos proximais do rim. Suas células revelam presença de mitocôndrias finas e alongadas (M) que se dispõem em paralelo com as invaginações basais (IB) da membrana plasmática de seu pólo basal. As invaginações mostram-se como fendas no citoplasma, conferindo-lhe um aspecto roto. Núcleos (N) das células epiteliais e a cavidade luminal (L) dos túbulos renais estão indicados. (HE, rato)(1).

Fotomicrografia de túbulos contorcidos proximais do rim. Suas células revelam presença de mitocôndrias finas e alongadas (M) que se dispõem em paralelo com as invaginações basais (IB) da membrana plasmática de seu pólo basal. A invaginações mostram-se como fendas no citoplasma, conferindo-lhe um aspecto roto. A membrana basal (MB) não acompanha essas invaginações da membrana plasmática. Núcleos (N) das células epiteliais e a cavidade luminal (L) dos túbulos renais estão indicados. (HE, rato)(1).

Fotomicrografia de túbulos contorcidos proximais do rim. Suas células revelam presença de profundas invaginações basais (IB) da membrana plasmática de seu pólo basal,, que se aprofundam no citoplasma e por vezes alcançam o ápice celular. Em seu interior estende-se o meio extracelular em fendas que conferem um aspecto roto ao citoplasma. A lâmina basal e membrana basal não acompanham essas invaginações da membrana plasmática. Núcleos (N) das células epiteliais, seus lisossomos (Li) e a cavidade luminal (L) dos túbulos renais, estão indicados. (HE, rato)(1).
Bibliografia
Evolução








0 comentários:
Postar um comentário