FITORMÔNIOS
FITORMÔNIOS OU HORMÔNIOS VEGETAIS
FITORMÔNIOS OU HORMÔNIOS VEGETAIS
実るほど頭の下がる稲穂かな
Minoru hodo atamano sagaru inahokana (1)
“A espiga de arroz, quanto mais carregada, mais se inclina”
実る = frutificar
ほど = medida, grau
頭 = cabeça
下がる = baixar, inclinar
稲穂 = espiga de arroz
O termo hormônio é derivado do grego: ὁρμῶν, ormón que significa evocar, excitar ou estimular. Os hormônios vegetais, ou fitormônios são os principais fatores internos que regulam o crescimento e o desenvolvimento vegetal, sendo responsáveis pela comunicação entre as células, tecidos e órgãos das plantas.
Os fitohormônios ou hormônios vegetais são pequenas moléculas ou substâncias orgânicas de ocorrência natural que influenciam os processos fisiológicos (Kozlowski et alii, 1997) nas plantas em concentrações muito baixas (Davies, 2004). Em outras palavras, os fitormônios são mensageiros químicos que coordenam as atividades celulares das plantas (Fleet e Williams, 2011).
Desde a descoberta inicial da auxina como o primeiro fitormônio (Went, 1935) até a identificação mais recente das estrigolactonas (SL) (Gomez-Roldan et al., 2008), nove categorias de fitormônios, ou seja,
auxinas IAA ou AIA,
citocininas (CK),
giberelinas (GA),
ácido abscísico (ABA),
etileno (ETH),
brassinosteróides (BR),
salicilatos (SA),
jasmonatos (JA) e
estrigolactonas (SL),
foram identificados até o momento.
Estrutura química dos hormônios vegetais
Em relação às estruturas químicas, as auxinas AIA são derivados do indol; já o ácido abscísico ABA é um sesquiterpeno; o etileno ETH é o alceno mais simples; as citocininas CKs são derivados de adenina; enquanto as giberelinas ou ácidos giberélicos (GAs) são ácidos diterpenóides tetracíclicos; brassinosteróides BRs são polihidroxiesteroides; jasmonatos (ácido jasmônico) JA é um ácido graxo derivado do ácido linolênico (Zhai, 2017) (Rahm et al, 1971); estrigolactonas SLs são lactonas terpenóides derivadas de carotenóides (Fleet e Williams, 2011).
Geralmente, AIA, GAs, ABA, JA e SA são ácidos e CKs são alcalinos; assim, a diversidade de estruturas e propriedades químicas de diferentes fitohormônios tornam necessários procedimentos especializados de extração, purificação e quantificação, bem como de localização (Han et al., 2012). A consideração das diversas propriedades físico-químicas dos fitormônios é discutida em um capítulo separado neste livro, que descreve os métodos físicos de cromatografia líquida (LC) e espectrometria de massa (MS) para a identificação e quantificação de hormônios vegetais (Fang et al., 2017).
Hormônios vegetais clássicos
Os cinco primeiros: AIA, CK, GA, ABA e ETH, às vezes são chamados de fitormônios “clássicos”, enquanto os quatro últimos são adições posteriores à crescente família fitormonal (Fleet e Williams, 2011).
Como dito acima vamos estudar os hormônios vegetais clássico, que são: as auxinas, o etileno, o ácido abscísico, as giberelinas, e as citocininas.
Olea europea, frutificação e maturação
Ácido indolilacético (AIA)
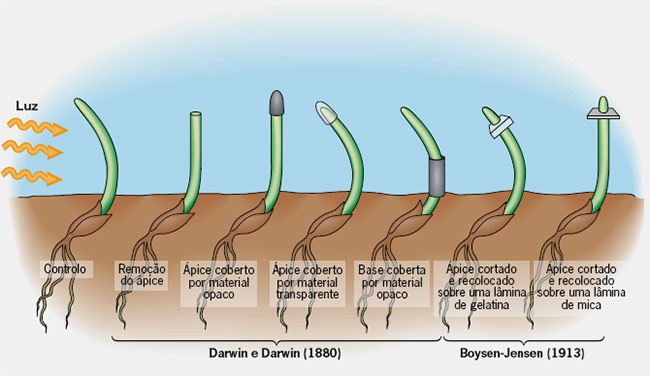
A história da auxina inicia com Charles Darwin e Francis Darwin observando o curvatura em direção a luz de plântulas de alfafa.
Em O Poder do Movimento nas Plantas, livro que escreveu com Francis Darwin, um dos seus dez filho, Charles Darwin descreve como constatou que o broto de uma espécie de planta, a Phalaris canariensis, crescia "torto" quando submetido ao estímulo da luz.
"Nos surpreendeu ver como a parte superior determinava a direção da curvatura da parte inferior", escreveu.
Para averiguar se a parte superior do broto era a parte sensível à luz, o biólogo cobriu a recobriu com uma "capa" de material opaco. E verificou que, desta vez, a planta não se dobrou em direção à luz.
É possível replicar esse mesmo experimento: plantar uma semente e ver como seu primeiro broto curva-se em direção a uma vela acesa, por exemplo, para então cobrir a ponta com uma "capa" de papel alumínio e notar a diferença.
Os experimentos de Charles Darwin
https://youtu.be/EqvAWWNPsYk
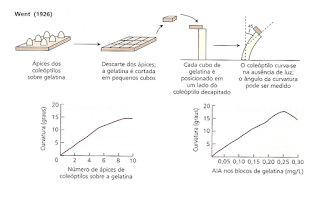
Em 1910 - 1913 fisiologista dinamarquês, Boysen-Jensen descobriu que a auxina ultrapassava um bloco de gelatina mas não substancia como a mica.
https://youtu.be/cKEi90Z_iBg
Mais tarde, em 1919, Arpad Páal (Hungria) acrescentou que quando uma planta é iluminada apenas de um lado, as auxinas migram para o lado menos iluminado (do caule ou o lado onde não bate a luz) promovendo seu crescimento, originando a curvatura observada por Darwin, fornecendo mais uma evidencia de que essa substancia era de natureza química.
https://youtu.be/AJ4OY9Jg5Kc
https://youtu.be/HmHvWDeTt7Y
Fritz Warmolt Went (1926) fisiologista holandês propôs o nome de Auxina a essa substância. O nome auxina deriva da palavra grega αυξειν, auxein: crescer ou aumentar.
A auxina está presente em todas as partes de uma planta, embora em concentrações muito diferentes. A concentração em cada posição é uma informação crucial para o desenvolvimento, portanto está sujeita a uma regulamentação rígida, tanto no metabolismo quanto no transporte. O resultado é que a auxina cria "padrões" de concentração máxima e mínima de auxina no corpo da planta, os quais, por sua vez, orientam o desenvolvimento adicional das respectivas células e, finalmente, da planta como um todo.
Posteriormente descobriu-se que não era somente um mas alguns hormônios de composição bastante simples do ácido indol-acético.
Ácido indolacético (AIA) ou Ácido-Indolil-Acético (AIA) Natural
Ácido indolbutírico (IBA)
Ácido alfa-naftalenocético (ANA)
Ácido indolpropiônico (AIP)
Ácido cloroindolacético (4-Cl-AIA)
Ácido 2,4 diclorofenoxiácético (2,4D) Sintético
Ácido 2-fenilacético (APA)
Funções na planta
1) Promove distensão da parede celular vegetal
2) Atua no crescimento dos meristemas (caules e raízes)
3) Em concentrações altas, atua inibindo o crescimento dos órgãos vegetais Assim pode ser usada como herbicida.
4) Atua tanto inibindo quanto estimulando o crescimento dos caules e raízes.
Concentrações acima do ideal ocasionam a inibição do crescimento desses órgãos. Já concentrações normais de auxina ocasionam a quebra de alguns constituintes da parede celular, como os filamentos de celulose, o que causa o enfraquecimento dessas fibras. Assim, há um aumento da absorção de íons pela membrana celular e um aumento do turgor da célula, causando o alongamento desta.
5) Atua na dominância apical, onde a diferenciação das células nas gemas apicais inibe o crescimento das gemas laterais.
A auxina é produzida principalmente pelo ápice do caule, i.e., no tecido meristemático apical e segue em direção a base. Nesse movimento, causa a inibição do crescimento das gemas laterais. À medida que a planta cresce e a gema apical afasta-se das laterais, a inibição é reduzida, permitindo que as gemas laterais mais distantes desenvolvam-se em galhos laterais. A remoção da gema apical (pela poda) estimula o crescimento e o desenvolvimento das gemas laterais. Assim, a poda pode estimular a produção de novos ramos laterais em árvores frutíferas e, consequentemente, aumentar a produção de flores e frutos.
6) Atua no fototropismo e no gravitropismo
O fototropismo é o crescimento da planta em direção à luz. Isso se deve ao fato da auxina migrar para a região da planta oposta ao sol. Essa maior concentração de auxina no lado mais escuro causa o alongamento dessas células, provocando a curvatura do caule para o lado iluminado. Assim, a auxina é um hormônio fotofóbico.
Charles Darwin juntamente com seu filho Francis Darwin em 1881, foram os primeiros estudos a observar que o crescimento em direção à luz das plantas se devia presença de algum componente nos tecidos que fazia que ela se inclinasse na direção da fonte de luz.
Os experimentos de Charles Darwin com plântulas da grama escura (a, b) que levaram à descoberta do fitohormônio auxina (c), uma substância promotora de crescimento produzida nas células sensíveia à luz da ponta do coleóptilo e transportada basipetalmente (do ápice para a base), onde promove o alongamento celular. As setas indicam a direção do tratamento de luz branca. (Kutschera and Niklas, 2009).
[Charles Darwin ’ s experiments with dark-grown grass seedlings (a, b) that led to the discovery of the phytohormone auxin ( c ), a growth-promoting substance produced in the cells of the light-sensitive tip of the coleoptile and transported basipetally, where it promotes cell elongation. Arrows denote the direction of white light treatment.]
Darwin continuou seu experimentos estendendo suas observações às raízes, e o que ele observou foi o gravitropismo.
Negative and positive gravitropism of the shoot (coleoptile)and root (radicle), respectively, in a dark-grown maize seedling (Zea mays) oriented horizontally (a). Charles Darwin analysed positive gravitropism (downward bending) of the radicle and demonstrated that roots without tips (decapitated organs) fail to respond to gravity (b).He concluded that the perception of the gravitropic stimulus isrestricted to the root tip (calyptra), whereas the growth response takes place distally. (g:vector of gravity).
Somente bem mais tarde, em 1919, Páal acrescentou que quando uma planta é iluminada apenas de um lado, as auxinas migram para o lado menos iluminado (do caule ou o lado onde não bate a luz) promovendo seu crescimento, originando a curvatura observada por Darwin.
O fototropismo, ou o alongamento diferencial das células exibido por um órgão da planta em resposta à luz azul direcional, fornece à planta um meio de otimizar a captura de luz fotossintética na porção aérea e a aquisição de água e nutrientes nas raízes. Avanços tremendos foram feitos em nossa compreensão das bases moleculares, bioquímicas e celulares do fototropismo nos últimos anos. Seis fotorreceptores e suas vias de sinalização associadas foram ligadas a respostas fototrópicas sob várias condições. A detecção primária da luz direcional ocorre na membrana plasmática, enquanto a fotorrecepção modulatória secundária ocorre no citoplasma e no núcleo.
As respostas intracelulares às pistas de luz são processadas para regular o movimento de auxina de célula a célula, para permitir o estabelecimento de um gradiente transgênico do hormônio. A foto sinalização também impõe a resposta da regulação da transcrição estabelecida como resultado de alterações nas concentrações locais de auxina. (Photosignaling also impinges on the transcriptional regulation response established as a result of changes in local auxin concentrations.)
Também foi demonstrado que três vias adicionais de sinalização de fitohormônio influenciam a capacidade de resposta fototrópica, e essas vias também são influenciadas pela sinalização de fotorreceptores. Aqui, discutiremos essa complexa dança de respostas intra e intercelulares que são reguladas por esses muitos sistemas para dar origem a uma resposta de adaptação rápida e robusta observada como dobramento (bending) de órgãos.
BL-Induced Phototropism in Higher Plants Requires the Establishment of a Differential Gradient of Auxin.
(A) Diagram of a hypocotyl exhibiting a phototropic response.
Auxin synthesized in the apical portions of the stem is polarly transported toward the root predominately through the central vasculature and to a lesser extent via epidermal and subepidermal cell layers (downward pointing red arrows). While in dark-grown seedlings the amount of auxin transported through the outer cell layers is not appreciably different side-to-side across the hypocotyl (data not shown), in seedlings exposed to directional BL, a differential of downward auxin flow is established (see downward pointing outer red arrows). Directional BL also induces a lateral redistribution of auxin from the lit to shaded portion of the hypocotyl (trans-hypocotyl red arrows). Together, these actions result in the differential accumulation of auxin in the elongation zone of shaded versus lit sides of the seedling (yellow shading).
(B) Cross section within the elongation zone of an Arabidopsis seedling hypocotyl illustrating the gradients of phot1 activity (false-colored white to blue) and auxin accumulation (false-colored white to yellow). Gray dots are meant to represent nuclei within the outer two cell layers, regions particularly important to auxin-mediated transcriptional responses (see Figures 3 and 4). Cells outlined in green are endodermal cells.
7) Estimula a formação de raízes adventícias;
8) Atua na diferenciação dos tecidos condutores;
9) Atua na inibição da abscisão de folha e frutos;
10) Atua no desenvolvimento dos frutos. Relembrando: o que é o fruto? O fruto surge quando o gameta feminino que esta no ovário, é fecundado pelo gameta masculino (núcleo polar); quando isso acontece o tecido do ovário é estimulado pela auxina e começa a se desenvolver formando o fruto. Ou seja após a fecundação, o embrião no interior da semente produz auxinas que agem sobre as paredes dos ovários promovendo sua transformação em fruto (fazendo as células aumentarem de volume, acumularem substancias açucaradas, desenvolvend0-se em fruto). Também controla sua permanência no caule ou sua queda quando maduro.
Desta forma, a aplicação de auxinas em flores não polinizadas também estimula o desenvolvimento de frutos, o que pode ser utilizado na agricultura, para a produção de frutos sem sementes, por ex.: melancia sem sementes e uva sem sementes.
A auxina é também produzida pelas gemas apicais, embriões, folhas jovens e sementes.
Transporte polar: do ápice para base
Precursor da Auxina é o aminoácido triptofano.
Efeitos
AÇÃO NO CRESCIMENTO/AÇÃO HERBICIDA
Dicotiledôneas: sensíveis
Monocotiledôneas: imunes
FORMAÇÃO DE FRUTOS E FRUTOS PARTENOCÁRPICOS
TROPISMO - DOMINÂNCIA APICAL
ABSCISÃO DAS FOLHAS - ENRAIZAMENTO DE ESTACAS
CULTURA DE TECIDOS (MICROPROPAGAÇÃO)
ETILENO, C2H4
Durante o século XIX, quando o gás produzido pelo carvão era utilizado para a iluminação das ruas, foi observado que as árvores próximas às lâmpadas perdiam suas folhas de forma mais acentuada que as demais.
• Posteriormente, evidenciou-se que o gás do carvão e os poluentes atmosféricos afetavam o crescimento e o desenvolvimento vegetal, tendo o etileno sido identificado como um componente ativo desse gás.
• Em 1901, Neljubov observou que plantas de ervilha cultivadas no escuro, em laboratório, apresentavam a resposta tríplice: redução no alongamento do caule, aumento do crescimento lateral (intumescimento) e crescimento horizontal anormal.
• Quando cultivadas ao ar livre, as plantas recuperavam a morfologia e a taxa de crescimento normal.
Neljubov identificou o etileno, proveniente do gás de carvão, presente no ambiente do laboratório, como a molécula causadora da resposta.
• A primeira indicação de que o etileno é um produto natural de tecidos vegetais foi publicada por COUSINS, em 1910, ao relatar que “emanações” das laranjas armazenadas em uma câmara provocavam o amadurecimento precoce das bananas. Hoje, sabe-se que laranjas produzem pouco etileno, sendo provável que as laranjas utilizadas por Cousins estivessem infectadas com o fungo Penicillium que produz grandes quantidades de etileno.
• Em 1934, GANE et col. identificaram quimicamente o etileno como um produto natural do metabolismo vegetal, o qual foi classificado como hormônio, devido aos seus drásticos efeitos sobre as plantas.
• Por 25 anos o etileno não foi reconhecido como um hormônio vegetal importante, principalmente, porque a maioria dos fisiologistas acreditava que os efeito do etileno eram devidos a ação das auxinas.
• Contudo, após a introdução da cromatografia gasosa na pesquisa do etileno em 1959, foi redescoberta a importância desse fitohormônio e reconhecido seu significado fisiológico como regulador do crescimento vegetal, (Burg & Thimann, 1959).
O etileno é amplamente produzido pelas angiospermas, Gimnospermas, licófitas, monilófitas, musgos, hepáticas, certas cianobactérias, fungos e bactérias também produzem etileno. A produção de etileno por fungos e bactérias contribui bastante para o seu teor no solo.(fisiologiavetal).
1) O Papel do etileno na maturação de frutos
O termo amadurecimento de frutos refere-se às mudanças no fruto que o tornam pronto para o consumo. Estas mudanças incluem o amolecimento do fruto devido à quebra enzimática das paredes celulares, à hidrólise do amido, ao acúmulo de açúcares e ao desaparecimento de ácidos orgânicos e de compostos fenólicos, incluindo os taninos.
Para as sementes cuja dispersão depende da ingestão por animais, amadurecimento e comestibilidade são sinônimos.
Uso comercial do Etileno
Tendo em vista que o etileno regula vários processos fisiológicos nas plantas, ele tem sido um dos hormônios mais usados na agricultura. Todavia devido à sua alta taxa de difusão, é muito difícil aplicar o etileno no campo sob a forma de gás, esta limitação pode ser superada com o uso de:
1) Auxinas e ACC
Ácido 1-aminociclopropano carboxílico, que podem desencadear a síntese natural de etileno e, em muitos casos, são usados na prática agrícola.
2) Utilização de compostos que liberam etileno
O composto mais utilizado é o ácido 2-cloroetilfosfônico (etefon, etrel). Este ácido libera etileno lentamente em ambiente alcalino:
A banana pertence ao género Musa, que inclui cerca de 70 espécies. No entanto, hoje em dia quase todas as bananas doces são de uma única variedade, conhecida como Cavendish. São cultivadas por reprodução assexuada para serem geneticamente idênticas.
As vezes em aula surge a dúvida se aqueles pontinhos pretos que existem no centro da banana sejam sementes ou não. Entretanto, aquelas estruturas são óvulos não fecundados. A banana cultivada é um fruto partenocárpico, ou seja, que se desenvolve sem que haja fecundação das oosferas (gametas femininos) e o ovário mesmo não havendo a fecundação se desenvolve em um fruto que pode ser usado na alimentação. Portanto a banana não possui sementes.
A perda de biodiversidade torna-as particularmente vulneráveis a ataques de parasitas, e há atualmente uma infecção por um fungo, Fusarium, que está muito disseminada e tem causado grandes perdas na produção.
Musa spp fruto partenocárpico
As giberelinas, ou ácidos giberélicos, são um grupo de hormônios vegetais cujas principais funções estão relacionadas com a regulação da altura das plantas e a germinação das sementes.
As giberelinas (GAs) são hormônios vegetais que regulam vários processos de desenvolvimento, incluindo alongamento do caule, germinação, dormência, floração, desenvolvimento de flores e senescência de folhas e frutos.
GAs é uma das classes mais conhecidas de hormônios vegetais. Acredita-se que a reprodução seletiva (embora inconsciente) de variedades de culturas deficientes na síntese de GA foi um dos principais motores da "revolução verde" na década de 1960, uma revolução que se acredita ter salvado mais de um bilhão de vidas em todo o mundo. (WP)
Estes hormônios foram descobertos no Japão a partir de estudos sobre a doença do arroz chamada de “planta boba”. Essa doença, causada por um fungo denominado Gibberella fujikuroi, causa uma coloração pálida nas plantas e um aumento do crescimento em altura, fazendo com estas apresentem uma tendência a cair. Ao cultivarem esse fungo em laboratório, os japoneses descobriram que havia uma substância produzida por eles que possuía uma atividade promotora do crescimento em vegetais. Após a purificação desses extratos fúngicos, essa substância foi caracterizada e denominada giberelina.
Mais de 100 tipos de giberelinas já foram isolados e identificados quimicamente. São sintetizadas nos tecidos jovens do sistema caulinar e em sementes em desenvolvimento, sendo transportadas provavelmente no xilema e no floema. (infoescola)
As giberelinas promovem a síntese de enzimas hidrolíticas, que degradam as substâncias de reserva presente nos cotilédones e no endosperma. Como exemplo clássico, pode-se citar a ação deste hormônio na germinação de sementes de cereais. Os grãos de cereais apresentam o endosperma composto por dois tecidos: o endosperma amiláceo, onde estão localizadas as reservas (entre elas o amido), e uma camada especializada de células que circunda o endosperma, chamada de camada de aleurona, que é rica em proteínas. O início da germinação, que ocorre devido à absorção de água pela semente, é o estímulo para a liberação de giberelinas pelo embrião, que têm como alvo as células da camada de aleurona, onde promovem a síntese de enzimas hidrolíticas que irão agir no endosperma durante a germinação. Entre essas enzimas encontra-se a α-amilase, a qual é responsável pela hidrólise do amido. Como resultado, as reservas nutritivas localizadas no endosperma são quebradas e os açúcares e outros produtos são transportados até o embrião em crescimento.
A ação destes hormônios no crescimento do caule e de folhas ocorre pelo estímulo tanto da divisão como do alongamento celular. Esse efeito é mais visível em variedades de plantas com baixa estatura, chamadas de plantas anãs, que sob tratamento com giberelinas se tornam idênticas em altura às plantas normais, sugerindo que essas variedades possam apresentam uma deficiência na produção de giberelinas.
Muitas espécies de plantas apresentam sementes dormentes, ou seja, sementes que não germinam mesmo que as condições estejam favoráveis. O tratamento dessas sementes com luz ou com exposição ao frio pode levar a quebra da dormência, promovendo a germinação. Em substituição a esses tratamentos, a aplicação de giberelinas pode causar a quebra da dormência em algumas espécies, como no alface, tabaco e aveia selvagem. Este hormônio estimula o alongamento celular, permitindo que a raiz atravesse os envoltórios da semente, barreiras que restringem seu crescimento.
O ácido abscísico é um hormônio encontrado em musgos e antóceros (com exceção das hepáticas), Licófitas e Monilófitas, vegetais superiores ou Espermatófitas e fungos. Ele atua no retardamento do crescimento e desenvolvimento desses organismos.
Durante a década de 1960, dois grupos independentes identificaram um composto ativo na iniciação da dormência dos botões em sicômoro e abscisão do caroço do algodão, denominando-o dormina e abscisina II, respectivamente. Após a purificação dos frutos do algodão, a estrutura química desse composto foi determinada em 1965 e passou a se chamar ácido abscísico (ABA).
Pouco depois, descobriu-se que os níveis de ABA aumentam consideravelmente quando as plantas murcham e que o ABA causa o fechamento estomático. Essas duas descobertas destacaram a importância do ABA na mediação das respostas dos tecidos vegetativos aos estresses ambientais, como seca, alta salinidade e baixa temperatura.
O ABA também é necessário para o acúmulo de reservas de nutrientes das sementes, a aquisição de tolerância à dessecação e a interrupção do desenvolvimento embrionário durante a maturação das sementes. Apesar do nome, o ABA não é um importante regulador da absicissão, que é controlada principalmente pelo etileno.(Mongrand, Hare & Chua, 2003)
During the 1960s, two independent groups identified a compound active in the initiation of bud dormancy in sycamore and cotton boll abscission, naming it dormin and abscisin II, respectively. Following its purification from cotton fruits, the chemical structure of this compound was determined in 1965 and it was renamed abscisic acid (ABA). Shortly after this, it was discovered that ABA levels increase considerably when plants wilt and that ABA causes stomatal closure. These two discoveries highlighted the importance of ABA in mediating responses of vegetative tissues to environmental stresses such as drought, high salinity, and low temperature. ABA is also required for the accumulation of seed nutrient reserves, the acquisition of desiccation tolerance, and the arrest of embryonic development during seed maturation. Despite its name, ABA is not a major regulator of absicission, which is primarily controlled by ethylene.(Mongrand, Hare & Chua, 2003)
ÁCIDO ABSCÍSICO
O ácido abscísico (ABA), um hormônio vegetal clássico, foi isolado múltiplas vezes em diferentes estudos. No início dos anos 1950, os pesquisadores isolaram compostos ácidos de plantas, conhecidos como inibidores β; eles separaram esses compostos por cromatografia em papel e mostraram que os inibidores β inibem o alongamento do coleóptilo em aveia. No início da década de 1960, cientistas nos Estados Unidos isolaram um composto de aceleração de abscisão a partir de frutos jovens de algodão, chamado de “abscisina II”. Simultaneamente, pesquisadores do Reino Unido isolaram um fator indutor de dormência a partir de folhas de sicamore tree (Acer pseudoplatanus L. 1753), denominado "dormina" (J.W.Cornforth; B.V.Milborrow; G.Ryback and P.F.Wareing, Nature, Lond. 205, 1269(1965) ,1966, 1967).
A estrutura da abscisina II foi determinada em 1965 e dormina mostrou-se subsequentemente quimicamente idêntica à abscisina II. Este composto foi então renomeado como ácido abscísico para refletir seu suposto envolvimento no processo de abscisão e trabalhos posteriores determinaram que o inibidor β é também ABA (revisado em Cutler et al., 2010; Finkelstein, 2013).
ABA é um composto de 15 carbonos (C15) que pertence à classe dos terpenóidesde. A orientação do grupo carboxila no carbono 2 determina os isômeros trans ou cis do ABA. Além disso, um átomo de carbono assimétrico na posição 1′ no anel determina os enantiômeros S(+) ou R(-).
ABA é sintetizado a partir de β-caroteno via zeaxantina, neoxantina, xantoxina e ABA-aldeído (via C40) (Shinozaki, 2003). (*)
ABA biosynthesis pathway. Intermediates and enzymes involved in ABA biosynthesis are shown. ABA is synthesized from β-carotene via oxidative cleavage of neoxanthin. AAO, ABA aldehyde oxidase; ABA2, ABA deficient 2 (short chain alcohol dehydrogenase); MCSU, molybdenum cofactor sulfurase; NCED, 9-cis-epoxycarotenoid dioxygenese; ZEP, zeaxanthin epoxidase.
Abscisic acid (ABA) is a single 15-C sequiterpenoid hormone that was originally isolated from abscising cotton fruits and maple dormant buds; the (+)-cis ABA enantiomer is the naturally active form found in plants. Although it is a relatively simple molecule, some steps of its biosynthesis are uncertain. ABA biosynthesis in higher plants is indirect and involves xanthophylls (i.e., oxidized forms of carotenoids) as precursors. In plastids, zeaxanthin epoxidation into antheraxanthin and violaxanthin catalyzed by zeaxanthin epoxidase (ZEP) enzymes is considered the first ABA biosynthesis step. Xanthophylls are then cleaved by 9-cis-epoxycarotenoid dioxygenases (NCED) to form xanthoxin. In cytosol, xanthoxin is converted into ABA aldehyde, which is finally oxidized by abscisic aldehyde oxidase (AAO) into ABA.(Le Bris, 2017)
A forma de ocorrência natural é (S)-cis-ABA, enquanto o ABA comercialmente disponível é comumente uma mistura das formas S e R em quantidades aproximadamente iguais.
A luz pode isomerizar (S)-cis-ABA e (R)-cis-ABA para as formas biologicamente inativas (S)-2-trans-ABA e (R)-2-trans-ABA, respectivamente.
Ambos (S)-cis-ABA e (R)-cis-ABA têm forte atividade em respostas ABA prolongadas, como a maturação de sementes; no entanto, o (S)-cis-ABA tem atividade mais forte em respostas ABA rápidas, tal como fechamento estomático (revisado em Cutler et al., 2010; Finkelstein, 2013). Doravante, o termo ABA refere-se a (S)-cis-ABA.
Embora, originalmente se pensasse que o ABA induzisse a abscisão, trabalhos posteriores mostraram que o etileno, ao invés do ABA, regula a abscisão.
A presença de ABA em órgãos em abscisão reflete seu papel na promoção da senescência e/ou respostas ao estresse, as quais precedem a abscisão. ABA promove a abscisão por meio do etileno (Cracker e Abeles, 1969).
Em Arabidopsis, as proteínas quinases dependentes de cálcio ativadas por ABA (CDPKs), CPK4 e CPK11, fosforilam os terminais N da enzima biossintética de etileno 1-aminociclopropano-1-carboxilato sintases (ACS). Esta fosforilação estabiliza ACS e aumenta a biossíntese de etileno (Luo et al., 2014). No entanto, existe uma interação complicada entre etileno e ABA no controle do crescimento e desenvolvimento da planta (Ma et al., 2014). Por exemplo, em arroz (sete espécies, Oryza barthii, Oryza glaberrima, Oryza latifolia, Oryza longistaminata, Oryza punctata, Oryza rufipogon e Oryza sativa), o etileno inibe o crescimento da raiz através da produção de ABA, enquanto o ABA regula negativamente a resposta ao etileno no coleóptilo modulando a expressão de OsEIN2 (Ma et al., 2014) (OsEIN2 is a positive component in ethylene signaling in rice).
Historicamente, o ABA foi considerado um inibidor do crescimento; no entanto, os tecidos jovens têm níveis elevados de ABA e os mutantes deficientes em ABA são severamente atrofiados, demonstrando que o ABA é um importante regulador do crescimento das plantas.
ABA é um hormônio vegetal onipresente e é sintetizado em quase todas as células que contêm cloroplastos ou amiloplastos.
Além disso, os principais componentes da sinalização ABA parecem ser conservados em plantas terrestres (Umezawa et al., 2010). O ABA foi encontrado em algumas bactérias, fungos e uma variedade de metazoários, desde esponjas do mar até humanos. No entanto, o ABA funciona como uma molécula de sinalização crucial apenas em plantas; em outros organismos, o ABA é um componente metabólico secundário.
Nas últimas três décadas, uma combinação de estudos de genética molecular, bioquímicos e farmacológicos identificou quase todas as enzimas na biossíntese e catabolismo de ABA, com mais de 100 loci regulando as respostas de ABA e milhares de genes que são regulados por ABA em vários contextos ( revisado em Finkelstein, 2013). ABA é o regulador central da resistência das plantas a estresses abióticos, como seca, salinidade e baixa temperatura.
Além disso, o ABA regula aspectos importantes do crescimento e desenvolvimento da planta, incluindo o desenvolvimento do embrião e maturação da semente, dormência da semente e germinação, estabelecimento de plântulas, desenvolvimento vegetativo, crescimento da raiz, movimento estomático, floração, resposta a patógenos e senescência (revisado em Finkelstein, 2013 ) (Li et alii, 2017).
Discovery and functions of abscisic acid
Abscisic acid (ABA), a classic plant hormone, was isolated multiple times in different studies. Researchers in the early 1950s isolated acidic compounds, referred to as β-inhibitors, from plants; they separated these compounds by paper chromatography and showed that β-inhibitors inhibit coleoptile elongation in oat. In the early 1960s, scientists in the United States isolated an abscission-accelerating compound from young cotton fruits, called “abscisin II.” Simultaneously, UK researchers isolated a dormancy-inducing factor from sycamore leaves, called “dormin.” The structure of abscisin II was determined in 1965 and dormin was subsequently shown to be chemically identical to abscisin II. This compound was renamed abscisic acid to reflect its supposed involvement in the abscission process and later work determined that the β-inhibitor is also ABA (reviewed in Cutler et al., 2010; Finkelstein, 2013).
ABA is a 15-carbon (C15) compound that belongs to the terpenoid class of metabolites. The orientation of the carboxyl group at carbon 2 determines the trans or cis isomers of ABA. In addition, an asymmetric carbon atom at position 1′ in the ring determines the S (+) or R (−) enantiomers. The naturally occurring form is (S)-cis-ABA, whereas commercially available ABA is commonly a mixture of S and R forms in approximately equal amounts. Light can isomerize (S)-cis-ABA and (R)-cis-ABA to the biologically inactive forms (S)-2-trans-ABA and (R)-2-trans-ABA, respectively. Both (S)-cis-ABA and (R)-cis-ABA have strong activity in prolonged ABA responses, such as seed maturation; however, the (S)-cis-ABA has stronger activity in rapid ABA responses, such as stomatal closure (reviewed in Cutler et al., 2010; Finkelstein, 2013). Hereafter, the term ABA refers to (S)-cis-ABA.
Although ABA was originally thought to induce abscission, later work showed that ethylene, rather than ABA, regulates abscission. The presence of ABA in abscising organs reflects its roles in promoting senescence and/or stress responses, which precede abscission. ABA promotes abscission through ethylene (Cracker and Abeles, 1969). In Arabidopsis, the ABA-activated calcium-dependent protein kinases (CDPKs), CPK4 and CPK11, phosphorylate the N-termini of the ethylene biosynthetic enzyme 1–aminocyclopropane-1–carboxylate synthases (ACS). This phosphorylation stabilizes ACS and increases ethylene biosynthesis (Luo et al., 2014). However, there is a complicated interplay between ethylene and ABA in the control of plant growth and development (Ma et al., 2014). For example, in rice, ethylene inhibits root growth through ABA production, whereas ABA negatively regulates the ethylene response in the coleoptile by modulating OsEIN2 expression (Ma et al., 2014).
Historically, ABA has been thought to be a growth inhibitor; however, young tissues have high ABA levels and ABA-deficient mutants are severely stunted, demonstrating that ABA is an important regulator of plant growth. ABA is a ubiquitous plant hormone and is synthesized in almost all cells that contain chloroplasts or amyloplasts. Also, the major components of ABA signaling appear to be conserved across land plants (Umezawa et al., 2010). ABA has been found in some bacteria, fungi, and a variety of metazoans ranging from sea sponges to humans. However, ABA functions as a crucial signaling molecule only in plants; in other organisms ABA is a secondary metabolic component.
Over the past three decades, a combination of molecular genetics, biochemical, and pharmacological studies have identified almost all of the enzymes in ABA biosynthesis and catabolism, with over 100 loci regulating ABA responses and thousands of genes that are regulated by ABA in various contexts (reviewed in Finkelstein, 2013). ABA is the central regulator of plant resistance to abiotic stresses such as drought, salinity, and low temperature. In addition, ABA regulates important aspects of plant growth and development, including embryo development and seed maturation, seed dormancy and germination, seedling establishment, vegetative development, root growth, stomatal movement, flowering, pathogen response, and senescence (reviewed in Finkelstein, 2013) (Li et alii, 2017).
Formação de camadas de abscisão
As camadas de abscisão são formadas nas folhas jovens e ativas das árvores frutíferas como em folhas de "stone fruit tree" (plantas de frutos com caroço) após a infecção por qualquer um dos vários patógens como fungos, bactérias ou vírus. Uma camada de abscisão consiste em uma lacuna formada entre duas camadas circulares de células foliares que circundam o local da infecção. Após a infecção, a lamela media entre essas duas camadas de células é dissolvida em toda a espessura da folha, cortando completamente a área central da infecção do resto da folha. Gradualmente, essa área murcha, morre e se desfaz, carregando consigo o patógeno. Assim, a planta, ao descartar a área infectada junto com algumas células ainda não infectadas, protege o resto do tecido foliar de ser invadido pelo patógeno e de ser afetado pelas secreções tóxicas do patógeno (Agrios, 2005).
Formação esquemática de uma camada de abscisão em torno de uma mancha doente de uma folha de Prunus. [Apud Samuel (1927).] (A – C) Manchas nas folhas e buracos feitos po rbactérias Xanthomonas arboricola pv. pruni. Em (A) folhas de cerejeira ornamentais; halos largos e verdes claros característicos se formam ao redor da área infectada antes que todo o tecido afetado caia, (B) no pêssego e (C) na ameixa. O efeito de buracos de tiro é particularmente óbvio nas folhas de ameixa.(Agrios, 2005).
Schematic formation of an abscission layer around a diseased spot of a Prunus leaf. [After Samuel (1927).] (A–C) Leaf spots and shot holes caused by Xanthomonas arboricola pv. pruni bacteria on (A) ornamental cherry leaves; characteristic broad, light green halos form around the infected area before all affected tissue falls off, (B) on peach, and (C) on plum. The shot hole effect is particularly obvious on the plum leaves.
"stone fruit tree"
A ameixa, o pêssego e a nectarina, a cereja doce e ácida (azeda), o damasco (Prunus armeniaca (L.) e a cereja cornalina pertencem ao grupo dos frutos de caroço de acordo com a classificação pomológica.
Com exceção da cereja cornalina, todos os membros do grupo das frutas de caroço pertencem aos gêneros Prunus L. da família Rosaceae.
A cereja cornalina pertence ao gênero Cornus da família Cornaceae. O nome latino, ou seja, binomial, é Cornus mas L. (Milošević and Milošević, 2020)
"stone fruit tree"
Plum, peach and nectarine, sweet and sour (tart) cherry, apricot, and cornelian cherry belong to the group of stone fruits according to pomological classification. With the exception of cornelian cherry, all members of the group of stone fruits belong to the Prunus L. genera from Rosaceae family. Cornelian cherry belongs to the Cornus genus from Cornaceae family. The Latin, that is, binomial, name is (Cornus mas L.) (Milošević and Milošević, 2020)
Formation of Abscission Layers
Abscission layers are formed on young, active leaves of stone fruit trees after infection by any of several fungi, bacteria, or viruses. An abscission layer consists of a gap formed between two circular layers of leaf cells surrounding the locus of infection. Upon infection, the middle lamella between these two layers of cells is dissolved throughout the thickness of the leaf, completely cutting off the central area of the infection from the rest of the leaf (Fig. 6-7). Gradually, this area shrivels, dies, and sloughs off, carrying with it the pathogen. Thus, the plant, by discarding the infected area along with a few yet uninfected cells, protects the rest of the leaf tissue from being invaded by the pathogen and from becoming affected by the toxic secretions of the pathogen.(Agrios, 2005).
ABA is involved in various physiological processes. ABA is a mediator of abiotic stresses such as drought, high temperatures, cold temperatures, or salinity. With drought and salt stresses, it contributes to maintenance of plant water homeostasis by inducing stomatal closure and increasing the root water uptake ability. ABA regulates various aspects of reproductive development such as flower senescence, fruit ripening, and seed formation. ABA prevents premature germination and controls dehydration and accumulation of reserves or dormancy induction and maintenance in seeds. It inhibits shoot growth and development. According to some apical dominance models, it may be a secondary inhibitor induced by auxins to limit lateral bud outgrowth. Exogenous ABA causes inhibition of lateral bud growth and, after shoot apex decapitation, ABA content usually decreases in the axillary buds. (Le Bris, 2017)
Citocininas são hormônios vegetais responsáveis pela divisão celular. As citocininas foram descobertas durante as pesquisas dos fatores que estimulam as células vegetais a se dividirem (sofrerem citocinese). Acredita-se que esses hormônios são produzidos nos meristemas das raízes, folhas e frutos jovens, além de sementes em desenvolvimento. O transporte de citocinina para as diversas partes do vegetal é feito principalmente pelo xilema.
A zeatina foi a primeira citocinina natural descoberta Letham, em 1973, isolou de extratos de endosperma imaturo de milho (Zea mays) uma substância que tinha o mesmo efeito biológico da cinetina, e identificou-a como trans-6-(4-hidroxi3-metilbut-2-enilamino)purina, a qual chamou de zeatina.
Desde a sua descoberta, as citocininas têm apresentado efeitos em vários processos fisiológicos e de desenvolvimento da planta dependendo de sua concentração, as citocininas podem agir sobre
1) A senescência foliar,
2) A mobilização de nutrientes,
3) A dominância apical,
4) A formação e a atividade dos meristemas apicais,
5) O desenvolvimento vascular,
6) Aumentando os níveis de clorofila nas folhas dos vegetais;
7) Acelerando a germinação;
8) Fazendo com que a planta produza uma maior quantidade de folhas próximas ao meristema apical;
9) Reduzindo a dominância apical (auxinas e citocininas têm efeito contrário, enquanto as auxinas inibem o crescimento das gemas laterais, as citocininas atuam induzindo essas gemas a se desenvolverem);
10) Retardando a senescência da planta, entre outros.
11) Quebra de dormência em de gemas.
12) Interação com outros organismos
Todavia o controle da divisão celular, processo fundamental no crescimento e desenvolvimento vegetais, é considerado a principal função dessa classe de reguladores de crescimento.
Germinação
Germinação de Psidium cattleianum
Fases da germinação e formação de plântula de Psidium cattleianum Sabine A. Início do desenvolvimento, abertura do opérculo; B. Emissão da radícula; C. Diferenciação da raiz e do hipocótilo; D. Emergência dos paracotilédones; D. Plântula com paracotilédones expandidos; E. Plântula normal com eofilos desenvolvidos. (tg: tegumento; o: opérculo; r: radícula; hp: hipocótilo; cl: colo; rp: raiz primária; pc: paracotilédone; ga: gema apical; ef: eofilo; ep: epicótilo; rs: raiz secundária).
[Figure 1: Stages of Psidium cattleianum Sabine germination and seedling formation; A. Early development, opening the operculum, B. Radicle protrusion, C. Differentiation of root and hypocotyl, D. Emergence of paracotyledons, D. Seedling with expanded paracotyledons E. Eophylls with normal seedling development. (tg: integument, o: operculum; r, radicle; hp: hypocotyl; cl: collar; rp: primary root; pc: paracotyledon; ga: apical bud; ef: eophyll; ep: epicotyl, rs: secondary root). (Gomes et alii, 2015)].
FISIOLOGIA VEGETAL
https://www.bbc.com/portuguese/curiosidades-50643995
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/linolenic-acid
https://www.sciencedirect.com/topics/medicine-and-dentistry/phytohormone
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/abscisic-acid
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/physiological-process
https://journals.plos.org/plosgenetics/article?id=10.1371/journal.pgen.1004701
https://funricegenes.github.io/OsEIN2/
https://pt.wikipedia.org/wiki/Arroz
https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/stone-fruits
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/abscisic-acid
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/abscission
https://youtu.be/cKEi90Z_iBg
https://www.youtube.com/watch?v=yXqRsH8Dul4
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/carotenoids
https://en.wikipedia.org/wiki/Cornus_mas
(*) Carotenoids are plant pigments with yellow, orange, and red colors and are composed of a 40-carbon skeleton of isoprene units covalently linked together giving them multiple conjugated double bonds (Figure 4). The structure may be cyclized at one or both ends, have various hydrogenation levels, or possess oxygen-containing functional groups. Lycopene and α-carotene are examples of acyclized and cyclized carotenoids, respectively. Carotenoid compounds most commonly occur in nature in the all-trans form. The most characteristic feature of carotenoids is the long series of conjugated double bonds forming the central part of the molecule. This gives them their shape, chemical reactivity, and light-absorbing properties. There are two main groups of carotenoids, the carotenes and the xanthophylls. The carotenes are hydrocarbons (they are composed of only carbon and hydrogen) and the xanthophylls contain oxygen in their structures.
Carotenóides são pigmentos vegetais com cores amarelo, laranja e vermelho e são compostos por um esqueleto de 40 carbonos de unidades de isopreno covalentemente ligadas entre si, dando-lhes múltiplas ligações duplas conjugadas. A estrutura pode ser ciclizada em uma ou ambas as extremidades, ter vários níveis de hidrogenação ou possuir grupos funcionais contendo oxigênio. O licopeno e o α-caroteno são exemplos de carotenóides aciclizados e ciclizados, respectivamente. Os compostos carotenóides ocorrem mais comumente na natureza na forma totalmente trans. A característica mais notável dos carotenóides é a longa série de ligações duplas conjugadas que formam a parte central da molécula. Isso lhes dá sua forma, reatividade química e propriedades de absorção de luz. Existem dois grupos principais de carotenóides, os carotenos e as xantofilas. Os carotenos são hidrocarbonetos (são compostos apenas de carbono e hidrogênio) e as xantofilas contêm oxigênio em suas estruturas.