HIDROSFERA
ÁGUA: IMPORTÂNCIA, CICLO, COMPOSIÇÃO, PROPRIEDADES E ESTADOS FÍSICOS
Hidrosfera é a esfera de todas as águas do planeta, os quais formam uma camada descontínua sobre a superfície da Terra.
A palavra hidrosfera vem do grego antigo: ὕδωρ, hýdōr, água, mais σφαῖρα, sphaîra, esfera; hidro + esfera = esfera da água.
A hidrosfera compreende todos os rios, ribeirões, córregos, riachos, lagos, lagoas, mares, oceanos e todas as águas subterrâneas (lençóis freáticos e aquíferos), bem como as águas marinhas e salobras, águas glaciais e lençóis de gelo, vapor de água, as quais correspondem a 70% de toda a superfície terrestre, sendo que os oceanos são responsáveis por 97,2% de toda a água, isso significa que cerca de 2/3 da superfície terrestre é coberta por oceanos.
A hidrosfera e a atmosfera juntas permitem a vida no planeta, tendo sido também os agentes formadores dos mais importantes combustíveis fósseis: o petróleo e o carvão.
Compõe junto com a atmosfera e a litosfera as três principais compartimentos da Terra: Litosfera, Hidrosfera, e Atmosfera.
ORIGEM DA ÁGUA
A Terra é única na história do Sistema Solar: é o único planeta com água nos tres estados (sólido,líquido e gasoso) e possui vida em todos os seus compartimentos: litosfera, atmosfera e hidrosfera.
Esse líquido cobre 70% do espaço total disponível na Terra, tornando-se a substância mais predominante no mundo.
Nesta porcentagem entram os oceanos, mares, rios e bacias hidrográficas que conectam os estreitos territórios de todos os países do mundo.
A história da água, "envolve nosso lar em um contexto muito maior, que se estende até o Universo e nos coloca em uma rica família de mundos oceânicos que abrangem nosso Sistema Solar e além".
O que sabemos sobre a origem da água?
De onde veio a primeira gota d’água da Terra?
A origem definitiva da água está na química: uma molécula de água é composta de um átomo de oxigênio e dois átomos de hidrogênio (H2O). O hidrogênio nasceu no Big Bang, enquanto o oxigênio é abundante nos núcleos de estrelas ainda mais massivas do que o Sol.
Entretanto, os marcadores químicos na água dos oceanos sugerem que a maior parte da água veio de asteroides e cometas que colidiram com a Terra há milhões de anos. Ao observarmos a lua notamos que sua superfície é
Existe água fora da Terra?
Em outros sistemas espaciais (estrelas, nebulosas, luas e outros planetas), a água pode ser encontrada em estado gasoso. Um exemplo é a Nebulosa de Órion: a grande nuvem de gás e poeira é composta principalmente de hidrogênio, e as moléculas de água presentes são comparativamente raras em relação às conhecidas na Terra. "Sua produção diária de água é tão grande que poderia cobrir 60 vezes os oceanos da Terra", mostram as pesquisas da NASA.
Nebulosa de Órion
Vênus pode ter sido o primeiro mundo oceânico do Sistema Solar: o segundo planeta do Sistema Solar não possui um campo magnético, o que enfraquece sua atmosfera. Portanto, os astrônomos da Nasa afirmam que um forte efeito estufa ferveu a água em seu interior, espalhando-a pelo espaço.
A agência norte-americana informa que Marte contém água congelada em seus polos e sob o solo, embora uma pequena quantidade de água salobra e lamacenta possa ser vista descendo as encostas das colinas marcianas durante as estações mais quentes.
Finalmente, nas luas de Júpiter, Europa e Ganimedes suspeita-se que existam oceanos de água salgada sob suas crostas frias. Ganimedes pode até ter várias camadas de gelo e água entre sua crosta e seu núcleo, resume a Nasa.
A origem da primeira água na história da Terra pode estar relacionada com a formação da atmosfera, pela desgaseificação (eliminação de gás de um sistema
por aquecimento, vácuo, absorção, adsorção ou qualquer outro procedimento adequado físico ou
químico) do planeta.
Portanto, este termo refere-se ao fenômeno de liberação de gases por um sólido ou líquido quando
este é aquecido ou resfriado. Este processo, atuante até hoje, teve início na fase de resfriamento
geral da Terra, após a fase inicial de fusão parcial.
Neste gradativo resfriamento e formação de rochas ígneas, foram liberados gases, principalmente
vapor de água H2O e gás carbônico CO2, entre vários outros, como subprodutos voláteis da
cristalização do magma.
A geração de água sob forma de vapor é observada atualmente em erupções vulcânicas, sendo
chamada de água juvenil.
Logo surge outra dúvida: o volume de água que atualmente compõe a hidrosfera foi gerado
gradativamente ao longo do tempo geológico ou surgiu repentinamente num certo momento desta
história?
Os geólogos defendem a segunda possibilidade. Existem evidências geoquímicas que suportam a
formação de quase toda a atmosfera e a água hoje disponível nesta primeira fase de resfriamento da
Terra; desde então, então este volume teria sofrido pequenas variações, apenas reciclagem, através
do ciclo das rochas.
FÓRMUA DA ÁGUA
MOLÉCULA DE ÁGUA
A molécula de água é formada por três átomos: dois de Hidrogênio e um átomo de oxigênio, unidos por duas ligações covalentes O - H, sendo H - O - H sua fórmula estrutural.
Átomos de hidrogênio existentes naturalmente
Átomo de Oxigênio e sua distribuição de elétrons
Formas de representar a molécula de água
A água possui, uma dipolaridade bastante forte com as cargas positivas do hidrogênio e negativas do oxigênio, resultando em uma forte rede de ligações intermoleculares. Essas ligações são denominadas pontes de hidrogênio e são interagidas pela força de Van der Waals. O átomo de oxigênio possui seis elétrons na camada de valência, portanto são necessários mais dois elétrons para que ele atinja estabilidade eletrônica. O átomo de hidrogênio possui apenas um elétron, sendo necessário para sua estabilidade mais um elétron (camada K= dois elétrons). Portanto, na molécula de água há o compartilhamento de um par de elétrons entre cada átomo de hidrogênio com o átomo de oxigênio. Esse compartilhamento de elétrons é o que constitui a ligação covalente.
Ligação entre o oxigênio e o hidrogênio, ligação covalente e ligação de hidrogênio.
(Texto a seguir)
Ligação entre moléculas vizinhas, ligação de hidrogênio.
Formas de representar a molécula de água
A molécula de água se liga a outra molécula de água por meio de ligação de hidrogênio. Devido a distribuição dos elétrons na molécula a água se constitui como uma substância polar o que facilita sua atuação como solvente (dissolver outras substâncias).
A interação com solutos ocorre porque a água é um líquido polar (com cargas).
A água pode dissolver:
Sais cristalinos: Interação com íons que unem os átomos do sal
Compostos orgânicos polares: açúcares, álcoois, aldeídos, cetonas, ácidos
formação de pontes de hidrogênio com os grupos hidroxila (OH) ou carbonila (COOH)
Características especiais da estrutura intramolecular e intermolecular.
a) ligações covalentes entre os átomos de O e H, b) polaridade de uma molécula de água) e c) ligações de hidrogênio: ligações intermoleculares estabelecida entre uma molécula de água, e suas vizinhas. Arranjo entre moléculas de água vizinhas devido as atração do Oxigênio (carga negativa) de uma molécula e o Hidrogênio (carga positiva) de outra molécula vizinha. O átomo de oxigênio é mais eletronegativo que o de hidrogênio, ou seja, o núcleo do oxigênio atrai os elétrons envolvidos na ligação O-H mais fortemente que o núcleo do hidrogênio. Essa propriedade é decisiva na polaridade da molécula de água, uma vez que torna o oxigênio mais negativo (com os elétrons mais próximos) e o hidrogênio mais positivo (com os elétrons mais afastados). Ou seja, a molécula de água é polar, sendo o oxigênio seu pólo negativo (já que são dois elétrons a mais) e os hidrogênios seus pólos positivos (um elétron a menos para cada átomo). (Adaptado de UFRGS, bioweb, lhmet).
Ligação de hidrogênio
Como água é um composto polar, o pólo positivo de uma molécula atrai o pólo negativo de outra, o que resulta em uma atração eletrostática. Essa atração é chamada ligação de hidrogênio (ou ponte de hidrogênio), e ocorre entre átomos de hidrogênio com oxigênio, nitrogênio ou fluor. As ligações de hidrogênio, apesar de serem as mais fortes entre as forças consideradas fracas, são bem menos estáveis que as ligações covalentes, prova disso é que a energia de dissociação de uma ligação de hidrogênio entre moléculas de água é cerca de 23 kJ/mol, enquanto que a da ligação O-H (covalente) da água é de 470 kJ/mol.

Ligação de hidrogênio entre duas moléculas de água vizinhas
Outra característica das ligações de hidrogênio é a rapidez com que elas se formam e são quebradas. A todo instante moléculas de água estão interagindo entre si, formando ligações de hidrogênio que duram de um a vinte picossegundos (1 ps = 10 elevado na -12 s). Quando uma ligação se quebra, imediatamente outra se forma.
No estado líquido, cada molécula de água faz, em média, três ligações de hidrogênio, devido ao aumento da entropia (grau de desordem do sistema).
A molécula de água, apesar de ter apenas dois hidrogênios, tem uma conformação muito semelhante à da molécula de metano (CH4), tetraédrica (Figura abaixo), uma vez que o átomo de carbono possui, assim como o do oxigênio, quatro orbitais, e a massa molar dessas duas substâncias é muito semelhante (metano: 16 g/mol; água: 18 g/mol). Mas no metano há quatro ligações C - H iguais, fazendo com que não haja modificação de ângulos. Já na molécula da água, como foi dito acima, os orbitais livres do oxigênio se repelem, e o ângulo entre as ligações O - H é diminuído de 109,5° (tetraedro perfeito, como na molécula de metano, Fig. 1) a 104,5° (UFRGS).

Estrutura do Metano (CH4) ou gás dos pântanos
As ligações de hidrogênio, portanto, influenciam nos estados físicos da água. Como foi dito anteriormente, a molécula de água é semelhante à de metano, que é um gás em temperatura ambiente. Mas o metano é apolar e, por isso, não faz ligações de hidrogênio.
A água também seria gasosa em temperatura ambiente, mas as ligações de hidrogênio causam uma maior organização entre suas moléculas, mantendo-a no estado líquido na temperatura ambiente e alto ponto de ebulição.
No interior de uma quantidade de água, as moléculas sofrem atração umas pelas outras (formam ligações de hidrogênio), de modo que a força resultante sobre cada molécula é nula. Entretanto, na superfície da água, as moléculas estão em contato tanto com outras moléculas de água como com moléculas de gases presentes no ar. A atração do ar pelas moléculas de água é muito menor do que a que ocorre entre as moléculas água-água, de modo que a força resultante nas moléculas de superfície não é nula. A conseqüência disso é a formação de um filme, uma finíssima membrana que limita a água e dificulta que gases a penetrem. Além disso, esse filme constitui uma barreira mecânica, que dificulta a penetração de pequenas partículas na água. Um exemplo claro dessa barreira mecânica é mostrado na figura abaixo. A essa propriedade da água damos o nome de tensão superficial. (UFRGS).
Trata-se da formação de uma fina película sob um líquido devido à desigualdade de atrações entre as moléculas que o compõe. Esse fenômeno ocorre de maneira mais acentuada nos líquidos que possuem forças intermoleculares intensas, como a água.
As interações entre as espécies de um líquido são chamadas de forças de coesão. Enquanto que as moléculas no interior de um líquido sofrem atrações por moléculas vizinhas em todas as direções, as moléculas na superfície interagem com as moléculas abaixo e ao lado delas. Veja como ocorre a tensão superficial na água.
A água (H2O) é uma molécula polar formada por 2 átomos de hidrogênio (polos positivos) e um átomo de oxigênio (polo negativo) unidos por ligações covalentes. O polo positivo de uma molécula é atraído pelo polo negativo da molécula vizinha, formando as ligações de hidrogênio.
Esse tipo de interação no interior do líquido está distribuído em todas as direções. Na superfície, as forças estão direcionadas para baixo e para os lados, pois acima delas não há moléculas de água. Isso faz com que as moléculas da superfície fiquem mais coesas e criem uma película elástica.
A unidade de tensão superficial é dada pelo quociente entre unidade de força e unidade de comprimento, sendo as mais adotadas o dina/centímetro (dina/cm) e newton/metro (N/m) (todamateria).

Direção das forças atuantes sobre as moléculas de água no interior e na superfície de uma solução.

A tensão superficial permite que insetos caminhem sobre a água.
As gotas de água são esféricas devido à contração nas moléculas da superfície provocada pela tensão superficial. A esfera ocorre porque essa é a forma geométrica em que se tem a menor relação entre área superficial e volume. Sendo assim, a forma esférica mantém o menor número de moléculas de água em contato com o ar. (todamateria).
Tensão superficial
Quando inspiramos certa quantidade de ar, necessitamos que o ar penetre em nossos alvéolos para que seja o oxigênio seja trocado pelo CO2 (dióxido de carbono), para que o O2 seja levado para todas as nossas células, e o CO2 seja eliminado.
Todavia o citoplasma das células alveolares é composto, entre outras coisas, por água (70%) e, devido a isso apresenta tensão superficial.
Então, como o O2 penetra o citoplasma das células alveolares? No nosso pulmão, as células que formam os alvéolos são os pneumócitos primários e secundários. Os pneumócitos II produzem uma substância capaz de diminuir a tensão superficial da água, o surfactante (dipalmitoil-lecitina). O surfactante é uma molécula de detergente, e como tal apresenta uma porção polar (cabeça) e uma apolar (cauda). [Em água, essas substâncias tendem a formar micelas, entretanto, há uma concentração micelar crítica – limite de concentração de fosfolipídeos em que há formação de micelas – e a partir desse ponto não há mais formação de micelas. O pneumócito II secreta surfactante em concentração acima da micelar crítica, de modo que algumas moléculas não conseguem formar micelas, nem interagem com a água.] Essas moléculas rompem a membrana da superfície da água para poderem interagir com o ar, que é apolar. Desse modo, a tensão superficial é rompida e a entrada de O2 nas células alveolares é facilitada.
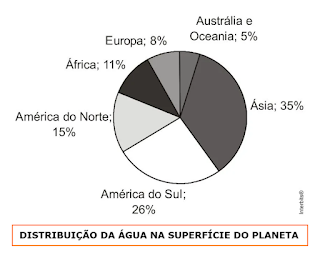
DISTRIBUIÇÃO DA ÁGUA NO PLANETA
Distribuição da água no planeta
(modif. de guiadoestudante)
97% MARES E OCEANOS - ÁGUA SALGADA - ESTADO LÍQUIDO
2,2% GELO, CALOTAS POLARES, GELEIRAS, PERMAFROST, CUME DE MONTANHAS, ESTADO SÓLIDO.
0,6% NO INTERIOR DA CAMADA SUPERFICIAL DO SOLO - ESTADO LÍQUIDO
0,1% RIOS E LAGOS - ESTADO LÍQUIDO
0,1% NA FORMA DE VAPOR NA ATMOSFERA - GASOSO (vapor).
A distribuição da água no planeta pode ser observada a partir da composição dessa substância.
Desta forma, esse recurso pode aparecer de forma duas formas água salgada e água doce.
Água salgada
Presente nos oceanos, mares e alguns lagos
Água doce
referente à água que não possui uma grande densidade de sal em sua composição. Essa última, que é a água própria para consumo humano animal e vegetal, pode apresentar-se ainda em diversas subdivisões. (brasilescola)
(1)
(2)
(3)
(4)
(Fonte: brasilescola. Ver exercícios desse link)
ÁGUA NO CORPO HUMANO
(Fonte: brasilescola)
A maioria dos mais importantes processos que ocorrem na Terra, de algum modo apresentam a água como papel fundamental. É assim com o intemperismo, formação de rochas, a Vida e o clima. Esse fato é tão verdadeiro que para procurar vida no universo, como a conhecemos, devemos procurar pela água. Sem água não há vida, uma vez que não é possível que ocorram reações bioquímicas no citoplasma da célula. As células ao se agruparem formam tecidos, um conjunto de tecidos formam órgãos, é um conjunto de órgãos forma o organismo, i.e., o corpo.
O corpo humano é composto de cerca de 60% a 70% (ou 60-75%) de água e, por isso, a água é imprescindível para a manutenção de uma boa saúde.
como vimos, água é o constituinte mais abundante do corpo humano. Apesar de ser um composto simples, formado por duas moléculas de hidrogênio e uma de oxigênio (H2O), é um nutriente fundamental à vida e desempenha diversas funções orgânicas, sendo sua ingestão diária essencial à saúde.
Desempenha papel fundamental na manutenção do volume plasmático, atua no controle da temperatura corporal, age no transporte de nutrientes e na eliminação de substâncias não utilizadas pelo organismo, e ainda participa ativamente dos processos digestório, respiratório, cardiovascular e renal (PHILIPPI, 2008, Carvalho e Zanardo, 2010).
Entretanto, a quantidade que deve ser ingerida ainda deixa algumas dúvidas.
“Por ser tão crítica (essencial é necessária) para a vida, há processos fisiológicos que controlam de forma estrita o balanço de sal e água no organismo (o balanço hídrico). A perda ou eliminação de água pelo corpo acontece principalmente pela produção do suor, respiração, urina e fezes.
Sabemos que nosso corpo é incapaz de armazenar água para uso futuro, sendo essa substância frequentemente eliminada para o meio. A perda de água pelo organismo é incontrolável e relaciona-se com importantes processos fisiológicos.
Eliminação de água diária pelo corpo:
1) 0,1 litro (100 ml) pelas fezes (75% das fezes são água)
2) 0,5 litro pela respiração (na forma de vapor),
3) entre 0,5 e 1 litro pela transpiração,
4) entre 1 a 1,5 litro de água por dia em média pela urina.
Assim, com uma ingestão de líquidos em torno de 2,500 mL/dia (2,5 L/dia), cerca de 100 mL serão excretados nas fezes, 0,5 litro pela respiração (na forma de vapor), entre 0,5 e 1 litro pela transpiração enquanto a maioria, 1.500 mL, será excretada na urina. Para um adulto médio, isso corresponde a 5% do volume total de água presente no corpo.
(Fonte: UFRN, 2020)
(SGB)
Para que o organismo se mantenha funcionando, as reações bioquímicas necessitam da água e são fundamentais: desde a troca de CO2 por O2 na respiração até a digestão. “Ela transporta nutrientes e oxigênio pela corrente sanguínea, mantém a concentração correta para a manutenção do equilíbrio eletrolítico e ácido-base, regula a temperatura corporal, mantém a estrutura celular, incluindo a membrana celular e a estrutura das proteínas e dos ácidos nucleicos e é vital para a excreção de substâncias tóxicas pela urina e fezes. A água é tão crítica para a vida que se você perder mais que 4% da água corporal total os sintomas de desidratação irão surgir e, se houver uma perda maior que 15%, ela pode ser fatal” (Ueno, 2023).
Como vimos, nossas células, no processo de respiração celular, convertem os nutrientes e o oxigênio que chegam pela corrente sanguínea em gás carbônico (CO2) e água. Assim, um adulto de cerca de 70 kg ‘fabrica’, aproximadamente, 700 mL de água por dia.
As perdas de água ocorrem de três maneiras:
1) uma parte corresponde à produção de secreções (saliva, suco gástrico e suor, por exemplo),
2) a outra parte é eliminada na respiração e
3) uma última parte está presente na urina e nas fezes.
Um estudo publicado pela Science (Variation in human water turnover associated with environmental and lifestyle factors. Science (378) 6622, 2023), salienta que o volume para consumo diário é determinado por diversos fatores como sexo, idade, aspectos físicos, umidade do ar, temperatura e até mesmo o IDH (Índice de Desenvolvimento Humano).
Assim, não existe uma quantidade ideal de água, como os famosos dois litros, já que a influência de múltiplos pontos modifica a necessidade de cada indivíduo.
Não há um valor “normal” ou recomendável para se ingerir ao dia. Geralmente, para um adulto numa dieta normoproteica padrão, cerca de 1 a 1,5 litro de água será suficiente para manter o balanço hídrico. Porém, esse valor dependerá do metabolismo individual, da idade, da distribuição de gordura corporal, das condições ambientais, da atividade física e de outros fatores que afetam a perda de água.
Há uma ideia generalizada de que consumir água faz bem à saúde. Como descrito acima, há mecanismos fisiológicos para a manutenção de um equilíbrio hídrico e caso haja falta de água a sede aparecerá.
Porém, mesmo não havendo um volume ideal a ser ingerido, o professor Roberto Zatz, da disciplina de Nefrologia do Departamento de Clínica Médica da Faculdade de Medicina da USP, afirma que certos grupos devem ficar mais atentos à quantidade de água: “Alguns grupos costumam ser encorajados a manter um certo nível de consumo, em geral algo próximo aos famosos dois litros/dia, para aumentar o fluxo urinário. Os exemplos são: indivíduos com infecção urinária ou com tendência a desenvolvê-la: embora não haja evidências conclusivas, firmou-se o conceito, muito razoável, de que um fluxo urinário alto dificulta a fixação de bactérias à via urinária; outro grupo que pode se beneficiar de um consumo mais alto de fluidos é constituído de pessoas com propensão a formar cálculos urinários, as “pedras nos rins”. Na ausência de tais condições, não há fundamento para o conceito de que o hábito de consumir altas quantidades de água sirva para “limpar o organismo” ou traga qualquer outro benefício.
De forma simplificada, para manter a quantidade de água eliminada pelo nosso corpo diariamente, é preciso repor essas perdas que estão ocorrendo, comenta o professor Eduardo Barbosa Coelho, da área de Nefrologia do Departamento de Clínica Médica da Faculdade de Medicina de Ribeirão Preto da USP.
O volume ingerido de líquido diariamente deverá ser equivalente às perdas de líquidos que os corpos sofrem incluindo a transpiração resultante de esforços físicos e do clima. Há uma grande quantidade de variáveis que pode alterar na quantidade diária de consumo de água, como por exemplo podemos citar: esforço físico, idade, gênero, temperatura do local e gravidez. No entanto, em média a OMS (Organização Mundial de Saúde), presume o consumo médio de 2 litros de água potável por dia para adultos.
A tabela a seguir apresenta informações sobre volumes de água necessário para hidratação diária (extraído de artigo da OMS, 2005).
(Fonte: SGB)
Dá para fazer um cálculo individual empírico:
Devemos multiplicar 35 ml (de água) pelo peso do seu corpo, uma vez que necessitamos em média 30 a 40 ml de água para cada quilograma de peso corporal.
Por exemplo: uma pessoa que pesa 55 quilos:
35ml x 55Kg = 1,925 litros
Logo:
Essa pessoa de 55 kg deve tomar pelo menos 1,9 litro diariamente.
E uma pessoa de 89 kg ?
35ml x 89kg = 3,115 litros
MUDANÇAS DE ESTADO DA ÁGUA
A água é a única substância que se encontra na natureza (do planeta Terra) nos três estados físicos, ou estado de agregação: sólido, líquido, e gasoso.
Esse fenômeno ocorre porque o nosso planeta está na “Zona habitável” da nossa estrela. A zona continuamente habitável é uma região ao redor de uma estrela na qual corpos de massa planetária podem sustentar água líquida por um determinado período de tempo.
(1)
(2)
A proteção natural contra o clima espacial, como a magnetosfera gerada pelo próprio planeta Terra, retratada nesta concepção artística, pode ser necessária para que planetas sustentem a água da superfície por períodos de tempo prolongados, e consequente possam desenvolver, sustentar e possibilitar a evolução da vida.
Vista esquemática da magnetosfera da Terra e de vários eventos que podem seguir o impacto do material ejetado solar no lado diurno da magnetosfera. A superfície azul representa as superfícies de fluxo magnético quase estacionário que resultam da interação quase estacionária do vento solar com o campo magnético da própria Terra.
A capacidade da água de transitar entre os estados de agregação ocorre porque a molécula de água apresenta propriedades específicas que são o resultado da sua estrutura atômica e dos tipos de ligações que mantêm suas moléculas unidas.
Os estados físicos da água são os estados de agregação dessa substância em função da temperatura e pressão.
A água pode se apresentar na forma sólida, líquida e gasosa.
Ao nível do mar: 0 m de altitude, pressão de 1 atmosfera, (1 atm) ou 760 mmHg, a água se funde a 0 °C e entra em ebulição aos 100 °C.
Quando a água ferve e evapora pode-se dizer que ela entrou em ebulição.
O ponto de ebulição (PE) representa a temperatura em que quando alcançada essa substância muda seu estado de agregação. Quando a água chega a 100°C ela passa do estado líquido para o estado gasoso.
Mas a água pode passar do estado sólido para o líquido e do estado líquido para o gasoso e deste de volta ao estado líquido a temperatura ambiente e a 1 atm.
Variáveis como pressão atmosférica e altitude, influenciam no processo de mudança de estado físico.
A matéria possui três estados físicos: sólido, líquido e gasoso, que podem transforma-se entre si de acordo com a temperatura e pressão.
• Fusão: passagem do estado sólido para o estado líquido
• Solidificação: passagem do estado líquido para o estado sólido
• Vaporização: passagem do estado líquido para o estado gasoso
• Sublimação: passagem do estado sólido para o estado gasoso
•. Ressublimação: passagem do estado gasoso para o estado sólido
• Condensação ou liquefação: passagem do estado gasoso para o estado líquido
Mudança de estado físico e a energia (calor) envolvido (trocado)
Processo endotérmico: Processo onde há ganho de energia (calor)
Processo exotérmico: Processo onde há liberação de energia (calor)
(1)
Calor e ebulição (2)
Ebulição, vaporização e condensação da água (3)
A vaporização, onde ocorre a passagem do estado líquido para o gasoso, pode acontecer de três modos distintos:
• Calefação: a mudança de estado físico acontece de forma rápida e quase instantânea. Podemos dizer que a calefação é uma forma de vaporização muito mais rápida. Ocorre quando um líquido entra em contato com uma superfície que está com a temperatura mais elevada que o ponto de ebulição desse líquido.
A calefação acontece quando a superfície está com uma temperatura superior ao ponte de ebulição da água. Por exemplo, gotas de água jogadas em uma panela em aquecimento ou água jogada sobre a chapa quente de um fogão a lenha.
• Ebulição: no caso da água é conhecido popularmente como “fervura”, isso porque para que ocorra a mudança de estado físico a substância deve receber calor (energia) para que as partículas unidas se separem e aconteça a transformação de estado físico;
• Evaporação: processo de mudança do estado líquido para o gasoso de forma lenta e gradual. Por exemplo, as roupas úmida que secam no varal. A água que está no estado líquido adsorvidas entre as fibras que constituem a roupa (fibras de algodão, lã e fibras sintéticas), recebem energia do Sol e do vento. Ao receberem energia (Sol, vento, secadora) as molécula vibra e a ligação de hidrogênio se desfaz possibilitando a molécula ficar livre e ir para atmosfera. (Modif. educamaisbrasil)
(1)
(2)
Roupas úmidas secando ao Sol no varal.
Ponto de ebulição da água
Quando a água é colocada para esquentar em uma panela ou chaleira, a transformação do estado líquido para o gasoso acontece por etapas. Inicialmente, com o aquecimento da substância, as suas partículas se agitam e bolhas de vapor são formadas no fundo da panela. (educamaisbrasil)
(1)
(2)
Água em ebulição a 100°C ao nível do mar.
(Fonte: taylorscience)
Essas bolhas estão na parte inferior do recipiente, pois a pressão atmosférica dentro delas é menor. Na medida que recebem mais calor, a água esquenta e a pressão dentro das bolhas se iguala à do ambiente, fazendo com que elas subam para superfície e entrem em ebulição.
Mesmo com o contínuo aquecimento da água, durante o processo de ebulição ela não muda de temperatura. A energia recebida serve apenas para promover a agitação e o afastamento das suas partículas (moléculas).
A água é uma substância pura que apresenta ponto de ebulição em 100º C, ao nível do mar (1 atm ou 760 mmHg). Deste modo, a sua temperatura não irá ultrapassar os 100º C na forma líquida e permanecerá constante até ser transformada em vapor.(educamaisbrasil)
Influências da pressão e da altitude no ponto de ebulição
É sabido que a água atinge seu PE em 100º C, ao nível do mar. A pressão atmosférica e a altitude exercem influências diretas no processo de ebulição, sendo assim essas variáveis podem alterar o PE da água.
Para exemplificar essa relação, podemos observar a localização de três regiões: as cidades de Salvador e São Paulo e o Monte Everest (cordilheira do Himalaia). Todos esses locais possuem altitudes diferentes, logo a pressão exercida sobre as matérias não será igual. (educamaisbrasil)
A cidade de Salvador possui altitude 0 em relação ao nível do mar (pressão de 760 mmHg) e ponto de ebulição da água em 100º C. Já a cidade de São Paulo possui altitude de 750 m em relação ao nível do mar (pressão atmosférica de 700 mmHg) e ponto de ebulição da água em 97º C.
Já o Monte Everest, considerado o ponto mais alto da Terra, a altitude no local chega a 8.848 m acima do nível do mar (pressão 240 mmHg) e o ponto de ebulição da água é em aproximadamente 72º C.(educamaisbrasil)
O Monte Everest é local com altas altitudes e o PE da água é 71º C. (G1)
Essas variações no ponto de ebulição acontecem porque quanto maior a pressão atmosférica, mais dificuldade as moléculas da água têm para se movimentarem e mudar de estado físico. Já em locais de altas altitudes, a pressão atmosférica é menor e as moléculas têm mais mobilidade.(educamaisbrasil)
Com base nas informações anteriores é possível estabelecer as seguintes relações:
• Quanto maior a altitude em relação ao nível do mar, menor a pressão atmosférica;
• Quanto maior a pressão atmosférica, maior o ponto de ebulição;
• Quanto menor a altitude, maior a pressão atmosférica e maior o ponto de ebulição.
Mudanças de estado físico da água
CICLO DA ÁGUA
(1)
A água é extremamente importante porque entra na composição de todos os seres vivos: 70% do corpo dos animais e 80-90% do corpo das plantas.


















































.png)
.png)











0 comentários:
Postar um comentário