Clado Mammalia
Vênus de Willendorf (28.000 anos atrás)
Vênus de Willendorf (28.000 anos atrás_
Todos os mamíferos descendem de um único ancestral comum que apareceu no final do Triássico, cerca de 200 milhões de anos atrás. Os mamíferos descendem de répteis synapsida ancestrais, os tetrápodes amnióticos, isto é, animais de quatro patas cujos embriões três anexos embrionários: âmnio, córion e alantóide. Após a extinção dos dinossauros, cerca de 65 milhões de anos atrás, os mamíferos se diversificaram, a partir desse ancestral comum, em várias espécies, adaptando-se a todos os meios, terrestres, aquáticos e aéreos.
Ovo amniótico-alantoidiano ou ovo reptiliano
Com a extinção dos dinossauros, há cerca de 65 milhões de anos, o rumo da evolução foi modificado, abrindo caminho para a multiplicação da classe mais derivada de vertebrados, que investem muito no cuidado da prole e possuidores de glândulas mamárias.
Glândulas mamárias para alimentar a prole
Durante toda a era dos répteis, pequenos mamíferos conviveram com os dinossauros. Os espaços vazios (nichos) que eles podiam ocupar eram muito escassos, pois os habitats terrestres eram ocupados pelos grandes répteis. Somente após o desaparecimento dos dinossauros. Os mamíferos puderam, enfim, apossar-se dos locais nos habitats que ficaram vazios.
Assim, eles conseguiram evoluir e aumentar, progressivamente, tanto em tamanho quanto em número de espécies até chegar à grande diversidade que hoje conhecemos.
Mamíferos
Tendências evolutivas nos Synapsida
Grupos Principais Pelycossauros
São animais synapsida ancestrais que surgiram no início do Permiano (Hemisfério Norte, (Laurásia))
Eram de hábito carnívoros e herbívoros
Animais com velas no dorso Dimetrodon com tamanho de um cão são bernardo
THERAPSYDES
Eram repteis mamaliformes
Ancestrais dos mamíferos
Hemisfério Sul (Gondwana)
Animais de hábitos carnívoros e herbívoros
Surge a fossa temporal
Aumento de taxa metabólica Moschops sp, com o tamanho de uma vaca
CINODONS
Surgem no final do período Permiano
Houve uma redução do tamanho corporal desses animais
Evidências de ossos turbinados nasais que persistiram nos mamíferos até os dias de atuais. Iportante adaptação para evitar perder calor para o meio ambiente e aquecer o ar que entra nos pulmões.
Cotylorrhyncus sp. animal de porte menor que um são bernardo
Lycaenops sp. animal do porte de um cão labrador
Probelesodon sp. animal do porte de um cão terrier.
Alterações associadas a locomoção e ao metabolismo refletidas no crânio e esqueleto.
Dentição + articulação das maxilas
Dentes e musculatura das maxilas diferenciados aumento da eficiência de mastigação. O osso dentário se articula com o esquamosal.
Eram predadores ativos
O que requeria uma maior demanda da capacidade metabólica aeróbica
Modificações da estrutura das costelas
Transformação da ventilação dos pulmões
Membros
Os membros tornaram-se mais longos e ocorreu modificações da cintura pélvica
com aumento da capacidade de atividade locomotora
Surgimento da endotermia e atividade noturna o que gerou um aumento do encéfalo em função das novas atividades sensoriais.
Os mamíferos são ativos durante todo o dia, no crepúsculo e também à noite. Localização de presas e fuga de predadores utilizando olfato e audição.
Capacidade de manter a temperatura do corpo acima do do ambiente e na ausência de sol.
1) Aumento do osso dentário e redução do pós-dentário
2) Modificações do músculo masseter
3) Modificação progressiva da inserção do osso angular para dentário 2
O que levou a um maior volume de alimento ingerido por dia 1
Redução do osso pós-dentário com a formação da nova articulação mandibular e sua incorporação no ouvido médio.
Diferenciação dos dentes (Dentição heterodonte);
Redução no número de substituições (difiodontia) duas dentições apenas.
Oclusão precisa da boca o que levou a uma melhoria concomitante da mastigação e audição.
Digestão mais rápida (mastigação melhor e endotermia (ataque das enzimas aos alimentos liberando os nutrientes, que são absorvidos)
Therapsida
Dentes diferenciados em incisivos, caninos e pós-caninos
Cynodontia
Dentes pós-caninos mais complexos
Mamíferos
Dentes pós-caninos diferenciados em pré-molares (substituídos) e
molares (não substituídos)
Desenvolvimento de um palato secundário ósseo permitindo respirar e comer ao mesmo tempo
Desenvolvimento dos ossos turbinados nasais para controle da temperatura do ar que entra para os pulmões. (Peralta, 2018).
CARACTERÍSTICAS DOS MAMÍFEROS
Uma única fenestra temporal
Dentição difiodonta (difiodontia)
Palato secundário ósseo
Ossos turbinados na cavidade nasal
Articulação do dentário com o esquamosal
Tegumento com Pelos
Glândulas mamárias
Desenvolvimento uterino
Diafragma
Crânio synapsida
A característica osteológica distintiva que reúne todos os sinápsidos é a presença de uma abertura (ou fenestra), destinada à fixação da musculatura mandibular, localizada na região temporal do crânio. Esta configuração é diferente da dos répteis, que possuem duas aberturas de cada lado do crânio, apresentando, portanto uma configuração diápsida. Assim, nos mamíferos há apenas uma janela ou fenestra temporal (janela da região da têmpora do animal) Inserção dos músculos da mandíbula, permitindo maior volume nos músculos da mastigação.
Fossa temporal
PELICOSSAURO
Synapsida basal
Caninos alongados
diferenciação no formato nos dentes (heterodontes)
Dimetrodon
Synapsida basais e mamíferos
TERÁPSIDA
CINODONS
Cinodonte descoberto no Rio Grande do Sul
Relações filogenéticas entre os synapsida
A diferenciação dos primeiros mamíferos ocorreu próximo ao limite entre os períodos Triássico e Jurássico, cerca de 215 milhões de anos atrás. Seus ancestrais diretos foram pequenos cinodontes de hábitos insetívoros da família Brasilodontidae, reconhecida recentemente a partir da descoberta de numerosos exemplares muito bem conservados, coletados na formação Caturrita do estado do Rio Grande do Sul". (1) A Formação Caturrita é uma formação geológica localizada no estado do Rio Grande do Sul, Brasil. Sua datação é do período Triássico, mais especificamente carniano e noriano. Recebeu este nome devido a um bairro da cidade de Santa Maria. Esta localizado acima Formação Santa Maria, na Bacia do Paraná. Geralmente são encontrados lenhos e árvores fossilizadas nesta formação. É uma formação que só se encontra no Rio Grande do Sul.A Formação Caturrita é constituída por material sedimentar depositado em ambiente fluvial no Triássico Superior. Sua composição é diversa, apresentando seixos de siltito argiloso vermelho na base, seguido por arenito avermelhado de granulometria fina à média, composição quartzosa e matriz argilosa, podendo ainda conter considerável teor de feldspato, sobreposto por siltito e folhelho também avermelhados. Em geral, a granulometria do arenito é mais grosseira e menos argilosa na base da deposição. Dado a sua origem fluvial, a Formação Caturrita apresentam marcada estratificação cruzada acanalada e tabular. A origem fluvial também resulta em significativa variação espacial na granulometria do arenito, identificada pelo contraste entre áreas de maior cimentação e coesão, com outras de maior condutividade hidráulica (com outras de maior condutividade hidráulica (com outras de maior condutividade hidráulica (com outras de maior condutividade hidráulica (com outras de maior condutividade hidráulica (com outras de maior condutividade hidráulica (com outras de maior condutividade hidráulica (apresentando seixos de siltito argiloso vermelho na base, seguido por arenito avermelhado de granulometria fina à média, composição quartzosa e matriz argilosa, podendo ainda conter considerável teor de feldspato, sobreposto por siltito e folhelho também avermelhados. Em geral, a granulometria do arenito é mais grosseira e menos argilosa na base da deposição. Dado a sua origem fluvial, a Formação Caturrita apresentam marcada estratificação cruzada acanalada e tabular. A origem fluvial também resulta em significativa variação espacial na granulometria do arenito, identificada pelo contraste entre áreas de maior cimentação e coesão, com outras de maior condutividade hidráulica (apresentando seixos de siltito argiloso vermelho na base, seguido por arenito avermelhado de granulometria fina à média, composição quartzosa e matriz argilosa, podendo ainda conter considerável teor de feldspato, sobreposto por siltito e folhelho também avermelhados. Em geral, a granulometria do arenito é mais grosseira e menos argilosa na base da deposição. Dado a sua origem fluvial, a Formação Caturrita apresentam marcada estratificação cruzada acanalada e tabular. A origem fluvial também resulta em significativa variação espacial na granulometria do arenito, identificada pelo contraste entre áreas de maior cimentação e coesão, com outras de maior condutividade hidráulica (podendo ainda conter considerável teor de feldspato, sobreposto por siltito e folhelho também avermelhados. Em geral, a granulometria do arenito é mais grosseira e menos argilosa na base da deposição. Dado a sua origem fluvial, a Formação Caturrita apresentam marcada estratificação cruzada acanalada e tabular. A origem fluvial também resulta em significativa variação espacial na granulometria do arenito, identificada pelo contraste entre áreas de maior cimentação e coesão, com outras de maior condutividade hidráulica (podendo ainda conter considerável teor de feldspato, sobreposto por siltito e folhelho também avermelhados. Em geral, a granulometria do arenito é mais grosseira e menos argilosa na base da deposição. Dado a sua origem fluvial, a Formação Caturrita apresentam marcada estratificação cruzada acanalada e tabular. A origem fluvial também resulta em significativa variação espacial na granulometria do arenito, identificada pelo contraste entre áreas de maior cimentação e coesão, com outras de maior condutividade hidráulica (A origem fluvial também resulta em significativa variação espacial na granulometria do arenito, identificada pelo contraste entre áreas de maior cimentação e coesão, com outras de maior condutividade hidráulica (A origem fluvial também resulta em significativa variação espacial na granulometria do arenito, identificada pelo contraste entre áreas de maior cimentação e coesão, com outras de maior condutividade hidráulica (Soares, 2015).
Formação Caturrita (Triássico superior)
Formação Caturrita (Triássico superior)
Esta citação foi feita por José Fernando Bonaparte, renomado paleontólogo argentino, em seu livro intitulado A origem dos mamíferos (1) e evidencia a importância do papel dos cinodontes brasileiros como fósseis-chave na elucidação de questões relacionadas à aurora da história evolutiva dos mamíferos, um dos temas de maior interesse na paleontologia de vertebrados (2; 3; 4).
Cinodontes e mamíferos são membros da linhagem mamaliana, formalmente denominada de linhagem Synapsida, a qual evoluiu independentemente da outra linhagem de tetrápodes (vertebrados com quatro membros), a linhagem reptiliana, ou Sauropsida. Esta última inclui tartarugas, crocodilos, lagartos, dinossauros e aves, entre outros. Assim como os saurópsidos, os sinápsidos são tetrápodes amniotas que, diferente dos anfíbios, apresentam fecundação interna e não dependem da água para sua reprodução.
Synapsida é um grupo monofilético, ou seja, um grupo natural que reúne todos os descendentes de um ancestral comum, incluindo as formas extintas e as viventes. Apesar de bastante diversa no passado, sendo constituída por vários subgrupos, como pelicossauros, dinocefálios, anomodontes, terocefálios e cinodontes, os únicos representantes atuais da linhagem Synapsida são os mamíferos (Fig. 1). Exagerando um pouco, podemos dizer que os mamíferos são a ponta do iceberg da linhagem Synapsida. A história evolutiva dos sinápsidos inicia-se com os pelicossauros (Pelycosauria) (Fig.1A), que são os membros mais primitivo do grupo, e que, posteriormente, foram substituídos por formas mais avançadas, os terápsidos (Therapsida). Cinodontes e mamíferos (Fig. 1B a D) fazem parte deste último grupo. Em uma analogia bem simples, podemos ver esse agrupamento monofilético como uma série de matrioscas, aquelas bonecas russas de madeira, colocadas umas dentro das outras. Os mamíferos (Mammalia) seriam a menor boneca da sequência, que seria englobada pela boneca Cynodontia. Esta seria envolvida pela boneca Therapsida, que por sua vez estaria inserida dentro de uma boneca maior, denominada de Synapsida (Soares, 2015)
Geologia prática do RS
(por ACPaim)
TRÊS LINHAGENS DOS SYNAPSIDA
EXISTENTES ATUALMENTE
MONOTREMATA (Prototheria) (05 cinco espécies)
MARSUPIALIA (Metatheria) (400 espécies)
PLACENTARIA (Eutheria) (5.300 espécies)
Principais linhagens amniotas. Em vermelho, os Synapsida e os principais eventos que deram origem a sua diversidade e as características que definem seus principais grupos. (Warren et alli, 2008)
Sistema reprodutivo de fêmeas existentes
MONOTREMATA
Os monotremados (Monotremata) constituem uma ordem de mamíferos que põem ovos, diferindo significativamente com os modos reprodutivos dos outros mamíferos os marsupiais e os placentários. Eles retêm muitas características de seus ancestrais terapsídeos, porém apresentam várias características mamíferas importantes, como a presença de pelos, coração tetracameral, três ossículos auditivos e glândulas mamárias com produção de leite, embora sem mamilos. são animais encontrados na Austrália, Tasmânia e Nova Guiné, os monotremados provavelmente originaram-se durante o período Mesozoico, quando se separaram da vertente dos thérios. Compreendendo duas famílias, três gêneros e cinco espécies vivas atualmente, esta ordem constitui uma das mais distintas entre os mamíferos atuais.
MARSUPIALIA
Benjamin o último tigre da Tasmânia fotografado vivo

Brasilestes stardusti
PLACENTÁRIOS
Veado de cauda branca nexicano
Mazama nana
Veado bororó, ou veado anão endêmico da região sudeste e sul do Brasil.
Os Mazama nana são pouco estudados no seu habitat pela densidade das matas onde vivem e pelo comportamento altamente evasivo. É o cervídeo brasileiro menos conhecido pela ciência, e o que se sabe sobre esta espécie em geral se resume a dados como a distribuição geográfica, a taxonomia e informações genéticas. A espécie é ameaçada pela fragmentação dos habitats disponíveis da região Sul do Brasil, que isola e enfraquece as populações existentes.
SINAPOMORFIAS DOS MAMÍFEROS
Corte longitudinal de uma glândula mamária humana
1. Parede do peito
2. Músculo Pectoralis
3. Lóbulos
4. Mamilo
5. Areola
6. Duto do leite
8. Tecido adiposo
9. Pele
GLÂNDULAS MAMÁRIAS/LACTAÇÃO
As glândulas mamárias estão presente e potencialmente funcionais em machos de monotremados e eutérios.
São ausentes nos machos marsupiais.
Todos os mamíferos produzem leite, mas somente os Placenários ou Eutheria possuem mamilos.
As glândulas mamárias são relacionadas às glândulas sebáceas.
Todos os mamíferos possuem três características que não são encontradas em outros animais, são elas:
1) Glândulas mamárias para a lactação
A produção de leite ocorre através de glândulas mamárias. O leite é uma secreção rica em gordura, proteínas, água, sais, além de fatores imunológicos que protegem o filhote nos primeiros anos de vida.
Linha do leite. Compare com os mamíferos ancetrais.
2) Tegumentos coberto por Pêlos
Os pelos são formados de queratina, e especializados em funções diferenciadas: proteção contra a insolação, manutenção da temperatura corporal, defesa (ouriço), comunicação intraespecífica, camuflagem.
Pele em corte (Britânica)
3) Três ossos no ouvido médio (martelo, bigorna e estribo).
Três ossículos no ouvido médio (orelha média)
Orelha de um mamífero
4) Presença de dentes diferenciados
Os mamíferos apresentam dentes diferenciados (heterodontia) em incisivos, caninos, molares e pré-molares, além de apresentarem duas dentições são animais difiodontes (difiodontia).
Dentição
Dentição dos mamíferos (1)
5) Mandíbula inferior formada por um único osso o Dentário.
O registro fóssil mostra as diferenças entre mamíferos e répteis na articulação entre a mandíbula e o crânio: em a) vemos a mandíbula dos tetrápodes, incluindo os primeiros répteis mamaliformes (Synapsida), como a do pelicosauro mostrado na figura, era composta por vários ossos, como articular, o angular e o dentário; b) na forma transicional do Triássico, o cynodonte Probainognathus sp, a articulação entre o osso articular e o osso quadrado permanece, mas esses ossos se reduzem em tamanho e o osso dentário se expande, enquanto que o osso subangular e o osso esquamosal passam a participar dessa articulação.
Outra grande mudança é a ampliação da abertura temporal, com o desenvolvimento do arco zigomático, no qual se inserem os músculos mais fortes da mandíbula ; c) Nos mamíferos modernos (a letra c da figura representa o crânio de um lobo), o osso dentário é o único osso da mandíbula (os demais, reduzidos, mudam de função ou são totalmente perdidos), articulando-se com o osso esquamosal (o osso quadrado se reduz e também muda de função, transformando-se em um ossículo do ouvido médio). Os dentes reptilianos não são especializados (dentição homodonte), enquanto os dos mamíferos modernos se especializaram para exercer diferentes funções (dentição heterodontia) (Macdonald, 2001).
Dente tribosfênico
Esse tipo de dente funciona como uma espécie de triturador. Para isso, é necessário um encaixe preciso entre os molares superiores e inferiores: os dentes de cima têm uma projeção pontuda, chamada de cúspide, e os de baixo possuem uma depressão ou bacia. Com esse sistema, é como se o alimento fosse colocado num pilão, sendo esmagado e processado com muito mais eficiência, para que as enzimas atuem em porções menores de alimentos como sementes e até mesmo ossos. Acredita-se que os molares tribosfênicos tenham permitido que os mamíferos adquirissem grande versatilidade evolutiva na hora de escolher sua comida, coisa que outros vertebrados praticamente não tinham, os dinossauros, por exemplo, tinham uma dentição muito menos especializada, provavelmente tendo que engolir grandes pedaços do alimento (presa) ou mesmo a presa inteira; como os crocodilos fazem atualmente. No caso dos mamíferos, o sistema também permitiu adquirir o máximo de energia de cada porção do alimento, coisa essencial para manter seu sangue quente e seu metabolismo rápido funcionando, especialmente no que concerne a fuga de predadores. Esse tipo de dente tribosfênico foi encontrado no mamífero Kielantherium gobiense Dashzeveg, 1975, que viveu antes da separação dos mamíferos marsupiais (gambás, cangurus, e afins) e os placentários (os demais mamíferos, incluindo os humanos).
Analisando 26 ordens de mamíferos que existiram nos últimos 65 milhões de anos, Hunter e Jernvall (1995), descobriram que aquelas que apresentam o maior número de espécies têm um molar com uma ponta a mais. Os animais com o dente modificado tiveram maior chance de sobreviver ao clima frio e seco daquela época.
Relações filogenéticas dos principais taxa de mamíferos tribosfênicos Therian. O Australosphenida (Quadro A) e Boreosphenida (Quadro B) são monofiléticos e separados um do outro. a, Análise primária: o consenso estrito de 18 árvores igualmente parcimoniosas e mais curtas dos 55 caracteres dentais e mandibulares que são conhecidos para os mamíferos tribosfénicos do sul (ver Informações Suplementares). b, Análise estendida: o consenso restrito de oito árvores igualmente parcimoniosas e mais curtas de uma análise expandida, incluindo dados cranianos e pós-cranianos para a taxa melhor preservada (118 caracteres informativos; consulte Informações suplementares). A localização do clado australosphenidan na árvore dos mamíferos é consistente, seja com base apenas nas características dentárias e mandibulares conhecidas por táxons do sul (a), ou em dados combinados da dentição, mandíbula, mais o crânio 23,24 e o pós-crânio 25–27 (b). As apomorfias que suportam os nós principais do cladograma são apresentadas nas Informações Suplementares (consulte Métodos para obter detalhes). ()
A formação de cúspides em mamíferos é regulada por nós de esmalte secundários. (A) Um molar de um camundongo transgênico Shh-GFP heterozigoto, que expressa a proteína fluorescente verde (GFP) sob um promotor Shh. Imagens de campo claro e fluorescência mostram o nó de esmalte primário (ponta de seta amarela) em E13 + 1 e nós de esmalte secundários das cúspides principais (pontas de seta brancas) em E13 + 2 e E13 + 3. Mais tarde (em E13 + 4), GFP e, portanto, Shh, é expresso nos ameloblastos em diferenciação em toda a coroa. (B) As seções histológicas (superior) coradas para a expressão de Fgf4 e Shh e representações tridimensionais da interface epitelial-mesenquimal (inferior) de dentes de camundongo e gambá em desenvolvimento mostram a aparência de cúspides. As cúspides de camundongo são iniciadas muito próximas umas das outras e as cúspides se tornam quase iguais em altura. Por contraste,Fig. 2B ). (C) Molares de camundongos cultivados com Shh (à esquerda) exibem um atraso na formação de cúspides e uma redução nas cúspides (em comparação com molares de controle; centro), enquanto a cultura com o inibidor de Shh ciclopamina (à direita) aumenta a formação de cúspides, permitindo que se formem perto um para o outro. Os molares foram tratados por 4 dias e as imagens são de 8 dias. As seções dos dentes do gambá são modificadas, com permissão, de Moustakas et al. ( Moustakas et al., 2011 ); a seção dos dentes do mouse é modificada, com permissão, de Jernvall et al. ( Jernvall et al., 1994 ); e os tratamentos Shh em C são modificados, com permissão, de Harjunmaa et al. ( Harjunmaa et al., 2012 ).
Fig.1.:As principais etapas da formação do dente. Antes do início do desenvolvimento do dente, a região de formação do dente (a lâmina dentária) aparece dentro do epitélio dentário. O desenvolvimento de dentes individuais é então iniciado em domínios específicos da lâmina, chamados de placódios. Durante o estágio de botão, o epitélio dentário invagina no mesênquima dentário, que se condensa ao redor do epitélio para formar um botão. Então, durante o estágio de capa, o epitélio se estende ainda mais para o tecido mesenquimal e se enrola ao redor do mesênquima em condensação. O estágio de cúspide é seguido pelo estágio de sino, durante o qual padrões de cúspides específicos da espécie emergem: em um dente de cúspide única, um nó de esmalte primário, que aparece pela primeira vez no estágio de cúpula, dá origem à ponta da coroa; em dentes de mamíferos multicúspides, nós secundários do esmalte se formam nos locais das futuras cúspides. Esse estágio é seguido pelo crescimento final e secreção da matriz, durante os quais o epitélio interno do esmalte se diferencia em ameloblastos, que produzem o esmalte, e as células mesenquimais adjacentes se diferenciam em odontoblastos que secretam dentina. As raízes continuam a se desenvolver durante a erupção. (Jernvall e Thesleff, 2012 )
Fig. 2. Diversidade evolutiva dentro dos dentes das espécies vivas.
(A) Os dentes são encontrados entre os vertebrados, mas os dentes dos mamíferos tendem a ter mais cúspides e são geralmente mais complexos, enquanto os peixes e répteis tendem a ter um número maior de dentes simples. (B) Entre os mamíferos, os molares são geralmente mais simples em espécies comedoras de animais (por exemplo, leões), enquanto as espécies comedoras de plantas (por exemplo, pandas) têm topografia de copa complexa. (C) Os mamíferos têm capacidade de renovação dentária limitada e apenas alguns grupos de mamíferos (por exemplo, wallabies) têm espécies que podem desenvolver novos molares posteriormente. Uma solução mais comum são os dentes altos (hipodontia), em que apenas parte da coroa é visível fora da mandíbula (observe que as partes dentro da mandíbula se tornam visíveis na imagem dos molares de vacas). Algumas espécies de mamíferos (por exemplo, a ratazana) têm molares sempre crescentes (hypselodonte). Em contraste, peixes e répteis substituem continuamente os dentes (por exemplo, ver dente sendo substituído em iguana, em A). Anterior está para a esquerda. As imagens não estão na mesma escala. (Jernvall e Thesleff, 2012 )
6) Pulmões revestidos de pleura
Os pulmões são recobertos pelo folheto visceral da pleura. Esta é formada por uma delgada camada de tecido conjuntivo acolada ao parênquima pulmonar e é revestida externamente por um mesotélio, um epitélio simples, pavimentoso que reveste os derivados das cavidades celomáticas.
Assim como diversos órgãos do corpo humano, os pulmões estão revestidos e protegidos por membranas. As membranas de tecido conjuntivo que revestem os pulmões são chamadas Pleuras. As pleuras estão dispostas em dois folhetos: a pleura parietal e a pleura visceral. A pleura parietal fica em contato direto com a caixa torácica e a pleura visceral fica em contato direto com os pulmões. Entre as duas pleuras existe um espaço “virtual” denominado cavidade pleural ou espaço intrapleural. Na cavidade pleural circula o líquido pleural, que é importantíssimo pra evitar o atrito entre os pulmões e a caixa torácica, permitindo que os pulmões deslizem suavemente sobre a caixa torácica durante a ventilação pulmonar. Além disso, o líquido pleural estabiliza os dois folhetos pleurais, deixando-os colados através de uma pressão negativa, e isso evita o colapso dos pulmões mantendo-os sempre abertos e permitindo a entrada e saída do ar. Esta pressão negativa é denominada pressão intrapleural. (Fonte: Funções e doenças das pleuras)
Pulmão revestido pela pleura (2)
Pleura parietal e pleura visceral (3)
Delgada túnica serosa, brilhante e escorregadia que reveste o interior da Cavidade Torácica e praticamente toda a superfície pulmonar (incluindo as fissuras).
Quando sobre os pulmões constitui os sacos pleurais.
1) Pleura Visceral ou Pulmonar Recobre os Pulmões Reflete-se no hilo
2) Pleura Parietal - Reveste o restante da cavidade torácica - Nomeada de acordo com a região na qual se encontra.
Produção e reabsorção do Líquido Pleural
O líquido pleural é um ultrafiltrado do plasma sanguíneo, que entra na cavidade pleural através dos capilares sanguíneos da pleura parietal e é reabsorvido pelos capilares linfáticos também da pleura parietal. Portanto, tanto a produção quanto a reabsorção do líquido pleural são feitas através da pleura parietal. O volume aproximado do líquido pleural é de cerca de 1 a 20ml nas cavidades pleurais e estes valores variam de acordo com o peso do indivíduo. Estima-se que estes valores sejam de cerca de 0,1 a 0,2ml/kg para que se tenha um cálculo aproximado da quantidade exata de líquido pleural de acordo com o peso da pessoa. A composição do líquido pleural é basicamente de proteínas plasmáticas e células brancas. As proteínas encontradas no líquido pleural são a albumina, o fibrinogênio e as globulinas e os tipos celulares presentes ali são os linfócitos, os monócitos e as células mesoteliais. (3)
7) Epiglote controlando e separando a passagem
de alimento e de ar
Laringe – Traquéia – Pulmão - Brônquios - Bronquíolos - Bronquíolos terminais - Bronquíolos respiratórios - Ducto alveolar - Saco alveolar - Alvéolos (hematose).
8) Encéfalo altamente desenvolvido
O encéfalo é o centro do sistema nervoso em todos os animais vertebrados, e em muitos invertebrados. Alguns animais primitivos como os celenterados e equinodermos como a estrela-do-mar possuem um sistema nervoso descentralizado sem encéfalo, enquanto as esponjas não possuem sistema nervoso. Nos vertebrados o encéfalo localiza-se na cabeça protegido pelo crânio, próximo aos aparatos sensoriais primários: visão, audição, equilíbrio, paladar, e olfato. Os encéfalos podem ser extremamente complexos. O encéfalo humano - composto dentre outras estruturas pelo cérebro, cerebelo, e tronco encefálico (Mesencéfalo, Ponte e Bulbo) - contém cerca de 86 bilhões de neurônios, ligados por mais de 10 mil conexões sinápticas cada. Esses neurônios comunicam-se por meio de prolongamentos citoplasmáticos denominado axônio, que conduzem pulsos em sinais chamados potencial de ação para partes distantes do encéfalo e do corpo e as encaminham para serem recebidas por células específicas.
De um ponto de vista filosófico, pode-se dizer que a função mais importante do encéfalo é servir como estrutura física subjacente à mente. Do o ponto de vista biológico, entretanto, a função mais importante do encéfalo é receber informações sensoriais de origem tanto internas quanto externas, e em resposta gerar reações, comportamentos e estímulos que promovam de forma mais primitiva e autônoma a sobrevivência imediata da espécie, e ,em escala mais abrangente, o bem-estar pleno e duradouro do animal. O encéfalo controla o comportamento seja ativando músculos, seja causando a secreção glandular de substâncias químicas, como os hormônios. (Cater et alii 2012. 4, 5, 6).
9) Endotermia e homeotermia
A temperatura é constante independente do ambiente.
10) Sistema circulatório e Hematose
Circulação fechada, dupla e completa, com o coração apresentando quatro cavidades (2 Átrios e 2 Ventrículos).
Ocorre completa separação do sangue venoso e arterial como nas aves.
Os eritrócitos são anucleados.
11) Sexos separados e dimorfismo sexual.
12) Sexo do embrião determinado
pela presença dos cromossomos X ou Y
O sistema de determinação sexual em aves é inverso ao dos mamíferos.
Nas aves, as fêmeas são o sexo heterogamético (ZW), e determinam o sexo da prole, e machos constituem o sexo homogaméticos (ZZ).
Em mamíferos, os machos são heterogaméticos (XY) e as fêmeas homogaméticas (XX).
Cromossomos sexuais de mamíferos e de aves. (A) Representação esquemática dos sistemas de cromossomos sexuais de mamíferos e aves. Machos de mamíferos são heterogamético (XY) e as fêmeas são homogaméticas (XX). Em aves, os machos são homogamético (ZZ) e as fêmeas são heterogaméticas (ZW). O gene mestre determinantes dos testículo m mamíferos é o SRY, em aves é DMRT1. Ambos são representadas por faixas brancas nos cromossomos Y e Z. A dosagem por compensação ocorre apenas em mamíferos, onde um cromossomo X das fêmeas é aleatoriamente inativado (representada pelo cromossomo desbotado da imagem). Cromossomos autossômos são representados pela cor cinza ‘A’. (B) Características dos cromossomos Z e W de aves modernas. A eucromática (porção azul no Z e vermelho no W) e heterocromática (amarelo) em ambas as regiões são mostradas. Nomeadamente, o gene DMRT1 está localizado exclusivamente o cromossomo Z, em ambas as aves; ratitas e não-ratitas.( Batons, 2020 )
Em humanos (mamífero placentários e também em marsupiais) o gene SRY é responsável pela iniciação da determinação do sexo masculino (Berta et al, 1990) Ele esta presente no cromossomo Y de mamíferos therios, e mutações neste gene levam a uma gama de distúrbios relacionados com o sexo, com efeitos variados sobre o fenótipo e genótipo de um indivíduo.
Não há SRY em aves, e a dosagem do gene DMRT1 no cromossomo Z é o candidato mais provável a determinação do sexo. Como vimos, diferentes opções de determinação sexual evoluíram de forma independente em diferentes linhagens, embora cromossomos sexuais complexos, como o do ornitorrinco, nos ofereça pistas interessantes sobre a origem e evolução do sistema XY de mamíferos. Esse sistema pode ter evoluído diretamente do antigo sistema ZW dos répteis. E sabemos répteis mamaliformes são os ancestrais dos mamíferos.
Embora a principal função dos cromossomos sexuais seja, obviamente, determinar o sexo, outras funções específicas são susceptíveis de terem sido adquiridas após essa função primária evoluir e suprimir certas recombinações. Sabemos que o gene SRY (presente no cromossomo Y) é responsável pela determinação dos testículos.
Existem dois passos envolvidos na determinação do sexo dos mamíferos.
Um passo genético dado pelos cromossomos e a formação das gônadas, e o passo controlado pelo hormônio das gônadas que determinam o fenótipo sexual.
A via genética que resulta na diferenciação do testículo é controlada pela presença de um interruptor principal, um fator determinante testicular chamado de (TDF Testicle determinant factor). Na ausência dessa opção, uma gônada ainda não diferenciada forma um ovário.
Um testículo embrionário engatilha o segundo passo; a produção de hormônios sexuais. A produção do hormônio anti-Mullerian (AMH) em machos sinaliza o início da fase hormonal de diferenciação sexual, então a síntese de testosterona e seus derivados é responsável pela formação de quase todos os traços do sexo masculino. Uma exceção ocorre da formação independente do escroto e do desenvolvimento mamário nos marsupiais., que esta ligada a dosagem de um gene no cromossomo X, em vez do uso de andrógenos (Waters et al, 2005).
Embriologicamente e anatomicamente nos dois primeiros meses (8º a 9º semana) de gestação, os dois sexos se desenvolvem de maneira exatamente idêntica, ou seja, não é possível notar diferenças no fenótipo. No final desse período as gônadas se diferenciam em ovários e testículos, lembrando que os testículos ainda estão dentro da cavidade abdominal, só migrando para a bolsa escrotal no final da gestação. O desenvolvimento da genitália externa e dos caracteres sexuais secundários se completa por volta da 12º semana de gestação.
Formação e desenvolvimento da genitália externa
(Fonte: Desenvolvimento sexual)
O desenvolvimento do sexo do embrião depende de várias etapas. Quem vai comandar essas etapas é o sexo cromossômico, no embrião masculino o cromossomo XY e no feminino o cromossomo XX. Nos dois primeiros meses (8º- 9º semana) de gestação, os dois sexos se desenvolvem de maneira exatamente idêntica, ou seja, não é possível notar diferenças no fenótipo. No final desse período as gônadas se diferenciam em ovários e testículos, lembrando que os testículos ainda estão dentro da cavidade abdominal, só migrando para a bolsa escrotal no final da gestação. O desenvolvimento da genitália externa e dos caracteres sexuais secundários se completa por volta da 12º semana de gestação.
Em mamíferos monotremados (como os ornitorrincos e équidna) há um sistema de cromossomos sexuais complicado que forneceu novas informações sobre a origem do sistema XX/XY.
No ornitorrinco, as fêmeas têm cinco pares de cromossomos X (X1/X1, X2/X2, X3/X3, X4/X4, X5/X5) e os machos têm cinco Xs e cinco Ys (X1/Y1, X2/Y2, X3/Y3, X4/Y4, X5/Y5) que formam uma cadeia na meiose (Rens et al, 2004). O cromossomo X1, que se situa em uma das extremidades da cadeia de translocação tem vários genes em comum com os cromossomos humanos X (Watson et al, 1990), mas perdeu uma região em um área chamada de PAR, sigla em inglês de “Pseudoautosomal Region”.
Essas regiões pseudoautossômicas (PAR) são formadas por sequências homólogas de nucleotídeos nos cromossomas X e Y.
Ela inclui genes RBMX que acompanham o gene XIST em placentários. Isto sugere que estes genes adquiriram funções especializadas apenas na linhagem dos mamíferos therios após a divergência monotremados-therios que ocorreu a 210 milhões de anos (Waters et al, 2005).
O cromossomo de maior interesse em ornitorrincos é o X5, que se situa na extremidade da cadeia de translocação. Este cromossomo provou ter uma versão ortóloga do gene DMRT1 das aves; aquele responsável pela determinação do sexo das aves.
O cromossomo X representam cerca de 15% do genoma do ornitorrinco e, embora o ortólogo de DMRT1 (dentre outros) esteja presente em X5, é provável que exista no cromossomo Z da galinha um constituinte principal de uma cadeia ancestral meiótica. Isto sugere um claro elo evolucionário entre o sistema pássaro ZW e o sistema mamífero XY de mamíferos therios (Grutzner et al, 2004). Tem sido sugerido que a cadeia começou com uma translocação entre um autossômo e um par ZW em algum réptil ancestral com os mamíferos, e que este cromossomo autossômico assumiu o controle da determinação do sexo em placentários (Ezaz et al, 2006). O grande obstáculo na interpretação da origem da cadeia meiótica em monotremados está em sauropsídeos ancestrais (ave/réptil) e amniotas (sauropsídeos/mamífero). Como descrito anteriormente, as serpentes apresentam um sistema ZW que é conservado neste grupo, mas que não é equivalente ao ZW em pássaros (Matsubara et al, 2006).
Considera-se então os dados já constatados, o gene DMRT1 encontra-se no cromossomo Z e galinhas, mas não o W (Nanda et al, 1999), e é expresso durante gonadogenese (Shetty et al, 2002). Ele está, portanto, presente em uma dose dupla no sexo masculino (ZZ) e uma dose única em aves do sexo feminino (ZW), tornando-se um forte candidato para uma dosagem dependente do lócus de determinação de sexo em aves. Sabendo disto, nota-se que o DMRT1 esta localizado no cromossomo Z do emu, mas está ausente de em W, esta espécie distantemente relacionada tem apenas uma pequena região de diferenciação entre os cromossomos W e Z e são praticamente homomórficas (Shetty etal, 1999).
DMRT1 é o gene identificado mais bem conservado na via que determina o sexo em vertebrados. Deleções heterozigóticas da região do cromossomo 9 humano que contém DMRT1 resultam em reversão masculino para feminina. Humanos e ratos que carregam deleções homozigóticas de DMRT1 são inférteis devido a defeitos graves na proliferação de células germinativas (Raymond et al, 2000). A diferença em termos de gravidade entre deleções heterozigotas de DMRT1 humano e dos ratos pode ser explicada pela possibilidade de que os ratos podem representar um estado mais evoluído de uma via dependente de dosagem ancestral e de uma via genética estável. Assim DMRT1 tem sido associado com a determinação do sexo por pelo menos 300 milhões de anos em mamíferos, bem como répteis, e as evidências encontradas no ornitorrinco sugerem que este era o sistema de cromossomos sexuais ancestral de todas as tetrápodes.
Em mamíferos marsupiais os cromossomos sexuais são geralmente menores do que cromossomos sexuais de placentários: o cromossomo X representa cerca de 3% do genoma haplóide e o cromossomo Y é ainda menor. No entanto, as ações do cromossomo X marsupial contém muitos genes no braço longo e na região pericêntrica semelhantes ao do X humano (Watson et al, 1990), demonstrando que cromossomos sexuais de mamíferos therios são monofiléticos.
Os genes no braço curto do cromossomos X humano, na porção Xp11.23 estão também localizados em cromossomos autossômos em marsupiais e de monotremados, além de tantas outras sequencias homólogas em todo o genoma.
A perda de quase todos os 1.100 genes originais no cromossomo Y humano ao longo de 310 milhões de anos desde de quando humanos e aves compartilharam um ancestral comum significa que os genes foram perdidos a partir do Y a uma taxa de 4 por milhão de anos. A este ritmo, os últimos 45 genes serão perdidos e o Y irá desaparecer em cerca de 12 milhões anos, embora a seleção positiva de genes seja um importante nas funções especificas no sexo masculino e podem evitar o eventual desaparecimento do Y . (Rossetti, visitado em 2020)
Os genes no braço curto do cromossomos X humano, na porção Xp11.23 estão localizados em cromossomos autossomos em marsupiais (Spencer et al, 1991) e de monotremados (Watson, 1991). (Rosseti, consultado em outubro de 2020).
Isto definiu uma região conservada do antigo X (XCR) e uma região adicionada ao X dos mamíferos eutherios (XAR) (Graves, 1995). O mapeamento de genes humanos na comparação com o de galinhas confirma que estas duas regiões estavam separadas em um ancestral comum de aves e mamíferos a pelo menos 310 milhões de anos e marsupiais que mantiveram o arranjo ancestral de genes (Kohn et al, 2004).
O cromossomo Y de marsupial é um candidato ideal para caracterização completa porque é pequeno e tem pouca heterocromatina (Toder et al, 2000). No entanto, o seqüenciamento dos genomas do sexo feminino do gambá (Monodelphis domestica) e de um canguru (Macropus eugenii), não forneceram informações sobre o Y. O conhecimento sobre a origem da determinação sexual e da dinâmica evolutiva dos cromossomos de marsupiais depende do mapeamento do cromossomo Y, de testes genéticos comparativos e da análise de bibliotecas genéticas (Sankovic et al, 2006).
A maioria das unidades de codificação de uma região chamada de MSY, ou “região especificamente masculina do Y” (sigla em inglês de male-specific Y) evoluiu de cromossomos homólogos de X, e não surpreendeu quando descobriu-se que o Y também é composto por regiões conservada (YCR) e regiões adicionadas (YAR) (Waters etal, 2001). Das 20 unidades proteicas de codificação distintas em MSY humano e que possuem um parceiro com X, apenas cinco estão presentes na marsupiais Y (YCR), sendo que 13 delas são autossômicas (YAR). No entanto, o cromossomo Y de marsupiais contém vários novos genes não ortólogos aos dos cromossomos Y de qualquer mamífero placentário. Eles têm versões parálogas do cromossomo X humano (Sankovic, 2005) e confirma a ideia de que diferentes linhagens de mamíferos começaram com o mesmo proto-Y, que era equivalente aos eixos X, as que perderam diferentes subconjuntos de genes (Graves, 2006). (veja na figura 2).
Os cinco genes conservados entre os placentários e marsupiais, que incluem SRY (determinação do sexo) e RBMY (fator de espermatogênese), provavelmente foram retidos porque eles têm funções masculinos selecionáveis. Os quatro genes marsupiais de Y parecem ter se perdido no cromossomo Y de placentários e podem ter evoluído uma função específica do sexo masculino na linhagem marsupial, ou pode ter sido perdido dos placentários quando sua função foi substituída algum outro gene.
A perda de quase todos os 1.100 genes originais no cromossomo Y humano ao longo de 310 milhões de anos (desde de quando humanos e aves compartilharam um ancestral comum) significa que os genes foram perdidos a partir do Y a uma taxa de 4 genes por milhão de anos. A este ritmo, os últimos 45 genes serão perdidos e o Y irá desaparecer em cerca de 12 milhões anos, embora a seleção positiva de genes seja um importante nas funções especificas no sexo masculino e podem evitar o eventual desaparecimento do Y (Graves, 2006).
Mesmo sob a posse de genes sexuais e da espermatogênese, isso não salvou o cromossomo Y em dois grupos de roedores; as ratazanas-toupeira-do-leste-europeu e do rato-do-Japão (Soullier et al, 1998), que carecem de um cromossomo Y e não têm nenhum gene SRY.
Tal como acontece com mamíferos placentários, a perda da função do gene Y impõe uma necessidade de alguma forma de compensação de dosagem. Marsupiais também passam pela inativação do cromossomo Y, embora seja diferente em vários aspectos fenotípicos e moleculares (Cooper etal, 1993), e evidentemente, não é controlado por um gene XIST (Duret etal, 2006).
Todos os mamíferos placentários têm um sistema XX/XY (sexo feminino e masculino). O mapeamento de genes e cromossomos mostram que o cromossomo X é quase idêntico, mesmo entre as espécies mais distantemente relacionadas. No entanto, o cromossomo Y difere genética e morfológicamente entre as espécies.
Os mamíferos placentários (mamíferos da infraclasse eutheria) divergiram de marsupiais (Metatheria) há cerca de 180 milhões de anos atrás, e a subclasse theria (contendo placentários e marsupiais) divergiu dos monotremados (subclasse Prototheria; com o ornitorrinco e equidna) cerca de 210 milhões de anos (Fig. 1). Mamíferos placentários estão agora divididos em quatro clados; Euarchontoglires (ou Supraprimates), Laurasiatheria, Xenarthra e Afrotheria (Murphy et al, 2001). Supraprimatas divergiram de Afrotheria cerca de 105 milhões de anos, Xenarthra a cerca de 100 milhões de anos e Laurasiatheria a cerca de 90 milhões de anos (Woodburne et al, 2003).
Há uma enorme quantidade de dados disponíveis sobre o X e Y humano, bem como para o X e Y de nossa espécie modelo (o rato), que pertence ao mesmo clado, Supraprimates. Pouco se sabe sobre Laurasiatheria, que inclui espécies economicamente importantes como a vaca, porco, cavalo e carnívoros, como gatos e cães. Quase nada se sabe sobre o conteúdo genético, organização e inativação dos cromossomos sexuais em outros grupos de mamíferos, especialmente os xenartros basais da América do Sul e afrotherios.
O cromossomo X é altamente conservado em tamanho (cerca de 5% do genoma haplóide) e conteúdo genético dentre todos os placentários, como observado pela primeira vez por Ohno (1967), e referido como Lei de Ohno.
O mapeamento de genes em Laurasiatheria revelou que a ordem dos genes no cromossomo X é quase idêntica em várias espécies (Ihara et al, 2004). Embora a ordem dos genes nos cromossomos X seja desconhecida em afrotherios e xenartros, a homologia completa ao cromossomo X humano foi estabelecida (Yang et al, 2003). No entanto, o cromossomo X de rato parece ter sido reorganizado em comparação com o X de outros mamíferos, embora seja geneticamente quase idêntico (Waterston etal, 2002).
A inativação de um único cromossomo X em mulheres parece ser uma característica onipresente dos mamíferos placentários. Seres humanos, ratos e até mesmo afrotherios e xenartros compartilham várias características clássicas da inativação do X como a formação da cromatina sexual e replicação assíncrona (Waters et al, 2004). No entanto, os detalhes do mecanismo molecular é significativamente diferente entre humanos e ratos, os únicos dois mamíferos em que estudos intensivos foram realizados.
O cromossomo Y é muito mais variável do que o X, diferindo entre as espécies de tamanho e gene conteúdo, e nas relações de homologia com X. Uma única região pseudoautossômica (PAR) é compartilhado entre X e Y de rato, vaca e cavalo e parece ser crítica para a fertilidade.
Há evidências recentes de que os cromossomos sexuais de mamíferos afrotherios também tem um PAR, representada por uma pequena região de proteína sinaptonêmica 1 (SCP1) entre o X e Y durante a meiose no macho do musaranho-elefante. Os cromossomos Y de diferentes espécies mostram uma considerável variação no conteúdo de heterocromatina, desde o pequeno cromossomo Y de ovelhas, até a heterocromática de cromossomos Y de elefantes (Houck et al, 2001). Seqüências repetitivas são muito mal conservadas, em análises genéticas, um cromossomo Y geralmente não hibridiza com um outro Y da mesma espécies ou espécies muito estreitamente relacionados (como ovelhas e vacas).
O conteúdo genético dos cromossomos Y de mamíferos foi definido apenas recentemente. Em 1959, observações feitas em fêmeas XO e machos XXY de humanos e ratos (Jacobs et al, 1959) foi constatado que certos fatores determinantes para machos estava no cromossomo Y. Mais recentemente várias funções têm sido atribuídas a eles, incluindo os fatores envolvidos na produção de esperma e a estatura do indivíduo.
Homologia de genes de cromossomos Y existentes de mamíferos em comparação com Y ancestral dos mamíferos. Roxo indica regiões pseudoautossômica, azul são as regiões não recombinadas eucromáticas do Y e cinza são heterochomatinas.
Diferente do homem, do chimpanzé e do rato, o conteúdo dos genes do cromossomo Y é pouco conhecido, mesmo para espécies como o cachorro e a vaca cujos genomas já foram seqüenciados em profundidade. Existe uma considerável variação entre os conteúdo dos genes de Y nas espécies, embora elas se sobrepõem e contêm além de SRY vários genes conhecidos por serem necessários para a espermatogênese. Quanto a condição humana, a maioria dos genes do cromossomo Y em outras espécies têm versões parálogas com o X, e a comparação de genes no Y no ser humano, rato, vaca, cavalo com genes no cromossomo X sugerem que diferentes subconjuntos de genes de um cromossomo autossômico antigo foram retidos em algumas espécies e perdidos em outras. Padrões de expressão de genes ortólogos de espécies diferentes não são necessariamente os mesmos; por exemplo, o gene ZFY humano é um gene de manutenção, enquanto que em rato esta ligado a espermatogênese nos testículo. Isto sugere que a função do gene Y, bem como conteúdo gene pode ter mudado durante a evolução em algumas linhagens. (Rosseti, consultado em outubro de 2020).
Nos mamíferos os machos são heterogaméticos (n+XY) e as fêmeas são homogaméticas (n+XX). Assim, a determinação do sexo, em mamíferos, se estabelece pelo arranjo formado entre o cromossomo X originário da fêmea e o cromossomo X ou Y originário do gameta masculino. Classicamente, a cronologia da diferenciação sexual cursa com o estabelecimento do sexo cromossômico, seguido do desenvolvimento gonadal que desencadeará o desenvolvimento do sexo fenotípico. O controle genético e hormonal estabelecido, então, pela expressão de gens localizados nos cromossomos sexuais e em outros loci dos cromossomos somáticos. Apesar de não estar, ainda, completamente estabelecido o mecanismo genético de controle sexual, sabe-se que alguns genes são fundamentais para o processo de diferenciação gonadal e fenotípica. O gene SRY (Sex-Determining Region of Y Chromossome) também denominado TDF (Testis Determining Factor) é implicado na formação do testículo. As células precursoras das células de Sertoli são o primeiro tipo celular a expressar o SRY, elas são quem formará os cordões seminíferos e iniciarão a diferenciação gonadal do macho. Além do SRY outros genes são implicados no processo de diferenciação gonadal. O gene WT1 apresenta 50 kb e compreende 10 exons. Os tipos celulares que o expressam são as células de Sertoli e a célula da Granulosa. Ele está implicado na morfogênese do trato genital após a determinação sexual. Como WT-1 e SRY são expressos nas células de Sertoli, isto sugere que WT-1 possui regulação por SRY ou existe interação entre esses dois genes. O SF-1 (Steroidogenic Factor 1) ou FtzF1 (Fushi Tarazu Factor) é um receptor nuclear que regula a transcrição de um grande número de genes implicados na estereidogênese e desenvolvimento das gônadas. SF-1 regula in vitro e in vivo a transcrição de gene do hormônio anti-Mülleriano (AMH) e interage com SOX-9, WT1 e DAX-1.
O SOX-9 é um gene da família SOX (SRY-Related HGM-box). A proteína de SOX-9 é necessária para a transcrição de AMH e portanto participa da manutenção dos níveis elevados de AMH no testículo fetal de todos os mamíferos. A diminuição das taxas de proteína SOX-9 redunda em feminilização das gônadas de indivíduos 46,XY podendo produzir indivíduos hermafroditas. (Rodrigues, 2004).
O gene DAX-1 situa-se no locus DSS (Dosage Sensitive Sex Reversal) que está localizado no cromossomo X. Este gene inibe a diferenciação testicular e como conseqüência a gônada acaba se tornando ovário. A relação entre esses e outros genes que atum na regulação e determinação sexual é complexa e não bem elucidada, mas sabe-se que o resultado da expressão e/ou inibição desses genes será a diferenciação gonadal e fenotípica do embrião e feto.
Diferenciação sexual
Diferenciação sexual em mamíferos
(Continua)
13) Fertilização interna
14) Presença de glândulas
mamárias, sebáceas, sudoríparas e odoríferas.
15) Presença de diafragma separando
a cavidade torácica da cavidade abdominal.
16) Esqueleto Ósseo com inúmeras especializações
Esqueleto de um gato
17) Sistema digestório
Aspectos particulares de mamíferos.
Existem lábios móveis em todos os grupos, exceto em monotremados e cetáceos. Geralmente existem dentes e estes são especializados em certas espécies. As glândulas orais, primariamente relacionadas à secreção de muco, estão presentes em todos os mamíferos, contudo, são mais desenvolvidas nas espécies terrestres, já que mantém a boca umedecida e auxiliam na deglutição do alimento. Muitos mamíferos arfam, isto é, respiram rapidamente com a boca aberta, para ajudar a regular a temperatura do corpo. Isso ocorre com o resultado da evaporação salivar e da evaporação nos pulmões. A maioria dos mamíferos tem a língua muito desenvolvida (com exceção das baleias) e capaz de muitos movimentos. Em sua superfície superior há numerosas papilas, algumas relacionadas à gustação (papilas sensoriais). O estômago tem formas e padrões variados, relacionados com os hábitos alimentares, podendo ser simples estruturas em forma de saco, até estruturas compostas por uma série de câmaras, como nos ruminantes. O intestino delgado é longo e convoluto na maioria, mas nas espécies herbívoras é ainda maior. A cloaca aparece somente nos monotremados. (Chordata )
18) Sistema respiratório
Em alguns mamíferos de água doce ocorrem adaptações de partes do sistema respiratório. Estas, freqüentemente, envolvem o desenvolvimento de abas e válvulas para fechar as narinas externas. Os mamíferos aquáticos apresentam adaptações para mergulhar a grandes profundidades, sem sofrer privação de oxigênio. Estas podem ser:
• redução da pulsação e da freqüência cardíaca; Ex.: elefante-marinho: pulso cai de 85 para 12 batimentos/min.
• tem maior tolerância ao CO2;
• tem grande quantidade de mioglobina no tecido muscular para “armazenar” oxigênio.
Os mamíferos que mergulham mais profundamente são os cetáceos, que podem resistir a uma enorme pressão e segurar a respiração por, pelo menos, uma hora. A pressão exercida a grandes profundidades é suportada através de um colapso alveolar (a partir de 60m de profundidade, aproximadamente) que impede as trocas gasosas. Além disso, o sangue é desviado da musculatura e pele para suprir as necessidades do encéfalo e coração e, no mergulho, a freqüência cardíaca é reduzida para cerca de 10 batimentos/minuto.
19) Sistema urogenital
As fêmeas têm geralmente dois ovários funcionais ligados a dois ovidutos (Trompas de Falópio). Os Monotremados põem ovos e os ovidutos abrem-se na cloaca, separadamente, embora apenas o esquerdo pareça ser funcional.
Nos Marsupiais e Placentários, o oviduto expande-se num útero, onde ocorre o desenvolvimento embrionário dos filhotes.
Marsupiais, a agestação é curta e o desenvolvimento termina no marsúpio. Após o nascimento, os embriões se arrastam para o marsúpio, onde agarram fortemente a um mamilo da mãe, sendo então alimentado pela secreção da glândula mamária.
Nos placentários, a placenta possibilita o desenvolvimento embrionário intra-uterino, já que o suprimento energético se dá via placenta. Nos machos, os testículos são bem posteriores ou podem estar no escroto (bolsa fora da cavidade do corpo). Há 1 único pênis. Adultos apresentam um rim metanéfrico, bexiga urinária e uréia como excreta nitrogenada.
Tratos reprodutivos característicos de fêmeas do ancestral e dos principais mamíferos viventes: (a) ancestral hipotético dos mamíferos, semelhante a um lagarto; (b) monotremado ovíparo; (c) marsupial mostrando estruturas vaginais complicadas; (d) mamífero placentário exemplificado por um primata avançado.
A maioria dos mamíferos tem estações de reprodução bem definidas, freqüentemente no inverno ou na primavera. As fêmeas passam por um ciclo estral periódico, marcado por modificações celulares no útero e na vagina e por diferenças no comportamento. Uma curiosidade que vale a pena comentar aqui, diz respeito aos tatus. As informações sobre o comportamento e a ecologia desses animais restritos ao Novo Mundo são raras e vêm principalmente de estudos feitos na natureza com a única espécie que ocorre na América do Norte, Dasypus novencinctus. De modo geral, esses animais têm hábitos solitários; raramente formam pares ou andam em bando. Sobre seu comportamento sexual, quase nada se sabe. Dasypus é o único gênero de mamífero que apresenta o que é cientificamente conhecido por poliembrionia homozigótica, isto é, dá sempre origem a quatro gêmeos idênticos. As fêmeas provavelmente não ovulam até completar dois anos de idade. Os adultos da espécie são solitários e são comumente vistos forrageando sozinhos. Entretanto, podem apresentar alguma sobreposição de área de uso. distribuição, está na lista das espécies brasileiras ameaçadas de extinção. Embora não haja estudos sobre sua biologia e ecologia, acredita-se que sejam solitários, com um padrão de atividade crepuscular/noturno. Após um período de gestação que ainda não se conhece com precisão, as fêmeas em geral dão à luz um único filhote. (Chordata )
20) Sistema Nervoso e órgãos dos sentidos
É mais desenvolvido que em outros vertebrados. Em muitas espécies, os hemisférios cerebrais possuem circunvoluções na superfície, de forma que há giros e sulcos. O córtex (camada externa do cérebro) é composto de matéria cinzenta. Nos mamíferos, os lobos olfativos são pequenos, se comparados aos vertebrados inferiores. O hipotálamo é muito importante e consiste de 4 partes, que controlam muitas funções inclusive pressão sangüínea, sono, conteúdo de água, metabolismo de gorduras e carboidratos, temperatura do corpo e, possivelmente, atividades rítmicas, como a migração por exemplo. O cerebelo, o centro de controle dos movimentos do corpo, também é mais desenvolvido nos mamíferos. Órgãos dos Sentidos O olfato bem desenvolvido, graças às cornetas nasais, que aumentam o epitélio olfativo. Nos olhos há modificações relacionadas aos hábitos, mas basicamente segue o padrão dos demais vertebrados. No ouvido aparecem várias modificações: a cóclea é maior e enrolada, para acomodar o aumento de tamanho; o ouvido médio tem 3 ossículos que transmitem vibrações da membrana timpânica ao ouvido interno; existe um canal auditivo externo e, na maioria, um pavilhão auditivo externo. Em certos mamíferos terrestres, o pavilhão cresceu muito e serve não apenas para conduzir o som para o canal auditivo, mas também pode funcionar para ajudar na termorregulação. As enormes orelhas dos elefantes e as dos coelhos podem ter esse uso suplementar. É bom lembrar que em alguns cetáceos e mamíferos como a toupeira, o pavilhão externo desapareceu. O aparelho auditivo de alguns mamíferos mostra uma especialização marcante. Muitos morcegos e cetáceos dependem em grande parte dos ecos e sons, que eles próprios produzem, para detectar a presença de objetos em seu ambiente (eco-localização). Os morcegos produzem som de alta freqüência (> 100 kHz), enquanto as baleias sem dentes emitem sons de baixa freqüência.
CARACTERÍSTICAS DA CLASSE MAMMALIA
RESUMO
1. Glândulas mamárias - secreção de leite para os filhotes
2. Possuem pelos no epitélio de revestimento (evitam a perda de calor).
3. Maioria terrestre (alguns podem voar ou viver na água)
4. Tamanho e peso bem variados (musaranho - 10 cm e 3 g; baleia-azul - 30 m e 200 t)
5. Queratina presente na pele - torna a pele seca (proteção contra bactérias).
A pele é
mole, fina , pluriestratificada com queratina e com pelos. Na pele
estão presentes glândulas sebáceas que secretam ácido graxo que protege e
impermeabiliza a pele e os pelos (função bacteríostática). As glândulas
sudoríparas secretam água e sais para a regulação da temperatura
corporal. A pele pode ser divida, para fins de estudo, nas seguntes partes:
Epiderme
Derme (camada intermediária) camada intermédia da pele, localizada logo abaixo da epiderme. É
responsável por cerca de 90% da espessura cutânea. Substâncias como o colágeno e a elastina, que conferem elasticidade à pele, estão aqui
localizadas. É nesta camada que o padrão predominante de fibras de
colágeno determina a tensão característica e as rugas da pele. As linhas de clivagem
(também denominadas linhas de tensão ou linhas de Langer) tendem a ser
longitudinais espirais nos membros e transversais no pescoço e no
tronco. As linhas de clivagem nos cotovelos, joelhos, tornozelos e
punhos são paralelos às pregas transversais que surgem quando os membros
são fletidos; flexione seu punho e verá várias delas.
6. São homeotérmicos (mantém a temperatura do corpo constante) e endotérmicos (retiram o calor do interior do organismo).
e Hipoderme ou tecido celular subcutâneo é uma camada de tecido conjuntivo frouxo localizado abaixo da derme, unindo-a de maneira pouco firme aos órgãos adjacentes.
Tipos de Epitélio mostrando a camada da epiderme
Localização dos diferentes epitélios no corpo dos animais
7.
Glândulas sudoríparas (produzem o suor, que ajuda a manter a
temperatura do corpo estável), glândulas sebáceas (produzem uma ácido
graxo que lubrifica os pelos, ajuda a impermeabilizar a pele e impede a
penetração de bactérias) e glândula odoríferas (responsáveis pelo
cheiro característico dos mamíferos: ácido caprílico)
8. Tecido adiposo - células, sob a pele, que armazena gordura (funciona como isolante térmico)
9. Diversos tipos de dentes (incisivos, caninos, pré-molares e molares) que se fixam em alvéolos, especializados na forma e com diferentes funções, adaptados ao tipo de alimentação do animal; dentição diferenciada (Heterodontes).
Exemplos de dentição em mamíferos
10.
A digestão começa na boca, através da saliva e os dentes, passa por
diversos processos, incluindo enzimas digestivas liberadas por diversos
órgãos e a absorção do alimento no intestino delgado até os resíduos
serem liberados pelo intestino grosso através do ânus.
11. Todos os mamíferos possuem pulmões alveolares bem desenvolvidos.
13. Sistema urinário formado por dois rins, dois ureteres, uma bexiga urinária e uma uretra.
14. Sistema nervoso - encéfalo (cérebro - parte melhor desenvolvida; cerebelo; bulbo; ponte), medula nervosa e nervos.
Evolução do Cérebro nos vertebrados, observe as modificações ocorridas entre as duas espécies de mamíferos.
15. Grande capacidade de aprendizado.
16. Fecundação interna - a grande maioria vivípara, filhotes se desenvolvem e se nutrem nas mães
17.
Por meio da placenta, o embrião se alimenta e respira. Também despeja
gás carbônico e outros resíduos por ela. A comunicação do embrião e a
placenta é feita por meio do cordão umbilical.
18. Classificação
Prototérios: Não apresentam mamilos, porém apresentam glândulas mamárias. Únicos mamíferos ovíparos, apresentam cloaca.
Metatérios:
placenta pouco desenvolvida, o embrião completa seu desenvolvimento
dentro de uma bolsa (o marsúpio) onde se encontram as glândulas
mamárias.
Eutérios: são a maioria dos mamíferos. São vivíparos, apresentam placenta bem desenvolvida.
MAMÍFEROS
https://youtu.be/8jzxLEydoVo
A representação diagramática da terminologia é Synapsida (S) inclui todos os táxons fósseis e recentes mais relacionados aos mamíferos vivos (M) do que aos répteis vivos (R). Os principais subclados de sinapsídeos incluem Therapsida (T) e Cynodontia (C), que incluem os mamíferos como representantes existentes. Sinapsídeos que não são therapsídeos (isto é, sinapsídeos não-therapsídeos) são um grupo parafilético tradicionalmente denominado “pelycosaurios” (P). Como os sinapsídeos fósseis mostram uma mistura de características mamíferas e reptilianas; estas últimas realmente retendo da condição amniotas primitiva, o termo “repteis mamaliformes” é freqüentemente empregado.(Netnatue,2020)
Exercícios
1) Cite as apomorfias dos mamíferos e e explique cada uma delas.
2) Observe a tabela e o cladograma abaixo
Com base na tabela acima escreva nos retângulos as características evolutivas que separam esses táxons uns dos outros. A tartaruga é um réptil e está colocada no cladograma como um grupo irmão dos mamíferos.
Bibliografia
Texto produzido pelo Al Martins 90132
STORER, T. I. e USINGER, R. L. Zoologia Geral. São Paulo, Coompania Editora Nacional, 1978.
http://sigep.cprm.gov.br/propostas/Sitio_Fossilifero_Predebon_QuartaColonia_RS_Art_2_Ameghiniana.pdf
https://netnature.wordpress.com/2018/08/16/os-primeiros-mamiferos-uma-abordagem-aos-grupos-extintos/
https://www.fcav.unesp.br/Home/departamentos/biologia/MARIACELIAPORTELLA/15t.-aula-mammalia-2014.pdf
Hominideos
Determinação sexual
Arnold AP, Itoh Y & Melamed E (2008) A bird’s-eye view of sex chromosome dosage compensation. Annu Rev Genomics Hum Genet 9 , 109–127
Berta P, Hawkins JR, Sinclair AH, Taylor A, Griffiths BL, Goodfellow PN, Fellous M (November 1990). “Genetic evidence equating SRY and the testis-determining factor”. Nature 348 (6300): 448–50.
Clinton M (1998) Sex determination and gonadal development: a bird’s eye view. J Exp Zool 281, 457–465.
Chue J. and Craig A. Smith. Sex determination and sexual differentiation in the avian model. EBS Journal 278 (2011) 1027–1034 ª 2011
Cooper DW, Johnston PG, Watson JM, Graves JAM. X inactivation in marsupials and monotremes. Semin Dev Biol 1993;4:117–28.
Duret L, Chureau C, Samain S, Weissenbach J, Avner P. The Xist RNA gene evolved in eutherians by pseudogenization of a protein-coding gene. Science 2006;312:1653–5.
Ezaz T, Stiglec R, Veyrunes F, Graves JAM. Relationships between vertebrateZWandXYsex chromosome systems. Curr Biol 2006;16:R736–43.
Elbrecht A & Smith RG (1992) Aromatase enzyme activity and sex determination in chickens. Science 255 , 467–470.
Gahr M (2003) Male Japanese quails with female brains do not show male sexual behaviors. Proc Natl Acad Sci USA 100 , 7959–7964
Glickman SE, Short RV & Renfree MB (2005) Sexual differentiation in three unconventional mammals: spotted hyenas, elephants and tammar wallabies. Horm Behav 48 , 403–417
Graves JAM. The origin and function of the mammalian Y chromosome and Y-borne genes-an evolving understanding. Bioessays 1995;17:311–20.
Graves JAM. Sex chromosome specialization and degeneration in mammals. Cell 2006;124:901–14.
Grutzner F, Rens W, Tsend-Ayush E, El-Mogharbel N, O’Brien PC, Jones RC, et al. In the platypus a meiotic chain of ten sex chromosomes shares genes with the bird Z and mammal X chromosomes. Nature 2004;432:913–7.
Herpin AS & Schartl M (2011) DMRT1 genes at the crossroads: a widespread and central class of sexual
development factors in fish. FEBS J 278 , 1010–1019.
Hillier LW, Miller W, Birney E, Warren W, Hardison R, Ponting CP, Bork P, Burt D, Groenen MAM & Delany ME (2004) Sequence and comparative analysis of the chicken genome provide unique perspectives on vertebrate evolution. Nature 432 , 695–716.
Houck ML, Kumamoto AT, Gallagher Jr DS, Benirschke K. Comparative cytogenetics of the African elephant (Loxodonta africana) and Asiatic elephant (Elephas maximus). Cytogenet Cell Genet 2001;93:249– 52.
Ihara N, Takasuga A, Mizoshita K, Takeda H, Sugimoto M, Mizoguchi Y, et al. A comprehensive genetic map of the cattle genome based on 3802 microsatellites. Genome Res 2004;14:1987–98.
Jakob S & Lovell-Badge R (2011) Sex determination and the control of Sox9 expression. FEBS J
Jacobs PA, Strong JA. A case of human intersexuallity having a possible XXY sex-determining mechanism. Nature 1959;183:302–3.
Kohn M, Kehrer-Sawatzki H, VogelW, Graves JAM, Hameister H.Wide genome comparisons reveal the origins of the human X chromosome. Trends Genet 2004;20:598–603.
Matsubara K, Tarui H, Toriba M, Yamada K, Nishida-Umehara C, Agata K, et al. Evidence for different origin of sex chromosomes in snakes, birds, and mammals and step-wise differentiation of snake sex chromosomes. Proc Natl Acad Sci USA 2006;103:18190–5.
Murphy WJ, Eizirik E, Johnson WE, Zhang YP, Ryder OA, O’Brien SJ. Molecular phylogenetics and the origins of placental mammals. Nature 2001;409:614–8.
Nanda I, Shan Z, Schartl M, Burt DW, Koehler M, Nothwang H, et al. 300 million years of conserved synteny between chicken Z and human chromosome 9. Nat Genet 1999;21:258–9.
Ohno S. Sex chromosomes and sex-linked genes. New York: Springer-Verlag; 1967
Raymond CS, Murphy MW, O’Sullivan MG, Bardwell VJ, Zarkower D. Dmrt1, a gene related to worm and fly sexual regulators, is required for mammalian testis differentiation. Genes Dev 2000;14:2587–95.
Reisert I & Pilgrim C (1991) Sexual differentiation of monoaminergic neurons – genetic or epigenetic? Trends Neurosci 14 , 468–473.
Rens W, Gr¨utzner F, O’Brien PC, Fairclough H, Graves JAM, Ferguson-Smith MA. Resolution and evolution of the duck-billed platypus karyotype with an X1Y1X2Y2X3Y3X4Y4X5Y5 male sex chromosome constitution. Proc Natl Acad Sci USA 2004;101:16257–61.
Sankovic N. Molecular characterisation of a marsupialYchromosome, in research school of biological sciences. Canberra: The Australian National University; 2005.
Sankovic N, Delbridge ML, Grutzner F, Ferguson-Smith MA, O’Brien PC, Graves JAM. Construction of a highly enriched marsupial Y chromosome-specific BAC sub-library using isolated Y chromosomes. Chromosome Res 2006;14:657–64.
Shetty S, Kirby P, Zarkower D, Graves JAM. DMRT1 in a ratite bird: evidence for a role in sex determination and discovery of a putative regulatory element. Cytogenet Genome Res 2002;99:245–51.
Shetty S, Griffin DK, Graves JAM. Comparative painting reveals strong chromosome homology over 80 million years of bird evolution. Chromosome Res 1999;7:289–95.
Smith CA, McClive PJ, Western PS, Reed KJ & Sinclair AH (1999) Conservation of a sex-determining gene. Nature 402 , 601–602.
Smith CA & Sinclair AH (2004) Sex determination: insights from the chicken. Bioessays 26 , 120–132.
Smith CA, Roeszler KN, Ohnesorg T, Cummins DM, Farlie PG, Doran TJ & Sinclair AH (2009) The avian Z-linked gene DMRT1 is required for male sex determination in the chicken. Nature 461 , 267–271
Soullier S, Hanni C, Catzeflis F, Berta P, Laudet V. Male sex determination in the spiny rat Tokudaia osimensis (Rodentia: Muridae) is not Sry dependent. Mamm Genome 1998;9:590–2.
Spencer JA, Sinclair AH, Watson JM, Graves JAM. Genes on the short arm of the human X chromosome are not shared with the marsupial X. Genomics 1991;11:339–45.
Toder R, Wakefield MJ, Graves JAM. The minimal mammalian Y chromosome—the marsupial Y as a model system. Cytogenet Cell Genet 2000;91:285–92.
Wachtel SS (1981) Conservatism of the H-Y ⁄ H-W receptor. Hum Genet 58 , 54–58.
Wachtel SS, Wachtel GM, Nakamura D & Gilmour D (1983) H-Y antigen in the chicken.
Differentiation 23 (Suppl), S107–S115.
Waters PD, Dobigny G, Pardini AT, Robinson TJ. LINE-1 distribution in Afrotheria and Xenarthra: implications for understanding the evolution of LINE-1 in eutherian genomes. Chromosoma 2004;113:137–44
Waters PD, Duffy B, Frost CJ, Delbridge ML, Graves JAM. The human Y chromosome derives largely from a single autosomal region added to the sex chromosomes 80–130 million years ago. Cytogenet Cell Genet 2001;92:74–9.
Waters PD, Delbridge ML, Deakin JE, El-Mogharbel N, Kirby PJ, Carvalho-Silva DR, et al. Autosomal location of genes from the conserved mammalian X in the platypus (Ornithorhynchus anatinus): implications for mammalian sex chromosome evolution. Chromosome Res 2005;13:401–10.
Watson JM, Spencer JA, Riggs AD, Graves JAM. Sex chromosome evolution: platypus gene mapping suggests that part of the human X chromosome was originally autosomal. Proc Natl Acad Sci USA 1991;88: 11256–60.
Watson JM, Spencer JA, Riggs AD, Graves JAM. The X chromosome of monotremes shares a highly conserved region with the eutherian and marsupialXchromosomes despite the absence ofXchromosome inactivation. Proc Natl Acad Sci USA 1990;87:7125–9.
Waterston RH, Lindblad-Toh K, Birney E, Rogers J, Abril JF, Agarwal P, et al. Initial sequencing and comparative analysis of the mouse genome. Nature 2002;420:520–62.
Woodburne MO, Rich TH, Springer MS. The evolution of tribospheny and the antiquity of mammalian clades. Mol Phylogenet Evol 2003;28:360–85.
Yang F, Alkalaeva EZ, Perelman PL, Pardini AT, Harrison WR, O’Brien PCM, et al. Reciprocal chromosome painting among human, aardvark, and elephant (superorder Afrotheria) reveals the likely eutherian ancestral karyotype. Proc Natl Acad Sci USA 2003;100:1062–6.
Yoshimoto S & Ito M (2011) A ZZ ⁄ ZW-type sex determination in Xenopus laevis . FEBS J 278 , 1020– 1026
Dentes
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
- ↵
Uma molécula descoberta em uma aranha no Brasil poderá salvar da extinção um mamífero que vive do outro lado planeta. Batizada de gomesina, um peptídeo (pequena proteína, nesse caso formada por 18 aminoácidos), foi encontrada na aranha caranguejeira Acanthoscurria gomesiana. Agora, pesquisadores australianos estão testando sua ação no combate a um tipo de câncer que está dizimando a população do diabo-da-tasmânia, marsupial que só vive na ilha que lhe dá o nome, localizada a 240 km da costa sudeste da Austrália. O diabo-da-tasmânia (Sarcophilus harrisii) é o maior marsupial carnívoro do mundo. Até 3 mil anos atrás ele vivia também na parte continental da Austrália, mas hoje seu habitat se restringe à ilha da Tasmânia, que é um Estado australiano. Mesmo lá, ele corre sério risco de extinção, por causa de uma forma contagiosa e transmissível "parasitária" de câncer conhecida como doença do tumor facial do diabo-da-tasmânia (TFDT). Desde que o mal surgiu, em 1996, cerca de 80% desses animais foram mortos. Se nada for feito, os cientistas estimam que a espécie será extinta dentro dos próximos 15 a 25 anos. (Noticia Imprensa).
Formação e composição do leite
Anatomia do peito feminino.
(Fonte ilustração: MatoomMi / Shutterstock.com)(IE)
Mama
Glândulas mamamrias de bovino
Localização das glândulas mamárias de uma gata
Localização das glândulas mamárias de uma gata
Comparação entre um mamilo sadio (esquerda) e um doente (direita)
(Fonte:biosol)
Segundo González (2002) a unidade anátomo-funcional do tecido mamário secretor é o alvéolo, estrutura sacular cujas paredes estão compostas de células epiteliais secretoras.
Ácino da gândula mamária
Cerca de 150 a 220 alvéolos formam o lóbulo, que possui um duto drenado por um duto comum maior. Grupos de lóbulos formam lobos separados por septos de tecido conectivo.
Os dutos lobulares confluem a um canal galactóforo que por sua vez desemboca no seio galactóforo, em comunicação com a cisterna da glândula. Cada alvéolo é irrigado por uma rede de capilares que fornece os nutrientes necessários para a síntese do leite.
Os elementos contráteis do alvéolo são as células mioepiteliais, as quais são sensíveis ao ocitocina. Em volta do alvéolo existe tecido conectivo (tecido conjuntivo), que adquire maior proporção durante a involução da glândula mamária (Gonzálaz, 2002).
Nos humanos a glândula mamária em lactação é composta por 15 a 20 lobos separados por septos de tecido conjuntivo com células adiposas. Cada lobo é drenado por um único ducto lactífero que conflui para o mamilo, revestido por dupla camada de células cúbicas ou colunares e por uma bainha de tecido conjuntivo com células mioides (céllulas mioepiteliais) (infoescola).
O processo de lactogênese compreende a diferenciação das células mamárias, as quais passam de um estado não secretor para um estado secretor. Esse processo envolve duas etapas:
(a) Diferenciação histológica e bioquímica das células epiteliais alveolares, que ocorre durante o terço final da gestação. Estas diferenças podem ser evidenciadas pelo aumento da relação RNA/DNA, que de um valor <1 durante a gestação, passa para 2 no início da lactação, o que indica aumento da síntese de proteínas e pelo aumento do quociente respiratório, que indica aumento da oxidação de substratos energéticos;
(b) Início da secreção dos produtos do leite, geralmente 1-4 dias antes depois do parto.
A formação do leite demanda um enorme trabalho metabólico. Em uma vaca leiteira, é requerida a passagem de 450 litros de sangue pela glândula mamária para produzir 1 litro de leite. (Gonzálaz, 2002)
O leite é sintetizado a paritr de nutriente fornecidos para as células da glândula mamária pelo sangue. Estes nutrientes são provenientes diretamente da dieta ou a pós sofrerem modificações nos tecios dos animais antes de alcançar a glândula mamária. Os principais componentes do leite são:
Água: 86 a 88%
Sólidos totais: 12,0 a 14,0 %
Gordua:3,5 a 4,5 %
Proteínas: 3,2 a 3,5%
Lactose: 4,6 a 5,2 %
Minerais: 0,7 a 0,8 %
Vitaminas
Células bacterianas, leucócidos, células mamárias secretoras
A quantidade de leite produzido varia muito em função da espécie (bovino, equino, ovino, caprino, canideo, homninidae) e da raça do bovino, além da variação individual.
Algumas espécies, como a vaca, a cabra e a ovelha foram selecionadas geneticamente para produzir leite para o consumo humano, em quantidades que estão além de suas necessidades biológicas.
De forma geral, as quantidades diárias de leite produzidas são de 11 a 45 kg na vaca, 9 a23 kg na égua, 1,3 a7 kgna cabra, 1 a 4,5 kg na ovelha, e 2 a 9 kg na porca.(Gonzálaz, 2002)
Entre os componentes exclusivos, sintetizados pela glândula mamária, que como vimos é uma glândula exócrina túbulo-alveolar, do tipo apócrina, ou seja, junto à secreção produzida nas células epiteliais glandulares, uma parte do citoplasma também é liberada, que são considerados como indicadores do processo lactogênico estão a lactose, a α-lactalbumina, a caseína, além de certos tipos de triglicerídios e citrato em ruminantes. (modif. Gonzálaz, 2002)
A proporção dos diferentes componentes do leite nas espécies varia especialmente quanto ao conteúdo de gordura, proteína e lactose (Tabela VII-3).
Dentro das proteínas do leite, a mais importante é a caseína, que perfaz cerca de 90% das proteínas lácteas. Existem vários tipos identificados de caseínas:
As caseínas se agregam formando grânulos insolúveis chamados micelas. As demais proteínas do leite estão em forma solúvel.
A α-lactalbumina corresponde a 2-5% do total de proteínas e funciona como uma das subunidades da enzima lactose sintetase. A lactose sintetase consta de duas proteínas, a proteína A, uma galactosil transferase, e a proteína B, que é a α-lactalbumina. Durante a gestação, a progesterona impede a síntese de α- lactalbumina, mas não da galactosil transferase, a qual transfere galactose sobre outros monossacarídeos diferentes de glicose para participar na formação de oligossacarídeos de membrana.(Gonzálaz, 2002)
Outras proteínas do leite incluem a β-lactalbumina (7-12%), albumina sérica (1%) e as imunoglobulinas G, M e A (1,3-2,8%) (Gonzálaz, 2002).
Os precursores para a síntese das proteínas do leite são aminoácidos livres do sangue em 90% e proteínas séricas em 10%. Entre estas últimas estão as imunoglobulinas.
A maioria da gordura do leite está representada pelos triglicerídios. A quantidade e a composição dos triglicerídios do leite variam muito entre as espécies (Tabela VII-3). Nos ruminantes, a proporção de ácidos graxos de cadeia curta e insaturados é bem maior que nos monogástricos. Os precursores dos ácidos graxos sintetizados no tecido mamário incluem glicose, acetato e β-hidroxibutirato. Entretanto, alguns ácidos graxos provenientes da dieta ou do metabolismo ruminal e intestinal são incorporados à glândula mamária a partir do sangue. Uma grande proporção de triglicerídios transportados pelas lipoproteínas do sangue entram na glândula mamária (Gonzálaz, 2002).
Aproximadamente 25% dos ácidos graxos do leite são derivados da dieta e 50% do plasma sanguíneo. O resto é elaborado na glândula mamária a partir de precursores, principalmente de acetato. A glândula mamária possui a enzima glicerol quinase, podendo portanto produzir glicerol-3-fosfato a partir de glicerol livre, para a síntese de triglicerídios. Contudo, cerca de 70% do glicerol necessário para a síntese de triglicerídios na glândula mamária provém da glicose sanguínea (Gonzálaz, 2002).
Os ácidos graxos de cadeia média (8-12 Carbonos) são característicos do leite não sendo possível encontrá-los em outros tecidos.
A lactose, açúcar primário do leite, é um dissacarídeo que constitui o maior regulador osmótico da célula mamária funcional, sendo portanto sua concentração o principal determinante do volume de leite secretado.
A galactose é originada a partir de glicose mediante a seguinte série de reações:
glicose + ATP → glicose-6-fosfato + ADP (enzima: hexoquinase)
glicose-6-fosfato → glicose-1-fosfato (enzima: fosfoglicomutase)
glicose-1-fosfato +UTP → UDP-glicose + PPi (enzima: UDP-glicose pirofosforilase) UDP-glicose → UDP-galactose (enzima: UDP-galactose 4-epimerase)
A lactose isomerase, enzima limitante na secreção de leite, catalisa a transferência de UDP-galactose sobre a glicose para dar lactose.
A glicose que não é utilizada para a síntese de lactose vai para síntese de glicerol e fornecimento de energia.
A disponibilidade de glicose sanguínea é um fator limitante para a síntese de leite. Outros precursores da glicose para a síntese de lactose são propionato, glicerol, pentoses-fosfatos e lactato(Gonzálaz, 2002).
Dos minerais do leite os mais importantes são o cálcio (0,12%) e o fósforo (0,1%), os quais provêem do sangue. O cálcio no leite é encontrado combinado de forma insolúvel com caseinato, citrato e fosfatos, de forma que consegue acumular altas concentrações ao mesmo tempo que mantém equilíbrio osmótico com o sangue.
A capacidade tamponante (a capacidade tamponante é a quantidade de íons hidrônio ou hidróxido que um tampão pode absorver sem uma mudança significativa em seu pH) do leite é atribuída a seu conteúdo de citrato, fosfato, bicarbonato e proteínas, os quais garantem a manutenção do pH em torno de 6,6.
Outros minerais presentes no leite incluem zinco, cobre, ferro, iodo, manganês e molibdênio. As quantidades de ferro e cobre estão em quantidades insuficientes para cobrir as necessidades do lactente (Gonzálaz, 2002).
A glândula mamária não sintetiza vitaminas, sendo que todas as vitaminas do leite provêm do sangue, (sintetizadas em outros lociais). O leite contém vitaminas A, D, E e a maioria do complexo B. Os pesquisadores identificaram treze vitaminas: A, C, D, E, K e oito vitaminas do complexo B. Essas vitaminas podem ser obtidas com uma dieta saudável, de comida variada, incluindo muitas freutas, legumes e verduras. Nosso corpo produz as vitaminas D e K; a vitamina D é fabriacada quando a pele é exposta à luz do sol. As principais formas da vitamina K são: K1 ou liloquinona que é encontrada na dieta e K2 ou menaquinona, esta obtida através da síntese que ocorre no organismo a partir das bactérias intestinais, principalmente da Escherichia coli.(Escola).
As vitaminas A, D, E e K não se dissolvem na água. Se o organismo não as usa de imediato, elas ficam armazenadas na gordura do corpo e no fígado.
O nível de vitamina C é baixo e, no caso do leite de vaca para consumo humano, a maioria é destruída no processo de pasteurização (Gonzálaz, 2002).
O colostro é mais rico que o leite em quantidade de vitamina A (4-25 vezes), D (3-10 vezes) e E (2,5-7 vezes).
Em geral, o leite das vacas Jersey e Guernsey têm maior conteúdo vitamínico que a raça holandesa (Gonzálaz, 2002).
O leite contém enzimas como a peroxidase e a catalase, as quais aumentam nos processos inflamatórios e sua elevação é usada nos métodos diagnósticos de mastite. Outras enzimas presentes no leite incluem fosfatases, xantino-oxidase e redutases.
Bibliografia
Santos D.A.S., Vicente W.R.R., Canola J.C. & Léga E. 2004. Estudo da papila mamária em fêmeas bovinas (Bos taurus Linnaeus, 1758), mediante as características ultra-sonográficas em modo-B (tempo rela). Braz. J. Vet. Res. Anim. Sci. 41(5):349-354.
Samoto V.Y., Miglino M.A., Ambrósio C.E., Pereira F.T.V., Lima M.C. & Carvalho A.F. 2006. Morfologia da glândula mamária de gambás da espécie Didelphis sp associada ao modelo marsupial. Biota Neotrop. 6(2):1-12. DOI: 10.1590/S1676-06032006000200014






























































































































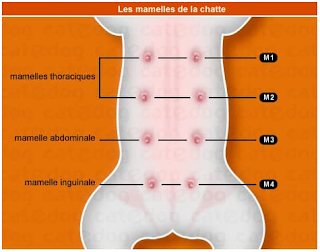






3 comentários:
Muito bom! Sou professor da rede estadual de ensino do estado do Paraná e adorei o blog de vocês, obrigado.
Olá, boa tarde. Sou professor de ciências e biologia na rede estadual de ensino do estado do Paraná e por acaso cheguei ao site de vocês ontem e posso afirmar que adorei o que vi e o que estou vendo! Obrigado pela dedicação e pelas postagens ricas e substanciais, já virei fã.
Abraços.
Muito obrigado Prof. Paulo. Sucesso ai com os alunos!
Postar um comentário