FISIOLOGIA VEGETAL
Germinação
Fitocromo
Desenvolvimento da plântula
Transporte de seiva
Fitormônios
Auxina
Etileno
Giberelinas
Ácido abscísico
Citocinina
Nutrição vegetal
Movimento
Abcisão foliar e maturação
O que acontece quando um fruto amadurece?
Nos frutos carnosos, a clorofila é degradada e outros pigmentos podem formar-se alterando sua coloração. Simultaneamente, a parte carnosa do fruto amolece como resultado da digestão enzimática da pectina, o componente principal da lamela média da parede celular. Durante esse mesmo período o amido, ácidos orgânicos e óleos são metabolizados em açúcares. Há ainda o desaparecimento de ácidos orgânicos e de compostos fenólicos, incluindo os taninos. Como consequência dessas transformações, os frutos tornam-se visíveis, saborosos.
Essas características podem frequentemente ser atribuídas ao acumulo de antocioninas e carotenoides na epiderme desses frutos. O que os tornam atrativos para os animais que se alimentam dos frutos e então disseminam as sementes. (pontobiologia)
CONCEITOS DE GERMINAÇÃO
Germinação pode ser encarada como uma sucessão de etapas que determina, em uma semente quiescente e com baixo teor de água, a retomada das atividades metabólicas e o início da formação de uma plântula, a partir do embrião (Mayer & Poljakoff-Mayber, 1975)
Germinação compreende uma sequência ordenada de eventos metabólicos que resulta no reinício do desenvolvimento do embrião, originando um plântula (Marcos-Filho, 1986)
Germinação de uma semente é a retomada de crescimento do embrião, que resulta na ruptura da cobertura da semente e na emergência da plântula (Copeland & Mc Donald, 1995)
Germinação é uma sequência de eventos morfogenéticos que resultam na transformação do embrião em plântula (Berlyn, 1972)
Germinação pode ser encarada como uma sucessão de etapas que determina, em uma semente quiescente e e com baixo teor de água, a retomada das atividades metabólicas e o início da formação de uma plântula, a partir do embrião (Mayer & Poljakoff-Mayber, 1975)
Morfologicamente, a germinação é a transformação do embrião em plântula. Sob o ponto de vista fisiológico, consiste na retomada do metabolismo e do crescimento e no reinício da transcrição do genoma. Bioquimicamente, a germinação se refere à diferenciação sequencial dos caminhos oxidativos e de síntese e à à retomada de processos bioquímicos característicos do crescimento vegetativo e do desenvolvimento (Jann & Amen, 1980). (Marcos Filho, 2020)
Solanum lycocarpum belongs to the Solanaceae and is popularly known as lobeira, fruit-of-wolf, eggplant and jurubeba˜o (Rizzini, 1971; Almeida et al., 1998). S. lycocarpum is abundant in the Cerrado biome in the central part of Brazil (Haraguchi et al., 1980; Oliveira-Filho and Oliveira, 1988) and displays both arborous and shrub shapes, attaining 4 m in height (Correˆa, 1984). This species has ecological importance as the fruits serve as food to an important wolf species (Chrysocyon brachyurus) that occurs in the Cerrado (Mota Ju´nior and Martins, 2002), to the tapir (Tapirus terrestris) (Pinto, 1998), crab eating fox (Cerdocyon thous) (Rodrigues, 2002), hoary fox (Lycalopex vetulus) (Dalponte and Lima, 1999) and tegu lizard (Tupinambis merianae) (Castro and Galetti, 2004). The fruits of S. lycocarpum also possess nourishing and medicinal properties (Dall’Agnol and von Poser, 2000).
In addition, the species presents successful growth and development in unfavourable ambient conditions, such as water stress, acid soils and nutrient-poor soils (Vidal et al., 1999), which may occur in degraded areas and pastures (OliveiraFilho and Oliveira, 1988). Despite the usefulness and importance of this species, little is known regarding the morphology and anatomy of its fruits and seeds as well as the regulation and mechanism of germination of its seeds. Studies of the morphological characteristics of fruit and seed are important for the identification and analysis of the variation of species (Oliveira and Pereira, 1984; Amorim, 1996); for the definition of the storage conditions and sowing methods (Kuniyoshi, 1983); for selecting the substrate used in germination tests (Arau´jo and Matos, 1991) and for management studies aiming at fauna conservation through determination of their herbivorous diet (Kuniyoshi, 1983). Another relevant factor is that morpho-anatomical studies of the seeds allow the identification of species present in the soil seed bank, which enables greater understanding of future regeneration and vegetal succession in forest ecosystems (Beltrati, 1994). In addition, such studies may provide a clue as to which technological, physiological and molecular strategies should be adopted to understand the mechanism and regulation of seed germination (da Silva et al., 2007). (Pinto et alii, 2007).
Solanun lycocarpum St. Hil. 1753
(Fonte: Fernando Tatagiba. WP, 1) -
Embriogênese
Radiação solar que chega a Terra. Lei do inverso dos quadrados
Irradiância solar (Angelocci, 2012)
A luz é um importante fator que controla o crescimento e o desenvolvimento da planta. (fisiologiavegetal)
A principal razão para isso é claro, é que a luz é responsável pela fotossíntese. Porém, outros efeitos da luz sobre o desenvolvimento da planta e que são completamente independentes da fotossíntese, também ocorrem.
Muitos desses efeitos controlam a aparência da planta, isto é, o seu desenvolvimento estrutural ou morfogênese. O controle da morfogênese pela luz é conhecido como FOTOMORFOGÊNESE.
Para que a luz possa controlar o desenvolvimento da planta, ela inicialmente deve ser absorvida. A percepção do sinal luminoso requer um pigmento que absorva a luz e torne-se fotoquimicamente ativo, funcionando como um fotorreceptor.
Este fotorreceptor, pela absorção seletiva de luz de diferentes comprimentos de onda, interpreta a informação na forma de uma ação primária. Esta ação primária pode envolver uma mudança na conformação de uma proteína, uma reação redox ou outra forma de transdução química.
Independente da natureza do evento primário, a absorção da luz pelo fotorreceptor inicia uma cascata de eventos bioquímicos conhecida como cadeia de transdução e amplificação de sinal, a qual produz a resposta final (note que a seqüência é semelhante ao modo de ação proposto para os hormônios. A diferença é que o hormônio se liga a um receptor específico na membrana da célula alvo enquanto, nas respostas fotomorfogenéticas, a molécula ativa é o próprio fotorreceptor).
As respostas fotomorfogenéticas em plantas parecem estar sob o controle de três fotorreceptores:
• Fitocromo
Apresenta absorção no azul bem como na região do espectro
correspondente ao vermelho e vermelho distante (ou vermelho extremo);
• Criptocromo
Pigmento que absorve a luz azul e ultravioleta (UV–A, 320 a 400
nm). Esse pigmento parece ser importante em Criptógamas;
• Fotorreceptor de UV–B
São compostos que absorvem radiação ultravioleta na
faixa de 280 a 320 nm.
DESCOBERTA DO FITOCROMO
Alguns efeitos fotomorfogenéticos podem ser facilmente notados comparando-se
plântulas crescendo na luz com plântulas crescendo no escuro (Figura 1). As plântulas
crescendo no escuro são estioladas. Algumas diferenças causadas pela luz são visíveis:
• A produção de clorofila é promovida pela luz;
• A expansão da folha é promovida pela luz;
• O alongamento do caule é inibido pela luz;
• O desenvolvimento da raiz é promovido pela luz.
NATUREZA QUÍMICA DO FITOCROMO
O fitocromo é uma cromoproteína, consistindo de um cromóforo e uma apoproteína (porção protéica de uma cromoproteína). O cromóforo é uma cadeia aberta tetrapirrólica, sendo os quatro anéis denominados de A, B, C e D (Figura 2). O anel A do cromóforo é covalentemente ligado à apoproteína através de uma ligação tioéter a um resíduo de cisteína. As propriedades fotoquímicas do fitocromo resultam da complexa interação entre o cromóforo e a apoproteína. Estudos sobre as propriedades fotoquímicas do fitocromo, em plântulas crescendo no escuro, indicam que ele apresenta uma absorção máxima em 667 nm para a forma de fitocromo vermelho (Fv) e em 730 nm para a forma vermelho distante (FVD).(fisiologiavegetal)
Provável estrutura do cromóforo do fitocromo e sua ligação à apoproteína
(Hopkins, 2000)
O fitocromo parece existir in vivo como um dímero, com um cromóforo para cada
monômero. Massas moleculares para monômeros nativos variam de 120 (Zuchini) a 127 kDa
(milho). A massa molecular do fitocromo de aveia, o qual tem sido mais extensivamente
estudado, é de 124 kDa (em plantas estioladas). Alguns resultados experimentais têm indicado
que o pigmento é fortemente associado com membranas celulares. No entanto, os estudos com
fitocromo de aveia mostraram que a proteína é relativamente hidrofílica, a qual é mais
consistente com o modelo de uma proteína globular solúvel do que uma proteína intrínseca de
membrana. (fisiologiavegetal)
Espectros de absorção do fitocromo vermelho e do fitocromo vermelho distante (extremo) (Taiz & Zeiger, 1998).
As sementes em que a luz estimula o processo de germinação são conhecidas como
fotoblásticas positivas. Aquelas cuja germinação é inibida pela luz são fotoblásticas negativas.
Muitas outras, incluindo a maioria das espécies cultivadas, não são afetadas pela luz, ou seja,
elas germinam na luz ou no escuro.
Sementes, tais como as de alface, podem requerer somente breve exposição à luz,
medida em segundos ou minutos (Tabela 1 abaixo), enquanto outras podem requerer algumas horas
ou mesmo dias de constantes ou intermitentes irradiância. Em todos os casos, o pigmento
responsável parece ser o fitocromo. Quando a luz requerida é de baixa fluência e as respostas
são fotorreversíveis (ver Tabela 1), as respostas são classificadas como LFRs. (fisiologiavegetal).
Desenvolvimento da plântula
Plântulas crescendo no escuro mostram excessivo alongamento do caule, as folhas
permanecem pequenas (principalmente nas dicotiledôneas), os cloroplastos não se
desenvolvem completamente e não ocorre síntese de clorofila. Após a iluminação com luz de
baixa fluência, a taxa de crescimento do caule diminui (Figura 1), as folhas se expandem
(principalmente em dicotiledôneas), os cloroplastos se desenvolvem a partir de etioplastos e
as folhas tornam-se verdes com o acúmulo de clorofila. No caso de gramíneas, se observa
inibição do crescimento do entrenó, inibição do crescimento do coleóptilo e promoção do
desenrolamento das folhas. Note que nos dois casos, o fitocromo inibe o crescimento do caule
(Fv → FVD, que inibe o crescimento).
A significância ecológica destas respostas não é difícil para perceber. No escuro, as
reservas limitadas da semente são usadas para o crescimento em extensão do eixo,
maximizando a possibilidade da plúmula, composta de folhas jovens, alcançar a luz e ser
capaz de realizar a fotossíntese antes que as reservas sejam exauridas.
Potencial de membrana e distribuição de íons
Mudanças no potencial de membrana são fenômenos eletroquímicos, relacionados ao movimento de íons através da membrana plasmática. O potencial transmembranar modulado pelo fitocromo tem sido mostrado em uma variedade de tecidos, em estudos conduzidos em alguns laboratórios. Os resultados não são completamente consistentes, porém, em muitos casos, a luz vermelha induz a despolarização da membrana dentro de cinco a dez segundos após o tratamento. Um subsequente tratamento com vermelho distante causa um lento retorno para a polaridade normal. Uma correlação entre fitocromo e movimento de íons tem sido demonstrada em folhas que apresentam movimentos nictinásticos (dramático movimento nástico dependente de mudanças de turgescência das células). Plantas que mostram esse tipo de comportamento apresentam uma zona expandida na base da folha, o pulvino. O pulvino força o movimento da folha, alterando a sua forma como resultado da mudança diferencial de volume de suas células no lado inferior e superior. As mudanças no volume das células do pulvino estão relacionadas com a rápida redistribuição de solutos, principalmente, K+ , Cl- e malato-2. Muitas evidências sugerem que o fitocromo induz o enrolamento da folha pela regulação da bomba primária de prótons (H+ - ATPase) e pela regulação de canais de K+ nas células nos lados inferior e superior do pulvino.
Fotomorfogênese em plântulas de feijão (Phaseolus vulgaris). A plântula da
esquerda cresceu em condições de luz normal; a plântula da direita cresceu
no escuro; e a plântula do centro foi exposta a 5 minutos de luz vermelha
por dia (Hopkins, 2000)(fisiologiavegetal).
As características de plântulas crescendo no escuro são vantajosas se considerarmos, por exemplo, o processo de germinação. A plântula germinando precisa atingir a fonte de luz para se tornar fotossinteticamente ativa e, consequentemente, autotrófica. Nesse processo, como a germinação ocorre no escuro, as reservas do endosperma (ou cotilédones) são utilizadas principalmente para o alongamento do caule com pouco “investimento” na produção de folhas e de raízes. Isso tudo permite maximizar a possibilidade de sucesso no estabelecimento da plântula.
As grandes diferenças na forma e no crescimento de plantas desenvolvidas na luz e no escuro têm fascinado botânicos e fisiologistas por séculos. No entanto, pouco progresso para o entendimento desse fenômeno foi alcançado até o início da década de 1950. Nesse período, H. A. Borthwick, um botânico, S. B. Hendricks, um físico-químico, e outros colaboradores começaram um estudo do Espectro de Ação (um gráfico que mostra a efetividade da qualidade da luz sobre um determinado processo, plotado como uma função do comprimento de onda) para diversos fenômenos como: germinação de sementes de alface, alongamento do caule de ervilha e controle fotoperiódico do florescimento. Uma excitante observação foi a similaridade do espectro de ação, com picos no vermelho (promoção da resposta) e no vermelho distante (inibição da resposta), indicando a existência de um fotorreceptor comum para os processos estudados.
Mais notável, no entanto, foi a descoberta da fotorreversibilidade, uma resposta potencializada pela luz vermelha poderia ser inibida se o tratamento com luz vermelha fosse seguido imediatamente pela luz vermelha distante.
Borthwick, Hendricks e seus colaboradores encontraram similar fotorreversibilidade pelas luzes vermelha e vermelha distante, no controle do florescimento e no alongamento do caule. A partir dessas observações, esses pesquisadores propuseram a existência de um novo sistema de pigmentos, o qual ficou posteriormente conhecido como FITOCROMO. Segundo eles, o pigmento hipotético poderia existir em duas formas: uma forma com absorção no vermelho (Fv) e outra com absorção no vermelho extremo (FVD). A absorção de luz vermelha pelo Fv poderia convertê-lo para a forma FVD e vice-versa.(fisiologiavegetal)
Estrutura dos fitocromos, mostrando a isomerização cis-trans que é associada
à interconversão de Fv e Fve pela luz vermelha e vermelha distante
Distribuição do fitocromo
(Espécies, tecidos e células) e fotoconversão
O fitocromo tem sido encontrado em algas, briófitas e possivelmente em todas as
plantas superiores, onde ele executa significantes papéis na bioquímica, no crescimento e no
desenvolvimento. O fitocromo está presente na maioria dos órgãos de todas as plantas
estudadas, inclusive nas raízes. No entanto, ele é mais abundante em tecidos jovens (Figura
4). Nas células o fitocromo parece estar localizado no citosol e também em algumas
organelas. Em todas as plantas, o fitocromo é sintetizado inteiramente como fitocromo
vermelho (Fv). Aparentemente, nenhum Fve pode ser sintetizado no escuro.
Um dado interessante é que o FVD também absorve, embora menos eficientemente do que o Fv, a luz em 666 nm (vermelho). De maneira similar, o Fv também absorve um pequeno montante de luz vermelho distante (730 nm). Pelo fato dos dois espectros de absorção (Fv e FVD) se sombrearem (Figura 5), é impossível a conversão de 100% do pigmento para uma única forma, mesmo quando usamos luz “pura” no vermelho ou vermelho extremo.
Obs: As lâmpadas fluorescentes brancas são ricas em radiação no vermelho (Figura 6). Isso produz alta relação luz vermelha/luz vermelha distante (V/VD = 2,28) que produz um aumento no fotoequilíbrio, ou seja, favorece a formação do fitocromo ativo Fve. As lâmpadas incandescentes, ao contrário, produzem pouco vermelho e muita radiação vermelha distante.
Condições naturais
A maioria das informações à cerca do fitocromo é derivada de estudos com plântulas estioladas (crescendo no escuro), as quais são sujeitas a breves irradiações com luz vermelha ou vermelha extremo. Porém, é óbvio que, exceto em condições de laboratório, as plantas não crescem em uma caixa escura com ocasionais “flashes” de luz vermelha ou vermelha distante. Quando sementes germinantes alcançam a superfície do solo, a luz pode converter uma grande proporção do Fv para a forma FVD, o qual pode inibir o crescimento do caule, evitando o estiolamento. Porém, a luz do sol também contém comprimentos de onda na faixa do vermelho distante, ou seja, parte do fitocromo ativo (FVD) pode ser convertida para a forma inativa (Fv). Isto aumenta a questão de como o fitocromo funciona, e se de fato ele tem algum papel, em plantas verdes que são expostas à luz contínua (dia) em altas taxas de fluência.(fisiologiavegetal)
TRANSPORTE DA SEIVA
CONDUÇÃO DE SEIVA BRUTA
A teoria da tensão-coesão-adesão, inicialmente desenvolvida por Dixon e Joly (1895), é o modelo atualmente mais aceito para explicar o movimento ascendente da seiva bruta (xilemática) na planta.
Este movimento vertical da solução de seiva bruta (água mais sais) é uma consequência da perda de vapor de água através dos estômatos.
Transporte de seiva pela planta requer dois tipos de tecidos especializados:
o Xilema e o Floema.
Segundo esta teoria, o motor do movimento da seiva bruta é a tensão (pressão hidrostática negativa) criada pela transpiração. Quando as células do mesófilo foliar libertam vapor de água para o exterior, em função de um gradiente de pressão de vapor entre os espaços intercelulares e a superfície da folha, o potencial hídrico da água (energia livre das moléculas) que rodeia as células do mesófilo diminui. Como consequência dessa diminuição, e das forças de coesão entre moléculas de água (ligações de hidrogênio entre as moléculas), esta vai deslocar-se das células do xilema foliar próximas (onde o seu potencial hídrico é mais elevado) para as células do mesófilo, pois a água desloca-se de zonas de potencial hídrico mais elevado (próximo de zero) para zonas de potencial hídrico mais baixo (mais negativo). Cria-se assim um gradiente de potencial hídrico que se propaga às colunas de água do xilema, desencadeando uma força de tensão que permite o movimento de água através do continuum solo-planta-atmosfera.
Devido à coesão entre moléculas de água, e à sua adesão às paredes celulares dos vasos xilemáticos, forma-se uma coluna contínua que transmite a tensão desde as células do mesófilo até às raízes, como uma escada rolante, a medida que uma molécula de água na forma de vapor é liberada no estômato outra molécula de água no estado líquido entra na raiz.
Água no solo
Para entender como as raízes fazem para absorver a água do solo, é necessário antes, que analisemos como a molécula de água se apresenta no solo e quais são suas relações com os solutos ali presentes.
A molécula de água consiste de um átomo de oxigênio ligado a dois átomos de hidrogênio. Devido ao ângulo da ligação e à carga de cada átomo, a molécula de água possui uma natureza polar, fator que a torna o principal solvente conhecido.
Além disso, cada molécula se liga às vizinhas por numerosas ligações de hidrogênio, sendo essas ligações responsáveis por muitas das propriedades físicas da água, como a coesão, tensão e adesão. Sendo resultado direto da presença dessas ligações, a coesão refere-se à atração mútua entre as moléculas, que lhes permite permanecer unidas, resistindo à separação. As moléculas de água na interface ar-água são mais facilmente atraídas para as moléculas vizinhas que para a atmosfera circundante. Como consequência dessa atração desigual, a interface ar-água tende a minimizar sua área criando uma tensão superficial, que faz com que a superfície se comporte como uma película elástica.
A tensão não apenas influencia na forma da superfície, mas pode gerar uma pressão sobre o restante do líquido, como o que acontece quando a água evapora no mesófilo foliar durante a transpiração.
Adesão coesão
Outra propriedade, a adesão, refere-se à capacidade das moléculas da água de se ligarem a outras moléculas também polares, como a parede interna dos elementos do xilema ou aos microporos (capilares) do solo, por exemplo.
Quando o conteúdo de água do solo decresce, pela evaporação ou pela absorção radicular, a interface ar-água se contrai, criando uma pressão negativa. Essa pressão é responsável pela diminuição do potencial hídrico do solo.
O potencial hídrico é uma medida da energia livre (capacidade de realizar trabalho) da água por unidade de volume. A água pura possui o mais alto potencial hídrico, que equivale a zero. Adicionando-se solutos a essa água, a energia livre é diminuída e o potencial hídrico cai, assumindo um valor negativo.
Outros fatores que podem diminuir o potencial hídrico são a pressão e a força da gravidade. No solo ou nas plantas, a água sempre vai se mover de um local com maior potencial hídrico (mais próximo de zero) para outro com menor potencial (mais negativo). É importante ressaltar que esse é um processo passivo, resultado da ação de forças físicas: não existem "bombas" que empurrem a água de um lugar para outro.
Assim, a absorção de água pelas raízes ocorre devido a uma diferença de potencial hídrico entre o solo e a raiz, de modo que a água se mova de uma região de menor pressão (solo) para uma região com maior pressão (córtex da raiz).
No solo, O movimento de água é primariamente dirigido por pressão: quando a água é removida do solo pelas raízes, a tensão da água do solo puxa mais água de áreas adjacentes, em um movimento do tipo de fluxo de massa, que consiste no movimento concertado de grupos de moléculas, em massa, em resposta à aplicação de uma força exterior, como a pressão, e só é possível graças à coesão entre as moléculas de água.
Entrada de água na raiz
Além da diferença de potencial entre solo e raiz, a entrada da água na planta é facilitada pela presença dos pelos radiculares e, quando presentes pelas inúmeras hifas dos fungos do solo que formam como um halo ao redor das faízes.
Após ter penetrado na raiz, através dos pelos radiculares, a água necessita atravessar o córtex em direção ao cilindro vascular, de onde será distribuída ao restante da planta. Durante esse trajeto, a água e os íons contidos nela podem percorrer uma ou mais das três rotas possíveis:
1. Rota apoplástica
A água move-se exclusivamente pelas paredes celulares, sem atravessar quaisquer membranas.
2. Rota transmembrana
A água passa do protoplasto de uma célula para o protoplasto de outra célula adjacente, tendo, nesse caso, de atravessar duas vezes a membrana plasmática de cada célula (na entrada e na saída).
3. Rota simplástica
A água move-se do protoplasto de uma célula para o protoplasto de outra. Entretanto, não atravessa nenhuma membrana; a movimentação ocorre pelos plasmodesmas, que são canais revestidos por membrana, que atravessam as paredes celulares, comunicando células adjacentes.
Rota simplástica
(KB)
Estrutura interna da raiz em corte transversal
(KB)
(KB)
(KB)
Anatomia da raiz
Transporte no xilema
Tendo alcançado o cilindro vascular, a água (e solutos associados) penetra as células do xilema, que é o tecido especializado na sustentação e condução das plantas vasculares.
Quando comparada à complexidade do transporte no córtex da raiz, a via no xilema parece muito simples, pois oferece pouca resistência ao fluxo. Isso se deve, em grande parte, à presença de células altamente especializadas na condução de fluidos. Dentro desses vasos, que formam um sistema de tubos interconectados ao longo de todo O corpo da planta, da raiz às folhas, é que ocorre a maior parte do transporte de água no vegetal.
Em uma planta com 1 metro de altura, por exemplo, aproximadamente 99,5% do transporte da água ocorre no xilema e, em árvores mais altas, o movimento no xilema pode representar uma porcentagem ainda maior. Esse movimento de ascensão é possível, além da diferença de potencial hídrico e da coesão já citadas, graças à adesão das moléculas da água às paredes dos vasos, que cria uma força suficientemente grande para sustentar a coluna de água ascendente por vários metros contra a gravidade. A adesão é resultado da formação de ligações de hidrogênio entre moléculas polares da água e da parede interna dos vasos, sendo responsável, por exemplo, pela ascensão de líquidos em tubos capilares, um fenômeno conhecido como capilaridade.
Resumindo o transporte pelo xilema
A combinação dessas três forças: tensão, coesão e adesão, permite manter a corrente de transpiração, responsável pela geração de um défice hídrico ao nível da raiz e consequente absorção de água.
O transporte ocorre no xilema
Vasos lenhosos
Seiva bruta = água + sais minerais
Fenômenos envolvidos no processo de transporte de água e sais
1. Pressão positiva da raiz
Absorção de água aumenta a pressão nas raízes
2. Capilaridade
A atração da água com os vasos contribui para a ascensão
da seiva.
3. Teoria da Tensão-Coesão-Adesão
Tensão da água no solo, no mesófilo folhar e córtex vascular,
Coesão entre as moléculas d´água pelas ligações de hidrogênio
Adesão das moléculas às paredes do xilema
4. Transpiração foliar
A perda de água pela transpiração reduz a pressão nas
folhas
Transporte de seiva
https://youtu.be/-b6dvKgWBVY
https://youtu.be/la92f3Lh55Y
CONDUÇÃO DE SEIVA ELABORADA
Teoria do Fluxo de massa
Esta teoria considera que a sacarose se desloca através dos vasos crivosos, devido à existência de um gradiente de concentração, desde o órgão de produção, as folhas, até aos locais de consumo que são tecidos ou órgãos em formação ou crescimento e os órgãos de reserva durante a fase de acumulação de reservas, e as raízes.
1) A glicose, produto resultante da fotossíntese, é convertida em sacarose nas folhas;
2) A sacarose desloca-se no mesófilo (local na folha onde ocorre a fotossíntese), para os elementos do tubo crivoso (floema) por transporte ativo com a ajuda da célula companheira;
3) Com o aumento de concentração da sacarose no floema dá-se uma aumento da pressão osmótica nos tecidos circundantes e a água do xilema e das células vizinhas entra por osmose nos tubos crivosos do floema aumentando a pressão de turgência e causa o deslocamento da seiva elaborada, através das placas crivosas para locais com menor pressão;
4) A sacarose passa, possivelemnte, por transporte ativo para os órgãos onde vai ser utilizada ou ser depositada como reserva. Esta saída faz com que as células dos tubos crivosos fiquem hipotónicas, a pressão osmótica desce, e a água regressa às células vizinhas e ao xilema por osmose;
5) A passagem da sacarose a todas as células será feita, posteriormente, através de transporte de citoplasma a citoplasma. É depois degradada em glicose e utilizada para a respiração celular na mitocôndria, ou polimeriza-se e forma amido (produto de reserva).(minhas-aulas).
1) Triose-P produzida na fotossíntese (nos cloroplastos) das folhas é transportada para o citossol, onde é convertida à sacarose. Durante à noite o amido deixa o cloroplasto, principalmente na forma de maltose, e é convertido à sacarose.
2) A sacarose do mesofilo se movimenta até as vizinhanças do floema, simplasticamente, de célula a célula. Esta fase é um transporte que envolve pequenas distâncias, isto é, algumas células, chamado de transporte de curta distância, a qual é provavelmente simplástica.
3) Em um processo chamado de carregamento do floema, os açúcares são transportados para os elementos crivados e células companheiras. Uma vez dentro dos elementos crivados, a sacarose é exportada. O transporte pelo sistema vascular é chamado de transporte de longa distância.
Os processos e de carregamento e descarregamento representam a força motriz para o transporte de longa distância, tendo grande importância para a produção agrícola. Uma vez que, a maior transporte de fotoassimilados para o dreno aumenta a produção de tecidos-dreno comestíveis, como os grãos dos cereais.
O carregamento do floema pode ser via apoplástica e a simplástica com aprisionamento de polímeros e simplástica passiva. O carregamento do floema não ocorre da mesma forma em todas as plantas. Em regiões de clima temperado e de clima árido predomina o carregamento apoplástico, mas em regiões de clima tropical úmido o simplástico (Kerbauy, 2004).
CONDUÇÃO DA SEIVA ELABORADA
Ocorre no floema
Vasos liberianos
Seiva elaborada = água + sacarose (fotossintatos)
Teoria de Ernest Münch
i. Relacionada à pressão osmótica dos órgãos vegetais
ii. Modelo: experimento de Münch.
Órgãos fonte e órgãos dreno
The mature leaves are the main source organs in the grapevine, although green berries contribute roughly 20% of their own sugars until the onset of ripening.1,2
The shoots (including young leaves, petioles and shoot tips), woody trunks, roots and berries are sink organs and the strength of the different sinks (i.e. the amount of sugars required of a specific sink at a specific developmental stage) change throughout the season
(wineland)
Phloem network. Osmotic flow of water into the cells of the phloem near the source cell increases the pressure locally. This drives the excess glucose away from the high concentration region through the phloem network. If, at the same time, this same substance is consumed at another leaf and its concentration locally drops, then the process is reversed: Water flows out of the phloem cells through osmosis (the low concentration is the same as too much water) and the pressure at that location drops. In this way, nutrients are delivered from source to sink, as they become available and as they are needed. On the right, photographs of a source leaf (top) and a sink leaf (bottom) belonging to transgenic Arabidopsis plants expressing green fluorescent protein (GFP) on the companion cell (CC)-specific AtSUC2 promoter are shown. Since the AtSUC2 promoter is a source leaf specific activity, no GFP is produced at the sink leaf. The GFP can move from the source leaf to the sink leaf via the phloem [reprinted with permission from Stadler et al., Plant J. 41, 319-331 (2005). Copyright 2005 Wiley]. 48 (Psaltis et al, 2016).
The pressure-flow process Pressure flow schematic Build-up of pressure at the source and release of pressure at the sink causes source-to-sink flow. At the source phloem loading causes high solute concentrations. y decreases, so water flows into the cells increasing hydrostatic pressure. y At the sink is lower outside the cell due to unloading of sucrose. Osmotic loss of water releases hydrostatic pressure. Xylem vessels recycle water from the sink to the source. (slidetodoc).
Plant growth as modeled in current Dynamic Global Vegetation Models (DGVMs; blue arrows) and based on empirical evidence (additional red dashed arrows), nutrient controls on growth and carbon (C) reserves are included in a subset of models (violet arrows). The difference between the two conceptual models is fundamental, but because many processes are correlated, plausible results can be obtained in the short term, even with a mechanistically wrong approach. (nph, Fatichi, 2012)
IMPLICAÇÕES DA CONDUÇÃO DE SEIVA
Anel de Malpighi
i. Retirada da casca
perda dos vasos do floema
ii. Ocorre acúmulo de seiva elaborada e deficiência
nutricional nas porções abaixo do anel
Relação entre absorção e condução de seiva:
FITORMÔNIOS OU HORMÔNIOS VEGETAIS
O termo hormônio é derivado do grego: ὁρμῶν, ormón que significa evocar, excitar ou estimular. Os hormônios vegetais, ou fitormônios são os principais fatores internos que regulam o crescimento e o desenvolvimento vegetal, sendo responsáveis pela comunicação entre as células, tecidos e órgãos das plantas. Entre eles temos as auxinas, as giberelinas, as citocininas, o etileno, e o ácido abscísico.
Olea europea, frutificação e maturação
AUXINAS
Ácido indolilacético (AIA)
A história da auxina inicia com Charles Darwin e Francis Darwin observando o curvamente em direção a luz de plantulas de alfalfa.
Em 1913 fisiologista dinamarquês, Boysen-Jensen descobriu que a auxina ultrapassava um bloco de gelatina mas não substancia como a mica.
Mais tarde, em 1919, Arpad Páal (Hungria) acrescentou que quando uma planta é iluminada apenas de um lado, as auxinas migram para o lado menos iluminado (do caule ou o lado onde não bate a luz) promovendo seu crescimento, originando a curvatura observada por Darwin, fornecendo mais uma evidencia de que essa substancia era de natureza química.
Fritz Warmolt Went (1926) fisiologista holandês propôs o nome de Auxina a essa substância. O nome auxina deriva da palavra grega αυξειν, auxein: crescer ou aumentar.
A auxina está presente em todas as partes de uma planta, embora em concentrações muito diferentes. A concentração em cada posição é uma informação crucial para o desenvolvimento, portanto está sujeita a uma regulamentação rígida, tanto no metabolismo quanto no transporte. O resultado é que a auxina cria "padrões" de concentração máxima e mínima de auxina no corpo da planta, os quais, por sua vez, orientam o desenvolvimento adicional das respectivas células e, finalmente, da planta como um todo.
Posteriormente descobriu-se que não era somente um mas alguns hormônios de composição bastante simples do ácido indol-acético.
Ácido indolacético (AIA) ou Ácido-Indolil-Acético (AIA) Natural
Ácido indolbutírico (IBA)
Ácido alfa-naftalenocético (ANA)
Ácido indolpropiônico (AIP)
Ácido cloroindolacético (4-Cl-AIA)
Ácido 2,4 diclorofenoxiácético (2,4D) Sintético
Ácido 2-fenilacético (APA)
Funções na planta
1) Promove distensão da parede celular vegetal
2) Atua no crescimento dos meristemas (caules e raízes)
3) Em concentrações altas, atua inibindo o crescimento dos órgãos vegetais Assim pode ser usada como herbicida.
4) Atua tanto inibindo quanto estimulando o crescimento dos caules e raízes.
Concentrações acima do ideal ocasionam a inibição do crescimento desses órgãos. Já concentrações normais de auxina ocasionam a quebra de alguns constituintes da parede celular, como os filamentos de celulose, o que causa o enfraquecimento dessas fibras. Assim, há um aumento da absorção de íons pela membrana celular e um aumento do turgor da célula, causando o alongamento desta.
5) Atua na dominância apical, onde a diferenciação das células nas gemas apicais inibe o crescimento das gemas laterais
A auxina é produzida principalmente pelo ápice do caule, i.e., no tecido meristemático apical e segue em direção a base. Nesse movimento, causa a inibição do crescimento das gemas laterais. À medida que a planta cresce e a gema apical afasta-se das laterais, a inibição é reduzida, permitindo que as gemas laterais mais distantes desenvolvam-se em galhos laterais. A remoção da gema apical (pela poda) estimula o crescimento e o desenvolvimento das gemas laterais. Assim, a poda pode estimular a produção de novos ramos laterais em árvores frutíferas e, consequentemente, aumentar a produção de flores e frutos.
6) Atua no fototropismo e no gravitropismo
O fototropismo é o crescimento da planta em direção à luz. Isso se deve ao fato da auxina migrar para a região da planta oposta ao sol. Essa maior concentração de auxina no lado mais escuro causa o alongamento dessas células, provocando a curvatura do caule para o lado iluminado. Assim, a auxina é um hormônio fotofóbico.
Charles Darwin juntamente com seu filho Francis Darwin em 1881, foram os primeiros estudios a observar que o crescimento em direção à luz das plantas se devia presença de algum componete nos tecidos que fazia que ela se inclinasse na direção da fonte de luz.
Experimento de Ch. Darvin e Francis Darwin (1881)
Substância produzida nos ápices difundia-se de coleóptilos para blocos de Agar.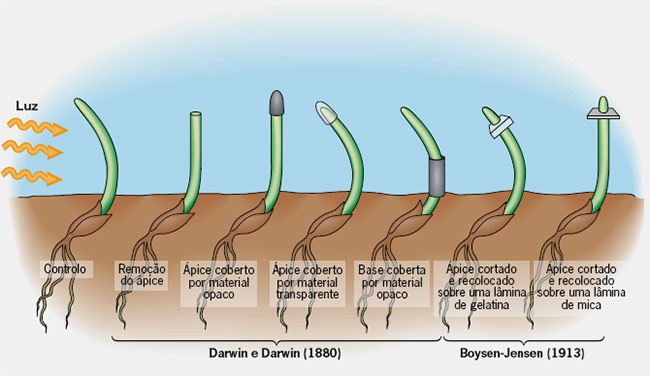
Os experimentos de Charles Darwin com plântulas da grama escura (a, b) que levaram à descoberta do fitohormônio auxina (c), uma substância promotora de crescimento produzida nas células sensíveia à luz da ponta do coleóptilo e transportada basipetalmente (do ápice para a base), onde promove o alongamento celular. As setas indicam a direção do tratamento de luz branca. (Kutschera and Niklas, 2009)
[Charles Darwin ’ s experiments with dark-grown grass seedlings ( a , b ) that led to the discovery of the phytohormone auxin ( c ), a growth-promoting substance produced in the cells of the light-sensitive tip of the coleoptile and transported basipetally, where it promotes cell elongation. Arrows denote the direction of white light treatment.]
Darwin continuou seu experimentos estendendo suas observações às raízes, e o que ele observou foi o gravitropismo.
Negative and positive gravitropism of the shoot (coleoptile)and root (radicle), respectively, in a dark-grown maize seedling (Zea mays) oriented horizontally (a). Charles Darwin analysed positive gravitropism (downward bending) of the radicle and demonstrated that roots without tips (decapitated organs) fail to respond to gravity (b).He concluded that the perception of the gravitropic stimulus isrestricted to the root tip (calyptra), whereas the growth response takes place distally. (g:vector of gravity).
O fototropismo, ou o alongamento diferencial das células exibido por um órgão da planta em resposta à luz azul direcional, fornece à planta um meio de otimizar a captura de luz fotossintética na porção aérea e a aquisição de água e nutrientes nas raízes. Avanços tremendos foram feitos em nossa compreensão das bases moleculares, bioquímicas e celulares do fototropismo nos últimos anos. Seis fotorreceptores e suas vias de sinalização associadas foram ligadas a respostas fototrópicas sob várias condições. A detecção primária da luz direcional ocorre na membrana plasmática, enquanto a fotorrecepção modulatória secundária ocorre no citoplasma e no núcleo.
As respostas intracelulares às pistas de luz são processadas para regular o movimento de auxina de célula a célula, para permitir o estabelecimento de um gradiente transgênico do hormônio. A foto sinalização também impõe a resposta da regulação da transcrição estabelecida como resultado de alterações nas concentrações locais de auxina. (Photosignaling also impinges on the transcriptional regulation response established as a result of changes in local auxin concentrations.)
Também foi demonstrado que três vias adicionais de sinalização de fitohormônio influenciam a capacidade de resposta fototrópica, e essas vias também são influenciadas pela sinalização de fotorreceptores. Aqui, discutiremos essa complexa dança de respostas intra e intercelulares que são reguladas por esses muitos sistemas para dar origem a uma resposta de adaptação rápida e robusta observada como dobramento (bending) de órgãos.
BL-Induced Phototropism in Higher Plants Requires the Establishment of a Differential Gradient of Auxin.
(A) Diagram of a hypocotyl exhibiting a phototropic response.
Auxin synthesized in the apical portions of the stem is polarly transported toward the root predominately through the central vasculature and to a lesser extent via epidermal and subepidermal cell layers (downward pointing red arrows). While in dark-grown seedlings the amount of auxin transported through the outer cell layers is not appreciably different side-to-side across the hypocotyl (data not shown), in seedlings exposed to directional BL, a differential of downward auxin flow is established (see downward pointing outer red arrows). Directional BL also induces a lateral redistribution of auxin from the lit to shaded portion of the hypocotyl (trans-hypocotyl red arrows). Together, these actions result in the differential accumulation of auxin in the elongation zone of shaded versus lit sides of the seedling (yellow shading).
(B) Cross section within the elongation zone of an Arabidopsis seedling hypocotyl illustrating the gradients of phot1 activity (false-colored white to blue) and auxin accumulation (false-colored white to yellow). Gray dots are meant to represent nuclei within the outer two cell layers, regions particularly important to auxin-mediated transcriptional responses (see Figures 3 and 4). Cells outlined in green are endodermal cells.
7) Estimula a formação de raízes adventícias;
8) Atua na diferenciação dos tecidos condutores;
9) Atua na inibição da abscisão de folha e frutos;
10) Atua no desenvolvimento dos frutos. Relembrando: o que é o fruto? O fruto surge quando o gameta feminino que esta no ovário, é fecundado pelo gameta masculino (núcleo polar); quando isso acontece o tecido do ovário é estimulado pela auxina e começa a se desenvolver formando o fruto. Ou seja após a fecundação, o embrião no interior da semente produz auxinas que agem sobre as paredes dos ovários promovendo sua transformação em fruto (fazendo as células aumentarem de volume, acumularem substancias açucaradas, desenvolvend0-se em fruto). Também controla sua permanência no caule ou sua queda quando maduro.
Desta forma, a aplicação de auxinas em flores não polinizadas também estimula o desenvolvimento de frutos, o que pode ser utilizado na agricultura, para a produção de frutos sem sementes, por ex.: melancia sem sementes e uva sem sementes.
A auxina é também produzidos pelas gemas apicais, embriões, folhas jovens e sementes.
Transporte polar: do ápice para base
Precursor da Auxina é o aminoácido triptofano.
Efeitos
AÇÃO NO CRESCIMENTO/AÇÃO HERBICIDA
Dicotiledôneas: sensíveis Monocotiledôneas: imunes
FORMAÇÃO DE FRUTOS E FRUTOS PARTENOCÁRPICOS
TROPISMO - DOMINÂNCIA APICAL
ABSCISÃO DAS FOLHAS - ENRAIZAMENTO DE ESTACAS
CULTURA DE TECIDOS (MICROPROPAGAÇÃO)
ETILENO, C2H4
Durante o século XIX, quando o gás produzido pelo carvão era utilizado para a iluminação das ruas, foi observado que as árvores próximas às lâmpadas perdiam suas folhas de forma mais acentuada que as demais.
• Posteriormente, evidenciou-se que o gás do carvão e os poluentes atmosféricos afetavam o crescimento e o desenvolvimento vegetal, tendo o etileno sido identificado como um componente ativo desse gás.
• Em 1901, Neljubov observou que plantas de ervilha cultivadas no escuro, em laboratório, apresentavam a resposta tríplice: redução no alongamento do caule, aumento do crescimento lateral (intumescimento) e crescimento horizontal anormal.
• Quando cultivadas ao ar livre, as plantas recuperavam a morfologia e a taxa de crescimento normal.
Neljubov identificou o etileno, proveniente do gás de carvão, presente no ambiente do laboratório, como a molécula causadora da resposta.
• A primeira indicação de que o etileno é um produto natural de tecidos vegetais foi publicada por COUSINS, em 1910, ao relatar que “emanações” das laranjas armazenadas em uma câmara provocavam o amadurecimento precoce das bananas. Hoje, sabe-se que laranjas produzem pouco etileno, sendo provável que as laranjas utilizadas por Cousins estivessem infectadas com o fungo Penicillium que produz grandes quantidades de etileno.
• Em 1934, GANE et col. identificaram quimicamente o etileno como um produto natural do metabolismo vegetal, o qual foi classificado como hormônio, devido aos seus drásticos efeitos sobre as plantas.
• Por 25 anos o etileno não foi reconhecido como um hormônio vegetal importante, principalmente, porque a maioria dos fisiologistas acreditava que os efeito do etileno eram devidos a ação das auxinas.
• Contudo, após a introdução da cromatografia gasosa na pesquisa do etileno em 1959, foi redescoberta a importância desse fitohormônio e reconhecido seu significado fisiológico como regulador do crescimento vegetal, (Burg & Thimann, 1959).
O etileno é amplamente produzido pelas angiospermas, Gimnospermas, licófitas, monilófitas, musgos, hepáticas, certas cianobactérias, fungos e bactérias também produzem etileno. A produção de etileno por fungos e bactérias contribui bastante para o seu teor no solo.(fisiologiavetal)
O Papel do etileno na maturação de frutos
O termo amadurecimento de frutos refere-se às mudanças no fruto que o tornam pronto para o consumo. Estas mudanças incluem o amolecimento do fruto devido à quebra enzimática das paredes celulares, à hidrólise do amido, ao acúmulo de açúcares e ao desaparecimento de ácidos orgânicos e de compostos fenólicos, incluindo os taninos.
Para as sementes cuja dispersão depende da ingestão por animais, amadurecimento e comestibilidade são sinônimos.
Uso comercial do Etileno
Tendo em vista que o etileno regula vários processos fisiológicos nas plantas, ele tem sido um dos hormônios mais usados na agricultura. Todavia devido à sua alta taxa de difusão, é muito difícil aplicar o etileno no campo sob a forma de gás, esta limitação pode ser superada com o uso de:
1) Auxinas e ACC
Ácido 1-aminociclopropano carboxílico, que podem desencadear a síntese natural de etileno e, em diversos casos, são usados na prática agrícola;
2) Utilização de compostos que liberam etileno
O composto mais utilizado é o ácido 2-cloroetilfosfônico (etefon, etrel). Este ácido libera etileno lentamente em ambiente alcalino:
A banana pertence ao género Musa, que inclui cerca de 70 espécies. No entanto, hoje em dia quase todas as bananas doces são de uma única variedade, conhecida como Cavendish. São cultivadas por reprodução assexuada para serem geneticamente idênticas.
As vezes em aula surge a dúvida se aqueles pontinhos pretos que existem no centro da banana sejam sementes ou não. Entretanto, aquelas estruturas são óvulos não fecundados. A banana cultivada é um fruto partenocárpico, ou seja, que se desenvolve sem que haja fecundação das oosferas (gametas femininos) e o ovário mesmo não havendo a fecundação se desenvolve em um fruto que pode ser usado na alimentação. Portanto a banana não possui sementes.
A perda de biodiversidade torna-as particularmente vulneráveis a ataques de parasitas, e há atualmente uma infecção por um fungo, Fusarium, que está muito disseminada e tem causado grandes perdas na produção.
Musa spp fruto partenocárpico
GIBERELINAS
As giberelinas, ou ácidos giberélicos, são um grupo de hormônios vegetais cujas principais funções estão relacionadas com a regulação da altura das plantas e a germinação das sementes.
GA
As giberelinas (GAs) são hormônios vegetais que regulam vários processos de desenvolvimento, incluindo alongamento do caule, germinação, dormência, floração, desenvolvimento de flores e senescência de folhas e frutos.
GAs é uma das classes mais conhecidas de hormônios vegetais. Acredita-se que a reprodução seletiva (embora inconsciente) de variedades de culturas deficientes na síntese de GA foi um dos principais motores da "revolução verde" na década de 1960, uma revolução que se acredita ter salvado mais de um bilhão de vidas em todo o mundo. (WP)
Estes hormônios foram descobertos no Japão a partir de estudos sobre a doença do arroz chamada de “planta boba”. Essa doença, causada por um fungo denominado Gibberella fujikuroi, causa uma coloração pálida nas plantas e um aumento do crescimento em altura, fazendo com estas apresentem uma tendência a cair. Ao cultivarem esse fungo em laboratório, os japoneses descobriram que havia uma substância produzida por eles que possuía uma atividade promotora do crescimento em vegetais. Após a purificação desses extratos fúngicos, essa substância foi caracterizada e denominada giberelina.
Mais de 100 tipos de giberelinas já foram isolados e identificados quimicamente. São sintetizadas nos tecidos jovens do sistema caulinar e em sementes em desenvolvimento, sendo transportadas provavelmente no xilema e no floema. (infoescola)
Giberelina (GA1) (WP)
A ação destes hormônios no crescimento do caule e de folhas ocorre pelo estímulo tanto da divisão como do alongamento celular. Esse efeito é mais visível em variedades de plantas com baixa estatura, chamadas de plantas anãs, que sob tratamento com giberelinas se tornam idênticas em altura às plantas normais, sugerindo que essas variedades possam apresentam uma deficiência na produção de giberelinas.
Muitas espécies de plantas apresentam sementes dormentes, ou seja, sementes que não germinam mesmo que as condições estejam favoráveis. O tratamento dessas sementes com luz ou com exposição ao frio pode levar a quebra da dormência, promovendo a germinação. Em substituição a esses tratamentos, a aplicação de giberelinas pode causar a quebra da dormência em algumas espécies, como no alface, tabaco e aveia selvagem. Este hormônio estimula o alongamento celular, permitindo que a raiz atravesse os envoltórios da semente, barreiras que restringem seu crescimento.
ÁCIDO ABSCÍSICO
O ácido abscísico é um hormônio encontrado em musgos e antóceros (com exceção das hepáticas), Licófitas e Monilófitas, vegetais superiores ou Espermatófitas e fungos. Ele atua no retardamento do crescimento e desenvolvimento desses organismos.
Ácido abscísico
Esse hormônio pode ser encontrado em todas as partes das plantas, mas, acredita-se que a sua produção ocorra nas regiões meristemáticas, nas raízes, no caule, nas flores, sendo que frequentemente altas concentrações são encontradas nos frutos, nas sementes, nas gemas e nas folhas. O transporte desse ácido para as demais regiões da planta é feito através dos vasos condutores de seiva (xilema e floema) sendo mais abundante no floema.
Esse hormônio sempre entra em ação quando o vegetal se encontra em situações adversas, como por exemplo, no inverno, estações muito secas etc. Assim que entra em ação, ele, além de atuar no retardamento e desenvolvimento dos vegetais, atua também inibindo a germinação das sementes, promovendo a senescência, a dormência das gemas e também o fechamento dos estômatos. Quando o inverno ou a estação seca passa, as condições melhoram e os vegetais voltam a crescer e a se desenvolver.
As giberelinas promovem a síntese de enzimas hidrolíticas, que degradam as substâncias de reserva presente nos cotilédones e no endosperma. Como exemplo clássico, pode-se citar a ação deste hormônio na germinação de sementes de cereais. Os grãos de cereais apresentam o endosperma composto por dois tecidos: o endosperma amiláceo, onde estão localizadas as reservas (entre elas o amido), e uma camada especializada de células que circunda o endosperma, chamada de camada de aleurona, que é rica em proteínas. O início da germinação, que ocorre devido à absorção de água pela semente, é o estímulo para a liberação de giberelinas pelo embrião, que têm como alvo as células da camada de aleurona, onde promovem a síntese de enzimas hidrolíticas que irão agir no endosperma durante a germinação. Entre essas enzimas encontra-se a α-amilase, a qual é responsável pela hidrólise do amido. Como resultado, as reservas nutritivas localizadas no endosperma são quebradas e os açúcares e outros produtos são transportados até o embrião em crescimento.
CITOCININAS
Citocininas são hormônios vegetais responsáveis pela divisão celular. As citocininas foram descobertas durante as pesquisas dos fatores que estimulam as células vegetais a se dividirem (sofrerem citocinese). Acredita-se que esses hormônios são produzidos nos meristemas das raízes, folhas e frutos jovens, além de sementes em desenvolvimento. O transporte de citocinina para as diversas partes do vegetal é feito principalmente pelo xilema.
A zeatina foi a primeira citocinina natural descoberta Letham, em 1973, isolou de extratos de endosperma imaturo de milho (Zea mays) uma substância que tinha o mesmo efeito biológico da cinetina, e identificou-a como trans-6-(4-hidroxi3-metilbut-2-enilamino)purina, a qual chamou de zeatina.
Desde a sua descoberta, as citocininas têm apresentado efeitos em vários processos fisiológicos e de desenvolvimento da planta dependendo de sua concentração, as citocininas podem agir sobre
1) A senescência foliar,
2) A mobilização de nutrientes,
3) A dominância apical,
4) A formação e a atividade dos meristemas apicais,
5) O desenvolvimento vascular,
6) Aumentando os níveis de clorofila nas folhas dos vegetais;
7) Acelerando a germinação;
8) Fazendo com que a planta produza uma maior quantidade de folhas próximas ao meristema apical;
9) Reduzindo a dominância apical (auxinas e citocininas têm efeito contrário, enquanto as auxinas inibem o crescimento das gemas laterais, as citocininas atuam induzindo essas gemas a se desenvolverem);
10) Retardando a senescência da planta, entre outros.
11) Quebra de dormência em de gemas.
12) Interação com outros organismos
Todavia o controle da divisão celular, processo fundamental no crescimento e desenvolvimento vegetais, é considerado a principal função dessa classe de reguladores de crescimento.
Germinação
Germinação de Psidium cattleianum
Fases da germinação e formação de plântula de Psidium cattleianum Sabine A. Início do desenvolvimento, abertura do opérculo; B. Emissão da radícula; C. Diferenciação da raiz e do hipocótilo; D. Emergência dos paracotilédones; D. Plântula com paracotilédones expandidos; E. Plântula normal com eofilos desenvolvidos. (tg: tegumento; o: opérculo; r: radícula; hp: hipocótilo; cl: colo; rp: raiz primária; pc: paracotilédone; ga: gema apical; ef: eofilo; ep: epicótilo; rs: raiz secundária). Figure 1: Stages of Psidium cattleianum Sabine germination and seedling formation; A. Early development, opening the operculum, B. Radicle protrusion, C. Differentiation of root and hypocotyl, D. Emergence of paracotyledons, D. Seedling with expanded paracotyledons E. Eophylls with normal seedling development. (tg: integument, o: operculum; r, radicle; hp: hypocotyl; cl: collar; rp: primary root; pc: paracotyledon; ga: apical bud; ef: eophyll; ep: epicotyl, rs: secondary root). (Gomes et alii, 2015).
FISIOLOGIA VEGETAL
NUTRIÇÃO VEGETAL
MICRONUTRIENTES E MACRONUTRIENTES
Em termos quantitativos, o ar é uma fonte de nutrientes muito mais importante que o solo. Embora a água seja a substância principal na composição da matéria vegetal (70-80%), o carbono e o oxigênio (provenientes do ar na forma de CO2) constituem 90% da matéria seca das plantas.
O solo participa com 1/20 do total dos elementos químicos que compõem a massa vegetal. Assim, dos três meios que fornecem elementos para as plantas (água, ar e solo), este último é o que apresenta menor contribuição, sendo, entretanto, imprescindível, pois fornece materiais essenciais ao desenvolvimento e produção vegetal.(nutriçãodeplantas)
Independentemente da água e do gás carbônico, as plantas necessitam dos seguintes elementos minerais para seu pleno desenvolvimento:
nitrogênio,
fósforo,
potássio,
cálcio,
magnésio,
enxofre,
boro,
cloro,
cobre,
ferro,
manganês,
molibdênio e
zinco.
Os seis primeiros (N, P, K, Ca, Mg e S) são chamados de macronutrientes, devido às maiores exigências pelas plantas em termos quantitativos. (nutriçãodeplantas)
Os outros sete (B, Cl, Cu, Fe, Mn, Mo e Zn) são ditos micronutrientes. Fica claro, porém, que, pelo critério de essencialidade, todos os nutrientes (macro ou micro) têm a mesma importância para os vegetais, sendo a falta ou insuficiência de boro ou zinco tão prejudicial ao desenvolvimento vegetal quanto a de nitrogênio.
Segundo Arnon & Stout (1939), para um elemento ser considerado essencial, ele deve satisfazer a três critérios:
a) Na ausência do elemento, a planta não completa o seu ciclo de vida;
b) O elemento não pode ser substituído por outro;
c) O elemento deve estar diretamente envolvido no metabolismo da planta, como constituinte de um composto essencial, ou ser necessário para a ação de um sistema enzimático.(nutriçãodeplantas)
Funções dos nutrientes
Cada nutriente desempenha funções definidas dentro da planta e nenhum pode ser completamente substituído por outro. Conquanto cada elemento desempenhe certas funções específicas, todos devem estar juntos para produzir melhores resultados. Deve ser lembrado, entretanto, que o efeito de cada nutriente, em particular no crescimento da planta, depende da reserva dos outros elementos essenciais (Lei do Mínimo de Liebig), e nenhum efeito de cada elemento pode ser interpretado isoladamente (Fageria, 1984).(nutriçãodeplantas)
Tabela dos macronutrientes necessários para o desenvolvimento das plantas.
Tabela dos micronutrientes necessários para o desnvolvimento das plantas.
Macro e micronutrientes para o milho.
Soluções para pesquisa.
1) Estudar o papel dos macro e micronutrientes na nutrição mineral de plantas de milho ou feijão e 2) identificar os principais efeitos da carência de alguns nutrientes minerais na nutrição da planta e a participação no desenvolvimento da mesma. Para isso deve-se ir variando o volume de cada solução na solução ofertada à planta.
Deficiencia de alguns nutrientes e seus sintomas.
METABOLISMO DO NITROGÊNIO

FIXAÇÃO DO NITROGÊNIO
O nitrogênio é o macronutriente mais abundante nos tecidos das plantas.
A atmosfera terrestre é um grande reservatório de nitrogênio, mas apesar de ser composta por aproximadamente 78% de N2, a maioria dos seres vivos não tem a capacidade de usá-lo diretamente para produzir aminoácidos (proteínas) e outras substâncias orgânicas, necessitando de compostos mais reativos como o amônio (NH4 +) ou o nitrato (NO3 -), presentes no solo.
Esses compostos não são tão abundantes quanto o nitrogênio gasoso e, por isso, a escassez de nitrogênio no solo é, normalmente, o principal fator limitante no crescimento vegetal.
A fixação de nitrogênio industrial tem um alto custo energético, pois depende da queima de combustíveis fósseis. Nesse processo, o N2 reage com o H2 na presença de metais catalisadores em alta temperatura e pressão, formando amônia (NH3). O hidrogênio, derivado de gás natural, petróleo ou carvão é o responsável pelo elevado custo energético da reação.
Apesar disso, em países desenvolvidos como nos Estados Unidos, esse processo contribui com um terço do nitrogênio fixado por ano, evidenciando as vantagens e a redução nos custos de produção em culturas que fixam o N2 atmosférico, como ocorre, por exemplo, com a soja nos cerrados do Brasil.
A fixação biológica do nitrogênio (N2) é o processo pelo qual este elemento químico é capturado da atmosfera e reduzido a NH4+, que combinado com compostos orgânicos produz aminoácidos e outras substâncias contendo nitrogênio.
A fixação do nitrogênio é catalisada pela enzima nitrogenase. Esta enzima utiliza ATP na catálise enzimática, tornando a fixação biológica um processo metabolicamente dispendioso.
A equação que resume esse processo é apresentada a seguir:
N2 + 8 e- + 16 ATP (nitrogenase) 2 NH3 + H2 + 16 ADP + 16 Pi
Bactérias fixadoras de nitrogênio podem ser de vida livre no solo como no caso da Azobacter sp e Clostridium sp e as simbiontes, i.e., que formam associações simbióticas com as plantas. As mais comuns são a Rhizobium e a Bradyrhizobium que colonizam raízes de leguminosas. A associação entre as bactérias e as plantas é altamente especializada. O resultado dessa simbiose é um solo enriquecido em nitrogênio.
Essas bactérias (rizóbios) penetram nos pelos radiculares das leguminosas quando elas ainda estão no estágio de plântulas, formando estruturas tubulares denominadas canais de infecção. Ao aumentarem de tamanho e se tornarem fixadores de nitrogênio, os rizóbios param de se multiplicar e são, então, denominados bacteróides (ou bacterióides). Com a proliferação contínua dos bacteróides e também das células corticais das raízes, surgem crescimentos tumorais, conhecidos como nódulos.
Para o funcionamento desse processo, é necessária a regulação da concentração de oxigênio (O2) nos nódulos, uma vez que esse gás é um potente inibidor irreversível da enzima nitrogenase. Todavia, as bactérias envolvidas no processo são aeróbias, o que exige a participação de uma molécula transportadora de oxigênio, a leg-hemoglobina. A leg-hemoglobina é uma hemoproteína encontrada em concentrações elevadas no citoplasma das células do nódulo (700 μM em soja), conferindo-lhes uma coloração rosada. A porção heme dessa proteína é sintetizada pelo DNA bacteriano enquanto a porção globina é sintetizada pelo DNA da planta. A leg-hemoglobina apresenta 10 vezes mais afinidade pelo oxigênio (Km ≈ 0,01 μM) do que a cadeia β da hemoglobina humana. Estudos recentes indicam que leg-hemoglobina armazena uma quantidade suficiente de oxigênio para a manutenção da respiração nodular por apenas poucos segundos, permitindo a respiração da bactéria (importante para suprir a demanda de ATP) sem que ocorra a inativação da nitrogenase.
Nas cianobactérias, a anaerobiose é possibilitada pela presença de células especializadas denominadas heterocistos. Os heterocistos são células com paredes espessadas que se diferenciam quando as cianobactérias são privadas de NH4+ . Tais células não apresentam fotossistema II, responsável pela produção de oxigênio nos cloroplastos e que poderia inativar irreversivelmente a nitrogenase. Outra relação simbiótica de grande interesse agronômico é observada entre Azolla (uma pequena "pteridófita" aquática) e Anabaena (uma cianobactéria fixadora de nitrogênio que vive nas cavidades de Azolla). Essa relação é única, pois é mantida durante todo o ciclo de vida da planta. Na Ásia, seu crescimento massivo é permitido em plantações de arroz, pois estas acabam sombreando as plantas de Azolla e, à medida que esta "pteridófita" morre, o nitrogênio é liberado para a nutrição das lavouras. A associação Azolla-Anabaena pode fixar até 0,5 kg de nitrogênio por hectare/dia, taxa suficiente para nutrir uma plantação de arroz.
Azobacter sp
Clostridium sp
Cianobacterias
Simbiônticas
Bradyrhyzobium japonicum ou
Sinorhyzobium fredii para soja e
Rhyzobium leguminosarum bv. phaseoli para feijão
https://youtu.be/nEsATXN3Wo4
Hormônios vegetais: Auxina e Giberelina
MODELO PARA REGULAÇÃO DA TRANSCRIÇÃO PELA AUXINA
(A) A nucleus of a hypocotyl cell in a dark-grown seedling with only basal levels of auxin present. ARF transcription factors, such as NPH4/ARF7 (red), are bound to DNA target sequences (AuxRE) within the nuclear DNA as heteromeric complexes with a dominant transcriptional repressor protein, such as AUX/IAA19 (gold) and a corepressor, such as TPL (orange). This complex is transcriptionally inactive, and, as such, transcription of auxin-regulated genes is repressed (red X). Also present in the nucleus is the SCFTIR1/AFB auxin receptor complex (blue-violet and light green) in its inactive ligand (auxin)-free state.
(B) A nucleus of a hypocotyl cell that is in the shaded portion of a seedling exposed to directional BL where auxin has accumulated. Elevated auxin levels stimulate the binding of AUX/IAA proteins, such as IAA19, to the SCFTIR1/AFB complex (green and light blue), which in turn promotes the polyubiquitination of the AUX/IAA protein and its subsequent degradation by a 26S proteasome (gray). Removal of AUX/IAA proteins releases the corepressor TPL and allows for homodimerization of ARF proteins, which stimulates RNA polymerase core protein activation and transcription of target genes, such as TSI genes.
A Cellular Model for Auxin-Mediated Differential Cell Elongation in Phototropically Stimulated Hypocotyls.Initial photosensory events in phototropism result in a redistribution of auxin (yellow shading) such that it accumulates in the cells within the elongation zone of the hypocotyl farthest from the incident light (see Figures 1 and 2). Differential accumulation of auxin leads to the homodimerization and activation of NPH4/ARF7 (red and green nuclear proteins) in a graded fashion across the hypocotyl through auxin-mediated degradation of the IAA19 (gold) repressor protein and release of the corepressor TPL (orange) (see Figure 3). This differential in ARF activity thus results in the expression of tropic stimulus-induced genes, such as EXPANSINs (EXP), in the cells where auxin levels have increased beyond a threshold necessary to stimulate AUX/IAA degradation. EXP mRNAs (blue) are then translated into EXP protein, which is then deposited in the cell wall such that EXP protein accumulates beyond its basal level found in unstimulated seedlings (e.g., like that observed in the lit flank; red EXP ball) in regions farthest from the incident light stimulation. Increased auxin levels also stimulate (again in a graded fashion across the hypocotyl) a plasma membrane–localized H+-ATPase (purple) that pumps H+ out of the cell such that the extracellular matrix is acidified, a process that in turn activates the enzymatic activity of the EXP proteins in the wall to promote cell elongation.
Um modelo celular para alongamento celular diferencial mediado por auxina em hipocótilos estimulados fototropicamente. Eventos fotossensíveis iniciais no fototropismo resultam em uma redistribuição da auxina (sombreamento amarelo), de modo que se acumula nas células dentro da zona de alongamento do hipocótilo mais distante da luz incidente (veja as figuras 1 e 2). O acúmulo diferencial de auxina leva à homodimerização e ativação de NPH4 / ARF7 (proteínas nucleares vermelhas e verdes) de forma graduada no hipocótilo, através da degradação mediada por auxina da proteína repressora IAA19 (ouro) e liberação do Tpressor Corepressor (laranja) (veja a figura 3). Este diferencial na atividade da IRA resulta, portanto, na expressão de genes induzidos por estímulo trópico, como EXPANSINs (EXP), nas células em que os níveis de auxina aumentaram além do limite necessário para estimular a degradação de AUX/IAA. Os mRNAs EXP (azuis) são então traduzidos para a proteína EXP, que é então depositada na parede celular, de modo que a proteína EXP se acumule além do nível basal encontrado em mudas não estimuladas (por exemplo, como a observada no flanco iluminado; bola vermelha de EXP) nas regiões mais distante da estimulação da luz incidente. Níveis aumentados de auxina também estimulam (novamente de forma gradual no hipocótilo) uma H+ATPase localizada na membrana plasmática (roxa) que bombeia H + para fora da célula, de modo que a matriz extracelular é acidificada, um processo que por sua vez ativa a atividade enzimática das proteínas EXP na parede para promover o alongamento celular.
Went's classical experiment on the diffusion of auxin activity from unilaterally illuminated oat coleoptile tips (Went 1928), was repeated as precisely as possible. In agreement with Went's data with the Avena curvature assay, the agar blocks from the illuminated side of oat (Avena sativa L. cv. Victory) coleoptile tips had, on an average, 38% of the auxin activity of those from the shaded side. However, determination of the absolute amounts of indole-3-acetic acid (IAA) in the agar blocks, using a physicochemical assay following purification, showed that the IAA was evenly distributed in the blocks from the illuminated and shaded sides. In the blocks from the shaded and dark-control halves the amounts of IAA were 2.5 times higher than the auxin activity measured by the Avena curvature test, and in those from the illuminated half even 7 times higher. Chromatography of the diffusates prior to the Avena curvature test demonstrated that the amounts of two growth inhibitors, especially of the more polar one, were significantly higher in the agar blocks from the illuminated side than in those from the shaded side and the dark control. These results show that the basic experiment from which the Cholodny-Went theory was derived, does not justify this theory. The data rather indicate that phototropism is caused by the light-induced, local accumulation of growth inhibitors against a background of even auxin distribution, the diffusion of auxin being unaffected.
O experimento clássico de Went sobre a difusão da atividade da auxina a partir de pontas de coleóptilos de aveia com iluminação unilateral (Went 1928) foi repetido da maneira mais precisa possível. De acordo com os dados de Went com o ensaio de curvatura de Avena, os blocos de ágar do lado iluminado das pontas de coleóptilos de aveia (Avena sativa L. cv. Victory) tinham, em média, 38% da atividade de auxina daqueles do lado sombreado. No entanto, a determinação das quantidades absolutas de ácido indol-3-acético (IAA) nos blocos de ágar, usando um ensaio físico-químico após a purificação, mostrou que o IAA estava distribuído uniformemente nos blocos pelos lados iluminados e sombreados. Nos blocos das metades sombreadas e de controle escuro, as quantidades de IAA foram 2,5 vezes maiores do que a atividade da auxina medida pelo teste de curvatura de Avena, e nos blocos da metade iluminada até 7 vezes maiores.
A cromatografia dos difusados antes do teste de curvatura de Avena demonstrou que as quantidades de dois inibidores de crescimento, especialmente o mais polar, eram significativamente maiores nos blocos de ágar do lado iluminado do que naqueles do lado sombreado e no controle escuro.
Esses resultados mostram que o experimento básico do qual a teoria de Cholodny-Went foi derivada não justifica essa teoria. Os dados indicam que o fototropismo é causado pelo acúmulo local de inibidores de crescimento induzido pela luz em um contexto de distribuição uniforme de auxina, não sendo afetada a difusão da auxina.
MOVIMENTO DAS PLANTAS
Darwin e sua pesquisa sobre o movimento das plantas.
Em 1880, Darwin publicou um livro intitulado: "The Power of Movement in Plants" (O poder do movimento nas plantas), um livro que descreve seus estudos sobre movimentos de plantas. Neste livro, Darwin descreveu vários métodos para observar os movimentos das plantas. Esses métodos eram relativamente simples e permitiram a ele realizar centenas de experimentos com inúmeras espécies de plantas em vários locais de sua casa.
Todos os livros de Darwin foram traduzidos em formato digital e podem ser encontrados no site da British Library - Darwin (British Library - Darwin).
Esta postagem fornece um procedimento que tenta reproduzir um dos métodos que Darwin usou para registrar os movimentos da planta.
Materiais requisitados
Arame fino ou outro material filamentoso rígido
Um pedaço de plástico transparente (ou vidro)
Algumas sementes
Recipiente de crescimento (vaso)
Meio de crescimento (húmus ou solo)
Cola ou outro material adesivo
Papel
Uma caneta de marcação
O princípio
("O que serve de base a alguma coisa; causa primeira, raiz, razão")A maioria das plantas se move tão lentamente para estar além do alcance da atenção da maioria dos seres humanos. Para monitorar esse movimento da planta, Darwin percebeu que seria benéfico se o movimento pudesse ser amplificado.
Para realizar a ampliação sem o auxílio de tecnologia sofisticada, ele desenvolveu uma abordagem simples que se baseava no uso da distância entre um ponto de referência, a parte da planta em questão e o ponto de vista dos espectadores ou observadores.
Darwin conseguiu (realizou), isso anexando uma extremidade de um filamento de vidro fino a uma planta com uma pequena gota de cera preta ou um pequeno triângulo de papel preso à outra extremidade do filamento.
Várias polegadas atrás da planta, ele colocou um pedaço de papel (anteparo de papel) no qual desenhou um pequeno ponto.
Ele então colocou um pedaço de vidro vários centímetros na frente da planta.
Vendo a planta através do vidro com um olho e movendo a cabeça até que a bola de cera preta estivesse na linha do local com (in the line of site) o ponto no papel, (i.e., o ponto no anteparo do papel e a bola de cera preta estivesse alinhados com o olho) ele poderia marcar um ponto no vidro de forma que estivesse alinhado com a referência e a bola de cera (na mesma linha de visada estariam o olho, a bola de cera e o ponto desenhado no papel do anteparo atras da planta).
Ele registraria o tempo próximo à marca que acabou de fazer. Observando a planta da mesma maneira em momentos diferentes, foi possível detectar movimentos muito pequenos, observando o deslocamento dos pontos desenhados no vidro.
Alterando a distância entre a planta e o vidro, foi possível alterar a ampliação dos movimentos.
Juntando as peças
(Putting it together)Usando a descrição acima e os diagramas a seguir, que mostram o arranjo básico usado por Darwin, deve ser possível recriar o experimento de Darwin. No entanto, em vez de tentar montar placas de vidro verticais, recomendamos o uso de acrílico transparente (acrílico = Plexiglass) para segurança. Uma alternativa que funciona bem e é mais fácil de configurar é um aquário de 10 galões (37,85 litros) ou mais. Com um aquário, a planta pode ser colocada dentro e o ponto de referência marcado na parte de trás. O vidro frontal pode ser usado para marcar os movimentos. Você pode colocar uma folha de acetato transparente na parte frontal. Ao gravar o acetato claro (com a caneta marcadora) no vidro frontal, você pode remover as marcações para facilitar a análise.
A legenda da figura original de Darwin (Fig. 96, página 233) diz "Dianthus caryophyllus: circunutação de folhas jovens, traçada das 22h15 de 13 de junho às 22h35, 16h. O ápice da folha estava, no final de nossas observações, a 8 3/4 polegadas o vidro vertical, de modo a não ser muito ampliado. A folha tinha 5 1/4 de polegada de comprimento. Temp. 15 1/2 o-17 1/2 ºC."
A figura mostra o curso altamente tortuoso e em zigue-zague, juntamente com alguns loops, realizados durante 2 dias e meio. Como a folha continuava se movendo o tempo todo para a esquerda, é evidente que a linha em zigue-zague representa muitas circunutações.
Poder do movimento nas plantas.
1 Types of leaf movements. A Nyctinastic movements of the terminal pinnae of the compound leaf of Samanea saman (Jacq.) Merrill. Insets A schematic drawing of a pulvinus: E extensor, F flexor, vb vascular bundle, P II , P III secondary and tertiary pulvini, ra rachilla, rs rachis (reproduced with permission, Moshelion et al. 2002a).
B Seismonastic and nyctinastic leaf movement of Mimosa pudica L.: p pinnae, P I primary pulvinus; other abbreviations as in A (reproduced with permission, Fromm and Eschrich 1988b).
C Primary (laminar) leaves of Phaseolus vulgaris L., showing paraheliotropism in the field (reproduced with permission, Berg 1986). Note the movement of the leaf blades (arrows), adjusting the angle of the incident light (dashed arrows) at the indicated hours. A "purely" nyctinastic movement in the laboratory would occur between a horizontal and a vertical-down position of both leaves (not shown).
Os movimentos periódicos diários das folhas das plantas, conhecidos desde a antiguidade, são manifestações dramáticas de “motores osmóticos” regulados pelo relógio biológico endógeno e pela luz, percebida pelo fitocromo e, possivelmente, pelas fototropinas. Tanto os movimentos reversíveis quanto sua regulação geralmente ocorrem em órgãos foliares motores especializados os pulvini.
THE POWER OF MOVEMENT IN PLANTS.
BY CHARLES DARWIN, LL.D., F.R.S.
ASSISTED BY FRANCIS DARWIN.
WITH ILLUSTRATIONS.LONDON. 1880.
(LL.D., F.R.S.: Legum Doctor: Doutor honoris causa;
F.R.S.: Fellow or Royal Society)
1) Quando os vegetais encontram condições ideais de desenvolvimento, ocorre o crescimento e o desenvolvimento deles. Geralmente, o crescimento das plantas e aumento de sua massa são irreversíveis e se dão através das várias multiplicações celulares por meio de mitoses, fazendo com que haja uma distensão, ou seja, um aumento do volume celular. Os fatores que interferem no desenvolvimento de um vegetal podem ser internos, como alterações genéticas, taxas de hormônios e vitaminas, ou externos, como a intensidade da iluminação, a disponibilidade de água e a temperatura do ambiente em que a planta se encontra. Dentre os hormônios vegetais que viabilizam o desenvolvimento do vegetal, aquele que potencializa a germinação é
(a) AIA.
(b) giberelina.
(c) etileno.
(d) ABA.
(e) GH
2) Uma gimnosperma conhecida como cedrinho (Cupressus lusitanica) é uma opção de cerca-viva para quem deseja delimitar o espaço de uma propriedade. Para isso, mudas dessa espécie são plantadas a intervalos regulares. Podas periódicas garantem que o espaço entre as mudas seja preenchido, resultando em uma cerca como a ilustrada na imagem. Para se obter uma cerca-viva de altura controlada, que crie uma barreira física e visual, deve-se:
(a) estimular a produção de auxinas pelas gemas laterais das plantas, podando periodicamente a gema apical.
(b) estimular a produção de auxinas pela gema apical das plantas, podando periodicamente as gemas laterais.
(c) inibir a produção de auxinas pela gema apical e pelas gemas laterais das plantas, podando periodicamente as gemas laterais e a gema apical.
(d) inibir a produção de auxinas pela gema apical das plantas, podando periodicamente as gemas laterais.
(e) inibir a produção de auxinas pelas gemas laterais das plantas, podando periodicamente a gema apical.
3) A regulação metabólica nos vegetais ocorre, principalmente, pela ação dos fitormônios. É comum vermos algumas pessoas embalar, em folhas de jornais, frutos ainda verdes para que esses possam amadurecer. Qual é o fitormônio, produzido naturalmente pelo fruto, que estimula o seu amadurecimento?
(a) Etileno.
(b) Auxina.
(c) Giberelina.
(d) Ácido abscísico.
(e) Citocinina.
4) A luminosidade é um fator de grande influência no crescimento dos caules pois, normalmente, eles têm um crescimento em direção à luz, o chamado fototropismo positivo. Assinale a alternativa que contém o nome do principal hormônio vegetal envolvido no fototropismo positivo dos caules.
(a) Noradrenalina.
(b) Citosina.
(c) Giberelinas.
(d) Auxina.
(e) Etileno.
5) Os hormônios vegetais possuem papel vital na fisiologia de todas as espécies botânicas. Sobre este assunto, analise a tabela abaixo. Está(ão) correta(s):
(a) 1, 2 e 4, apenas.
(b) 1, 2 e 3, apenas.
(c) 1, 4 e 5, apenas.
(d) 2, 3, 4 e 5, apenas.
(e) 1, 2, 3, 4 e 5.
6) Quais características classificam um ser vivo com sendo um vegetal, ie., uma planta terrestre (Embryophyta)?
Cite os 4 grandes grupos de plantas e suas características distintivas. Quais são consideradas mais simples e quais são mais completas?
7) Cite as funções das seguintes partes de uma planta:
Raiz, Caule, Folha, Fruto, Flor, Semente.
8) O que é xilema e floema? Qual sua função?
9) Cite cinco (5) hormônios vegetais e dê suas funções.
Bibliografia
Hilhorst HWM, Groot SPC, Bino RJ. 1998. The tomato seed as a model system to study seed development and germination. Acta Botanica Neerlandica 47: 169–183.
FERRI, M. G. (Coord.) Fisiologia Vegetal, volumes 1. e 2. 2nd ed. São Paulo: EPU, 1985,
361p.
HOPKINS, W. G. Introduction to Plant Physiology. 2nd ed. New York: John Wiley & Sons,
Inc., 2000, 512p.
SALISBURY, F. B., ROSS, C. W. Plant Physiology. 4th ed. California: Wadsworth
Publishing Company, Inc., 1991, 682p.
TAIZ, L., ZEIGER, E. Plant Physiology. 1st ed. California: The Benjamin/Cummings
Publishing Company, Inc., 1991, 559p.
Raven, P., Evert, R. e Eichhorn, S. (2013) Biology of Plants, 8ª Ed., W.H. Freeman and Company / Worth Publishers.
Waterstrider
Water striders spend all their life on the surface of water, and the secrets of their ability to "skate" on the water surface have been discovered more than a decade ago. It is only recently that scientists began to study the biomechanics of nearly vertical jumps that water strider perform on water surface to escape from underwater predators such like fishes or backswimmers (Koh and Yang et al. Science 2015). But do they always succeed?
Anedotinhas
Nutrição
https://darwinsflowers.wordpress.com/exhibit/movements-and-habits-of-climbing-plants/
https://www.ufjf.br/fisiologiavegetal/files/2018/07/6_7-Fixa%c3%a7%c3%a3o-Biol%c3%b3gica-do-N2.pdf
https://upload.wikimedia.org/wikipedia/commons/7/7d/Darwin_-_On_the_movements_and_habits_of_climbing_plants_Fig06.jpg
https://www.researchgate.net/figure/Types-of-leaf-movements-A-Nyctinastic-movements-of-the-terminal-pinnae-of-the-compound_fig1_226315300
https://plantsinmotion.bio.indiana.edu/plantmotion/projects/darwin/darwinspmp.html
https://www.bl.uk/learning/timeline/item126813.html
http://www.plantcell.org/content/26/1/38
https://www.lib.utah.edu/collections/rarebooks/exhibits/past/evolutionofdarwin.php
Hormônios vegetais
http://www.fisiologiavegetal.ufc.br/Aulas%20em%20PDF%20PG/Unidade%20XIX.pdf

















































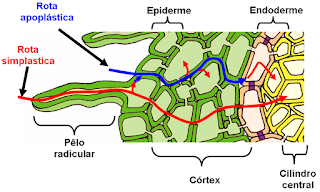

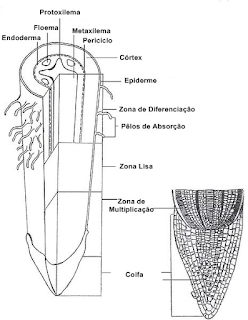



















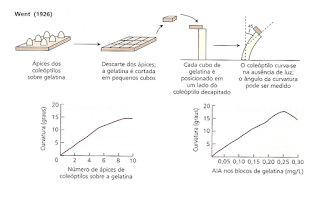




















































0 comentários:
Postar um comentário